冷冻处理对大豆分离蛋白结构和乳化性质的影响
2021-01-13胡海玥闫可心赵娅柔何琳琳汪建明
胡海玥,闫可心,赵娅柔,何琳琳,汪建明*
(1.天津科技大学食品科学与工程学院,天津 300457;2.天津市利民调料有限公司,天津 300000)
大豆分离蛋白(soybean protein isolate,SPI)是一种全价粉状食品原料和食品添加剂,是将低温脱溶豆粕作为原材料[1],经过一系列加工生产出来的。其蛋白质含量超过90%[2],并包含人体必需的20种氨基酸[3],具有较高的营养价值。大豆分离蛋白因其原料成本低、来源较为广泛[4],在食品工业生产中应用较多[5-6]。大豆分离蛋白是一种表面活性剂,可以降低水和油的表面张力,形成稳定的乳状液,所以常被作为乳化剂应用在冷冻食品中。冷冻是食品工业生产和日常生活中食物保藏最主要的手段[7],然而在实际生活和工业生产过程中,大豆分离蛋白在冷冻处理后会发生一定的变性[8],影响含有或添加大豆分离蛋白食物的口感和质量。这些因素严重阻碍了工业上对冷冻食品的开发和销售。
蛋白质在外力作用下较容易聚集[9]。当外部环境发生变化时(如热处理,离子强度变化或冷冻)[10],蛋白质内部的活性基团可能会暴露出来,引起共价和非共价聚集。然而,目前对大豆分离蛋白的研究多数集中在糖基化、热处理、超声和高压等方面[11-15]。Ahmed Taha等[10]研究不同超声乳化条件对含中链甘油三酸酯(medium chain triglycerides,MCT)的大豆分离蛋白乳液的理化性质的影响,发现高强度超声(high intensity ultrasound,HIU)可以辅助生产出稳定的大豆分离蛋白乳化液。左颖昕等[12]研究葡萄糖接枝对大豆分离蛋白功能特性和结构的影响,研究发现糖基化改性大豆分离蛋白质后,其二级结构和空间结构发生了变化,并且发生了美拉德反应。本文从大豆分离蛋白的微观结构的变化入手,应用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、内源荧光光谱以及傅立叶红外光谱等方法,探究冷冻条件对大豆分离蛋白和乳状液的粒径分布、微观结构和稳定性的影响,并对照样品进行比较,以期为工业上优化冷冻植物蛋白方法提供理论支持。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白(蛋白含量90%以上):河北塞亿生物科技有限公司;罗丹明B(分析纯)、考马斯亮蓝(R250,指示剂):北京Solarbio科技有限公司;磷酸氢二钠、磷酸二氢钠(分析纯):北京鼎国生物技术有限公司;过硫酸铅(分析纯):上海研域生物科技有限公司;十二烷基磺酸钠(sodium dodecyl sulfate,SDS)(分析纯):生工生物工程有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
海尔电冰箱(BCD-175F):青岛海尔股份有限公司;荧光分光光度计(RF-5301pc):日本津岛公司;紫外-可见分光光度计(SP-752)、电泳仪(DYY-12):上海舜宇恒平科技仪器有限公司;紫外可见分光光度计(Evolution300):Thermo Fisher Scientific公司;傅里叶红外光谱仪(NICOLET IS50):德国Thermo Scientific公司;Tuibiscan ASG静态多散射稳定性分析仪:北京朗迪森科技有限公司;倒置荧光显微镜(CKX41):日本日立公司。
1.3 方法
1.3.1 冷冻大豆分离蛋白的制备
将大豆分离蛋白与水按比例混合,使其蛋白浓度为0.04 g/mL,在室温(25℃)下利用磁力搅拌使其充分混合均匀,静置20 min。移入容器(长×宽为40 cm×20 cm)中,在-5℃和-20℃下冷冻。将冷冻后的大豆分离蛋白在室温(25℃)下使用相同流速的水流解冻。将解冻后的大豆分离蛋白放入鼓风干燥箱中在40℃下烘干8 h,烘干后的样品进行粉碎,过筛(80目),放入干燥器中储存备用。
1.3.2 大豆分离蛋白分子量的测定
利用SDS-PAGE电泳对大豆分离蛋白的分子量进行测定[16],得到冷冻处理后的大豆分离蛋白SDSPAGE电泳图。
1.3.3 大豆分离蛋白三级结构测定
使用荧光分光光度计测定大豆分离蛋白的三级结构。将待测样品溶于0.01 mol/L、pH值为7.0的磷酸盐缓冲液中,配制成1 mg/mL的溶液。在激发波长为290 nm、灵敏度为2 nm、狭缝为5 nm的条件下,以蛋白质内部荧光基团作为荧光光谱探针,空白对照为磷酸盐缓冲液,测定发射波长在300nm ~400nm的荧光光谱,得到冷冻诱导大豆分离蛋白聚集体的荧光光谱图。
1.3.4 大豆分离蛋白二级结构的测定
准确称量1 mg大豆分离蛋白样品和充分干燥的溴化钾150 mg(105℃,8 h),充分混合后研磨至粉末,并压制成透明薄片,使用红外光谱仪进行全波段扫描(4 000 cm-1~400 cm-1),以空气为背景,设定4 cm-1分辨率,扫描16次,并通过傅立叶变换得到样品红外光谱图。
1.3.5 大豆分离蛋白乳状液的制备
将大豆分离蛋白样品溶于去离子水中,配制0.002 g/mL大豆分离蛋白去离子水溶液,磁力搅拌2 h(25℃)后以油水比1∶3(体积比)缓慢加入大豆色拉油得到混合液,加入0.25%(基于混合液体积)的0.02%叠氮化钠,混合均匀后放入高速剪切均质机中,在12 000 r/min条件下处理3 min,制得均匀的大豆分离蛋白乳状液[17]。
1.3.6 大豆分离蛋白乳状液液滴分布测定
参考Feng等的方法[18],测定大豆分离蛋白乳状液粒径。
1.3.7 大豆分离蛋白乳状液微观形态观察
采用倒置荧光显微镜观察大豆分离蛋白乳状液的微观形态[19]。将制备好的样品乳状液取0.5 mL滴在载玻片上,用罗丹明B染色,小心盖上盖玻片,迅速放入倒置荧光显微镜下,对乳状液微观形态进行观察和拍照。
1.3.8 大豆分离蛋白乳状液稳定性动力学指数测定(turbiscan stability index,TSI)
量取大豆分离蛋白乳状液25 mL,放入Turbiscan测试瓶中。冷冻大豆分离蛋白分散液的稳定性动力学指数应用静态多散射稳定性分析仪进行测定[19]。取0.1 g样品放入30 mL 0.01mol/L pH 7.0的磷酸盐缓冲液中,磁力搅拌2 h(25℃)后放入Turbiscan测试瓶中。在温度26℃,30 min扫描1次,测定6 h。以未冷冻处理的大豆分离蛋白作为对照组。
1.3.9 统计分析
所有试验均重复测定3次,试验数据通过Excel 2007和Orign 8.0进行统计分析。使用Adobe Photoshop CS6对图片进行处理。
2 结果与分析
2.1 冷冻处理对大豆分离蛋白分子量的影响
为探究经过冷冻处理后的大豆分离蛋白分子量的变化,对冷冻处理后的大豆分离蛋白作SDS-PAGE凝胶电泳分析结果见图1。

图1 0.04 g/mL大豆分离蛋白冷冻处理后的SDS-PAGE电泳图Fig.1 SDS-PAGE electrophoresis pattern of 0.04 g/mL SPI after freezing treatment
7S和11S是大豆分离蛋白的两种重要组成成分。11S是通过二硫键将一个酸性(A亚基)和一个碱性(B亚基)多肽链连接而形成。7S主要是通过疏水相互作用,将α′、α、和β亚基相互连接而成。如图1所示,将通道2、3、5、6与通道1进行对比,发现其样品中的亚基组成与对照组相似,主要亚基均为7S和11S,变化并不显著。这说明大豆分离蛋白经-5℃和-20℃冷冻处理后,产生的变性多数为可逆变性[20],但通道4的条带较为分散,说明长时间的冷冻处理会使大豆分离蛋白产生不可逆变性。且所有冷冻后的样品与未经冷冻相比,条带都有所变浅,证明冷冻使大豆分离蛋白都产生了聚集行为,形成了不溶性的聚集体,从而导致分子量的变化。
2.2 冷冻处理对大豆分离蛋白三级结构的影响
内源荧光性质可以显示因蛋白质聚集导致的蛋白分子内部各基团距离减少的变化,而引起蛋白质内源荧光发射光谱的主要氨基酸残基为色氨酸。因此,通过内源荧光发射光谱能够反映色氨酸微环境的极性变化过程,且通过内源荧光光谱中最大峰的荧光强度和位置的变化,可以较为准确地判断蛋白质在三级结构水平上的构象变化情况[21]。图2显示了冷冻处理对大豆分离蛋白聚集体荧光强度的影响。
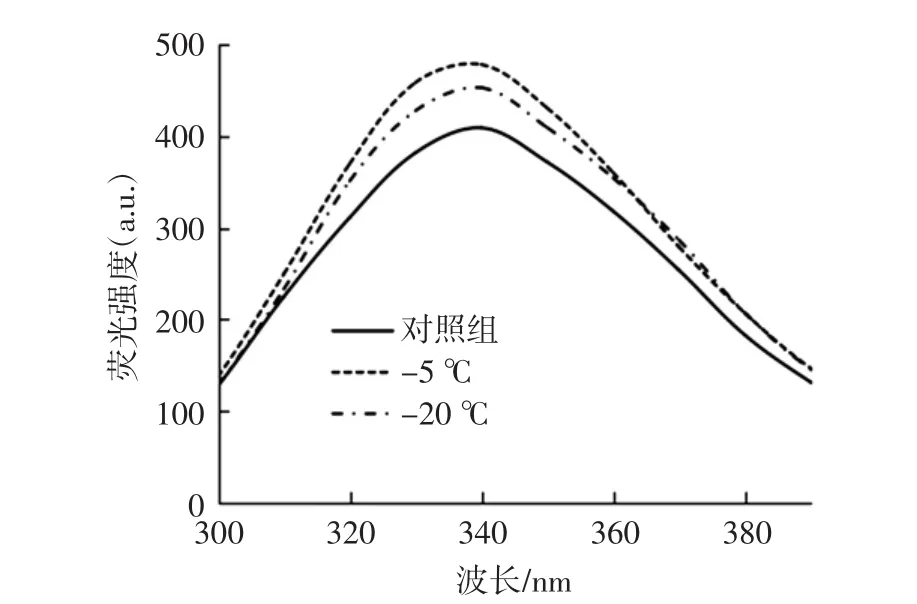
图2 冷冻处理大豆分离蛋白聚集体的荧光光谱图Fig.2 Fluorescence spectrum of aggregates of frozen induced SPI
色氨酸残基所在的微环境决定了其最大的吸收波长,若大部分的色氨酸残基被蛋白分子内部的非极性环境所包围,则其最大吸收波长小于330 nm;若色氨酸残基处于蛋白分子外部的极性环境中,表明色氨酸残基不再被蛋白分子的非极性环境所包围或包围强度变得更加松散,则其最大吸收波长将大于330 nm[22]。由图2可以看出,所有样品的最大吸收波长均大于330 nm。而在-5℃下处理的样品最大吸收峰的峰壁高于-20℃条件下的峰,最大吸收峰红移程度更大,且最大吸收峰的峰强更高,这种现象表明色氨酸残基的微环境极性增加了,即荧光基团更多地暴露在溶液中,蛋白质聚集会导致蛋白分子内部的基团之间的距离降低,从而引起内源荧光强度的变化。以上结果表明,冷冻导致蛋白质聚集,从而改变了大豆分离蛋白的三级构象。
2.3 冷冻处理对大豆分离蛋白二级结构的影响
蛋白质的二级结构由不同类型的氢键所构成。这些氢键在主肽链中组成具有规则性的周期空间构象,构成了二级结构的基本单元。傅立叶红外光谱中的酰胺I带可以表征蛋白质的二级结构。冷冻诱导大豆分离蛋白的傅立叶红外吸收光谱图见图3。

图3 冷冻诱导大豆分离蛋白的傅立叶红外吸收光谱图Fig.3 FT-IR spectroscopy of SPI induced by frozen
从图3不同样品的吸收峰的峰形和吸光度变化可以判断出,冷冻处理引起了大豆分离蛋白二级结构的变化。为了探究蛋白质二级结构单元的变化程度,对酰胺I谱带的吸收峰(1 600 cm-1至1 700 cm-1)进行了基线校正。对每个样品光谱进行分析,结果如表1所示。
由表1可知,蛋白质的二级结构主要由主链上的羰基和酰胺基之间的氢键所维持,主要由:α-螺旋、β-折叠、β-转角和无规卷曲所组成。当蛋白质所在环境变化,蛋白质分子会进行构象重排以达到稳定状态。未经处理的大豆分离蛋白的β-类型结构82.92%,其中β-折叠和β-转角的含量分别为32.71%和50.21%,而α-螺旋和无规卷曲相对较少,分别为9.90%和7.18%。经冷冻处理后,样品的β-类型结构均少于80%,β-折叠的含量增加,β-转角的含量降低,表明冷冻可能会导致蛋白质聚集。而α-螺旋和无规卷曲含量的增加表明蛋白质聚集为无序结构。结果表明,冷冻处理后蛋白质变性,导致不同程度的蛋白质聚集,从而对二级结构产生影响。
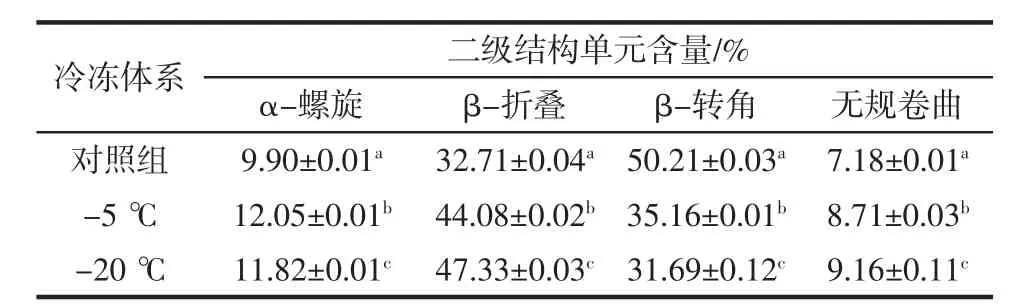
表1 冷冻对大豆分离蛋白二级结构单元含量计算结果的影响Table 1 Effect of freezing on secondary structure element content of SPI
2.4 冷冻处理对大豆分离蛋白乳状液的液滴分布的影响
经冷冻处理后的大豆分离蛋白容易产生聚集,从而影响大豆分离蛋白的乳化特性。利用粒径分布可以判断冷冻对大豆分离蛋白乳状液的影响。乳状液的粒径分布如图4所示。

图4 冷冻处理对大豆分离蛋白乳状液粒径分布的影响Fig.4 Effect of freezing on particle size distribution of SPI emulsion
从图4中可以看到,经冷冻处理后的大豆分离蛋白所形成的乳状液的液滴粒径分布变化较大。未经处理大豆分离蛋白乳状液中粒径分布最集中且粒径最小,大多数在20 μm以下。冷冻处理后的大豆分离蛋白形成的乳状液粒径分布与对照组相比较为靠右,峰型变宽,多数粒径分布在10 μm ~50 μm之间,经-5℃冷冻后的大豆分离蛋白所形成的乳状液粒径峰值接近19 μm,而-20℃的粒径峰值为30 μm。表明经冷冻处理,乳状液粒径变大,分布变得较为分散。说明乳状液中存在冷冻诱导形成的蛋白聚集体[23],且聚集体并未因为均质剪切而被破坏。
2.5 冷冻处理对大豆分离蛋白乳状液的微观形态影响
通过对蛋白乳状液的界面性质进行研究,可以了解蛋白的乳化性质和乳化能力。冷冻大豆分离蛋白乳状液的微观形态图片经过Adobe Photoshop CS6软件的黑白处理,如图5所示。

图5 大豆分离蛋白乳状液的微观形态图Fig.5 Microscopic morphology of frozen SPI emulsion
由图5可以看出,在大豆分离蛋白的乳状液中,形成的是水包油型的乳状液。在未经冷冻处理的大豆分离蛋白形成的乳状液中,油滴分布小而均匀,表明乳化效果好。未经冷冻处理的大豆分离蛋白形成的乳状液与经过冷冻的相比具有更强的乳化能力。经-5℃和-20℃处理的大豆分离蛋白乳状液的荧光分布因为乳状液中有蛋白聚集体的存在而不均匀,这与傅里叶红外光谱和粒径分布结果一致。
2.6 冷冻处理对大豆分离蛋白乳状液稳定性的影响
通过对冷冻大豆分离蛋白乳状液进行的微观形态分析,发现对冷冻大豆分离蛋白进行乳化,并不能破坏其存在的聚集体结构,因此对大豆分离蛋白乳状液进行稳定性研究见图6。
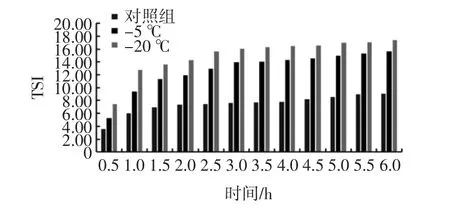
图6 冷冻温度对大豆分离蛋白乳状液稳定性动力学指数的影响Fig.6 Effect of freezing temperature on the stability kinetics index of SPI emulsion
稳定性动力学指数值越小,说明乳状液越稳定。由图6可以看出,未经冷冻的大豆分离蛋白形成的乳状液最为稳定,经过冷冻处理后的蛋白形成的乳状液的稳定性都发生了不同程度的降低。查阅文献[24-25]后发现,可能是蛋白质形成了一些低粒径的可溶性聚集体,从而引发乳状液的沉降;因此,与未经处理的大豆分离蛋白乳状液比较,冷冻处理后的大豆分离蛋白乳状液的稳定性较差。
3 结论
本文通过对冷冻大豆分离蛋白进行研究,利用SDS-PAGE凝胶电泳、内源荧光光谱、傅立叶红外光谱的测定,研究冷冻处理对蛋白的分子量、蛋白三级结构和二级结构的影响变化,结果表明冷冻使大豆分离蛋白产生的可逆变性;大豆分离蛋白三级构象发生变化;冷冻后的大豆分离蛋白的结构向无序化发展。为了解冷冻对大豆分离蛋白的乳化特性的影响,对其乳状液的粒径分布、微观结构和稳定性进行研究。研究表明,冷冻使蛋白乳状液的粒径变大,更加分散了液滴粒径;降低了大豆分离蛋白的乳化能力;降低了乳状液的稳定性。本研究所得结果可以为今后进一步提高工业冷冻植物蛋白的质量提供一定的理论支撑。
