柚皮苷对高糖作用下MC3T3-E1细胞活力和Akt通路相关因子表达的影响
2021-01-13林春淑舒晓春肖菲娜彭虹容婵江健胡洁华孟晓军
林春淑 舒晓春 肖菲娜 彭虹 容婵 江健 胡洁华 孟晓军
随着社会的快速发展,人们生活方式、饮食结构的改变和社会人口的老龄化,糖尿病的发病率在全球范围内呈现逐年上升趋势,成为影响人们健康的慢性疾病之一。研究表明,高糖对MC3T3-E1成骨细胞增殖有抑制作用[1],诱导成骨细胞凋亡[2],长期高血糖可使糖尿病患者骨细胞分化受影响,破坏骨代谢的动态平衡,导致骨形成减少。成骨细胞的活力降低是导致糖尿病性骨病的主要原因[3]。糖尿病性骨质疏松患者容易发生骨折,已成为糖尿病患者生活质量下降的主要原因之一。目前骨质疏松的主要治疗药物有骨吸收抑制剂和骨形成促进剂两类,如雌激素、二磷酸盐等,但这些药物治疗的同时出现了一定的副作用。当前以信号通路等研究为依据的各种骨生长因子制剂逐渐被开发,疗效也较好,促进骨形成类药物是未来骨质疏松症治疗药物的发展趋势之一[4]。Akt 信号通路广泛存在于动物细胞中,参与多种细胞增殖、分化和凋亡调节[5]。柚皮苷(naringin,NG)是一种双氢黄酮类化合物,主要来源于芸香科植物的果皮和果肉中,在降血脂、调节血糖等方面具有较强的生物活性[6]。唐琪等[7]研究表明NG 对成骨细胞增殖有一定的促进作用。还有研究发现NG 可提高大鼠的骨密度和促进骨形成的作用[8]。本研究观察不同浓度NG 作用于高糖环境下的MC3T3-E1细胞活力的变化,并检测成骨细胞相关分化因子的表达情况,为进一步应用NG 治疗糖尿病性骨质疏松提供实验依据。
材料与方法
一、材料
小鼠前成骨细胞株MC3T3-E1(南方医科大学生命科学院);Naringin(美国TARGET Mol公司,cas:10326-47-2);α-MEM培养基(广州凯基生物公司,葡萄糖浓度为5.6 mmol/L);胎牛血清(杭州四季青公司);CCK-8 试剂盒(沈阳万类生物公司)、D-(+)-葡萄糖(美国Sigma公司)、胰蛋白酶溶液-EDTA 溶液(广州凯基生物公司)、SYBR®Premix Ex Taq™(TliRNaseH Plus)[宝日医生物技术(北京)有限公司]、Reverse Transcriptase M-MLV(RNase H-)[宝日医生物技术(北京)有限公司]、蛋白提取试剂盒(南京凯基生物科技发展有限公司),BCA 蛋白定量检测试剂盒(南京凯基生物科技发展有限公司)。
二、方法
1.MC3T3-E1细胞的培养:MC3T3-E1细胞复苏后,加入含10%胎牛血清的完全培养基,置于5 %CO2、37℃恒温培养箱中培养。待细胞融合度达到90 %时,用0.25 %胰蛋白酶进行消化,再以300×g离心5 min 收集细胞,传代培养。
2.实验分组及处理:分为对照组(正常无血清培养基)、高糖组(含25 mmol/L 葡萄糖)、0.1 μmol/L+高糖组(0.1 μmol/L NG+25 mmol/L葡萄糖)、1 μmol/L+高糖组(1 μmol/L NG+25 mmol/L 葡萄糖)、10 μmol/L+高糖组(10 μmol/L NG+25 mmol/L葡萄糖)。以二甲基亚砜为溶剂配制浓度为10 mmol/L 的柚皮苷储备液,后分别用培养基稀释成10、1、0.1 μmol/L 3个药物浓度组,不加药物组在培养基中加入0.1 %的DMSO 溶剂。
3.CCK-8 法检测细胞活力:取生长良好的MC3T3-E1细胞,以1×104个/孔的密度接种于96 孔板,恒温培养箱中预培养24 h。待细胞贴壁后,加入各实验组的培养基干预12、24、48 h,向每孔加入100 μL CCK-8 溶液,温箱孵育1 h,用酶标仪测定各孔在450 nm 处的吸光度值。
4.实时荧光定量PCR(qPCR)法检测NG对高糖作用下MC3T3-E1细胞胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)、蛋白激酶(Akt1)、细胞成骨特异性转录因子(Runx2)的mRNA表达:将细胞1×105个/mL,以每孔2 mL细胞悬液接种于6 孔板,恒温箱预培养24 h后,加入各实验组无血清培养基分别干预24、48 h,提取各实验组细胞总RNA,逆转录获得cDNA,Real-time PCR分析采用SYBR®Premix Ex Taq™PCR试剂盒。引物序列如表1所示。反应条件:95℃ 30 s,95℃ 3 s,60℃ 34 s(收集荧光信号),共40个循环。GAPDH 作为内参照,数据使用2-ΔΔCt方法进行分析。

表1 引物序列信息
5.Western blot 法检测NG 对高糖作用下MC3T3-E1细胞IGF-1、Akt1 及碱性磷酸酶(alkaline phosphatase,ALP)蛋白表达的影响:取生长良好的细胞,以1×106个/ml 密度接种于25 cm2透气培养瓶中,待细胞贴壁后加入各实验组含药培养基,干预24、48 h。用TBS 缓冲液冲洗细胞2~3次,加入200 μL 的细胞蛋白裂解液,冰浴30 min,确保细胞完全裂解,12 000×g离心15 min,收集上清液。用BCA 蛋白试剂盒测定蛋白浓度,加入蛋白上样缓冲液在100℃加热10 min 进行蛋白变性,200 mA 转膜60 min。将转好的膜于室温下脱色摇床上用5 %的脱脂牛奶(0.5 %TBST 缓冲液配),封闭1 h,稀释一抗(TBST 溶解的5 %脱脂牛奶,磷酸化蛋白使用TBST 溶解的5 %牛血清白蛋白BSA),4℃过夜。用TBST 在室温下脱色摇床上洗3次,每次5 min,将二抗用TBST 稀释3 000倍,室温下孵育30 min后,用TBST 在室温下脱色摇床上洗3次,每次5 min。用电化学发光(ECL)进行发光显影,通过蛋白条带灰度分析进行定量测定。各组MC3T3-E1细胞IGF- 1、Akt1、ALP 蛋白的表达,是在同一凝胶上上样检测。Akt(60 kDa)、IGF-1(22 kDa)和内参(beta-actin 42 kDa)分子量相差较大,通过剪膜的方式分开孵育的;ALP(39 kDa)和内参分子量接近,通过膜再生的方式重新孵育不同的抗体。
三、统计学分析方法
采用SPSS 22.0 软件进行统计学分析,相关基因与蛋白的相对表达量用表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P< 0.05 为差异有统计学意义。
结 果
一、NG 在高糖环境下增加了MC3T3-E1细胞的活力
CCK8 检测结果显示,与对照组比较,高糖组细胞OD 值均降低,差异有统计学意义(P< 0.01);与高糖组比较,0.1 μmol/L+高糖组细胞OD 值在24、48 h 升高,1 μmol/L+高糖组和10 μmol/L+高糖组OD 值在12、24、48 h 均升高,差异有统计学意义(P< 0.05)。(表2)
二、NG 在高糖环境下上调了MC3T3-E1细胞Runx2、IGF-1、Akt1 的mRNA表达
与对照组比较,24 h 高糖组细胞Runx2、IGF-1、Akt1 的mRNA 的表达水平 降低,差异有统计学意义(P< 0.01);48 h 高糖组细胞Runx2、Akt1 的mRNA的表达水平降低,差异有统计学意义(P< 0.01)。与高糖组比较,1 μmol/L+高糖组和10 μmol/L+高糖组细胞Runx2、IGF-1、Akt1 mRNA表达水平在24、48 h 均升高,差异有统计学意义(P< 0.05)。与高糖组比较,0.1 μmol/L+高糖组在24 h 时Akt1 mRNA 的表达水平和48 h 时IGF- 1 mRNA 的表达水平差异无统计学意义(P> 0.05)。(表3~4)
表2 NG 对高糖环境下MC3T3-E1 的CCK-8 检测结果(± s)

表2 NG 对高糖环境下MC3T3-E1 的CCK-8 检测结果(± s)
注:与对照组比较,aP < 0.05;与高糖组比较,bP < 0.05;与0.1 μmol/L+高糖组比较,cP < 0.05;与1 μmol/L+高糖组比较,dP < 0.05
分组 实验次数 12 h 24 h 48 h对照组 3 0.90±0.01 1.00±0.05 1.09±0.03高糖组 3 0.80±0.01a 0.84±0.01a 0.90±0.01a 0.1 μmol/L+高糖组 3 0.82±0.01a 0.93±0.05b 0.99±0.01 ab 1 μmol/L+高糖组 3 0.92±0.01bc 1.01±0.04bc 1.12±0.02bc 10 μmol/L+高糖组 3 1.01±0.32 abcd 1.16±0.03 abcd 1.20±0.02 abcd F 值 74.876 49.449 143.567 P 值 < 0.001 < 0.001 < 0.001
表3 干预24 h后不同浓度NG 对高糖环境下MC3T3-E1细胞Runx2、IGF-1、Akt1 mRNA表达的影响(± s)

表3 干预24 h后不同浓度NG 对高糖环境下MC3T3-E1细胞Runx2、IGF-1、Akt1 mRNA表达的影响(± s)
注:与对照组比较,aP < 0.05;与高糖组比较,bP < 0.05;与0.1 μmol/L+高糖组比较,cP < 0.05;与1 μmol/L+高糖组比较,dP < 0.05
分组 实验次数 Runx2 IGF-1 Akt1对照组 3 1.00 1.00 1.00高糖组 3 0.34±0.02a 0.34±0.01a 0.15±0.02a 0.1 μmol/L+高糖组 3 0.50±0.15 ab 0.61±0.14 ab 0.21±0.02a 1 μmol/L+高糖组 3 0.62±0.09 ab 0.77±0.03 ab 0.24±0.08ab 10 μmol/L+高糖组 3 0.64±0.05 abc 1.02±0.07bcd 0.40±0.09abc F 值 24.016 47.571 48.036 P 值 < 0.001 < 0.001 < 0.001
表4 干预48 h后不同浓度NG 对高糖环境下MC3T3-E1细胞Runx2、IGF-1、Akt1 mRNA表达的影响(± s)

表4 干预48 h后不同浓度NG 对高糖环境下MC3T3-E1细胞Runx2、IGF-1、Akt1 mRNA表达的影响(± s)
注:与对照组比较,aP < 0.05;与高糖组比较,bP < 0.05;与0.1 μmol/L+高糖组比较,cP < 0.05;与1 μmol/L+高糖组比较,dP < 0.05
分组 实验次数 Runx2 IGF-1 Akt1对照组 3 1.00 1.00 1.00高糖组 3 0.72±0.03a 1.09±0.07a 0.38±0.04a 0.1 μmol/L+高糖组 3 0.76±0.03ab 1.14±0.20 0.63±0.36ab 1 μmol/L+高糖组 3 1.27±0.02abc 2.44±0.19abc 0.86±0.06abc 10 μmol/L+高糖组 3 1.37±0.02abcd 2.73±0.04 abc 1.43±0.03abcd F 值 559.110 126.311 318.142 P 值 < 0.001 < 0.001 < 0.001
三、NG 在高糖环境下上调了MC3T3-E1细胞ALP、Akt1、IGF-1 蛋白的表达
与对照组比较,高糖组MC3T3-E1细胞IGF-1、ALP、Akt1蛋白表达水平在48 h均降低,差异有统计学意义(P< 0.01)。与高糖组比较,0.1 μmol/L+高糖组、1 μmol/L+高糖组和10 μmol/L+高糖组ALP、Akt1、IGF-1 蛋白表达水平在48 h 均升高,差异有统计学意义(P< 0.05,表5~6,图1)。

图1 免疫印迹检测不同时间点各组MC3T3-E1细胞IGF-1、Akt1、ALP 蛋白的表达
表5 干预24 h后不同浓度NG 对高糖环境下MC3T3-E1细胞ALP、Akt1、IGF-1 蛋白表达的影响(± s)
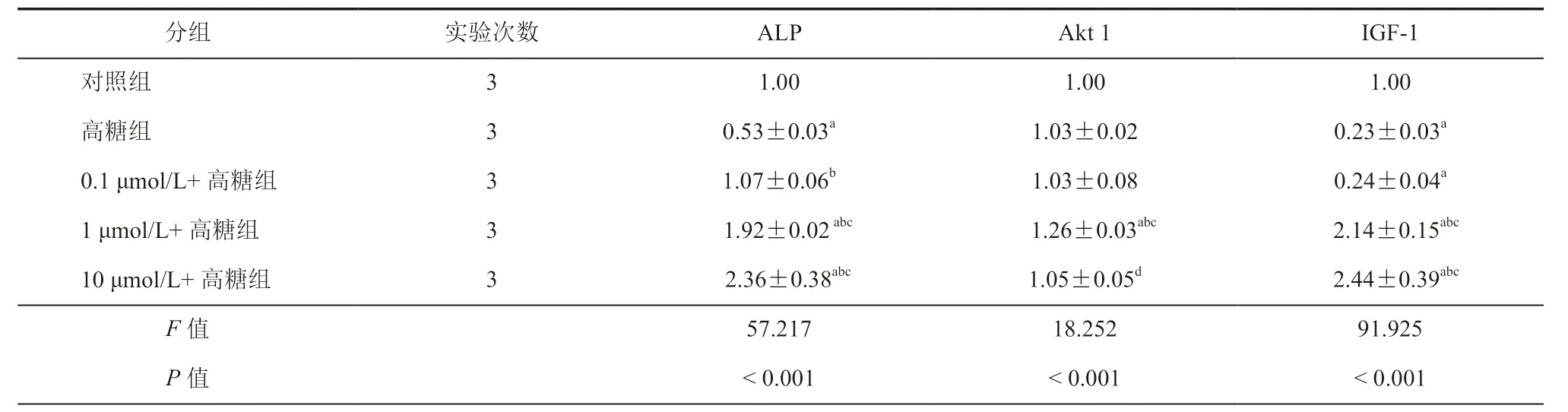
表5 干预24 h后不同浓度NG 对高糖环境下MC3T3-E1细胞ALP、Akt1、IGF-1 蛋白表达的影响(± s)
注:与对照组比较,aP < 0.05;与高糖组比较,bP<0.05;与0.1 μmol/L+高糖组比较cP < 0.05;与1 μmol/L+高糖组比较dP < 0.05
分组 实验次数 ALP Akt 1 IGF-1对照组 3 1.00 1.00 1.00高糖组 3 0.53±0.03a 1.03±0.02 0.23±0.03a 0.1 μmol/L+高糖组 3 1.07±0.06b 1.03±0.08 0.24±0.04a 1 μmol/L+高糖组 3 1.92±0.02 abc 1.26±0.03abc 2.14±0.15abc 10 μmol/L+高糖组 3 2.36±0.38abc 1.05±0.05d 2.44±0.39abc F 值 57.217 18.252 91.925 P 值 < 0.001 < 0.001 < 0.001
表6 干预48 h后不同浓度NG 对高糖环境下MC3T3-E1细胞ALP、Akt1、IGF-1 蛋白表达的影响(± s)
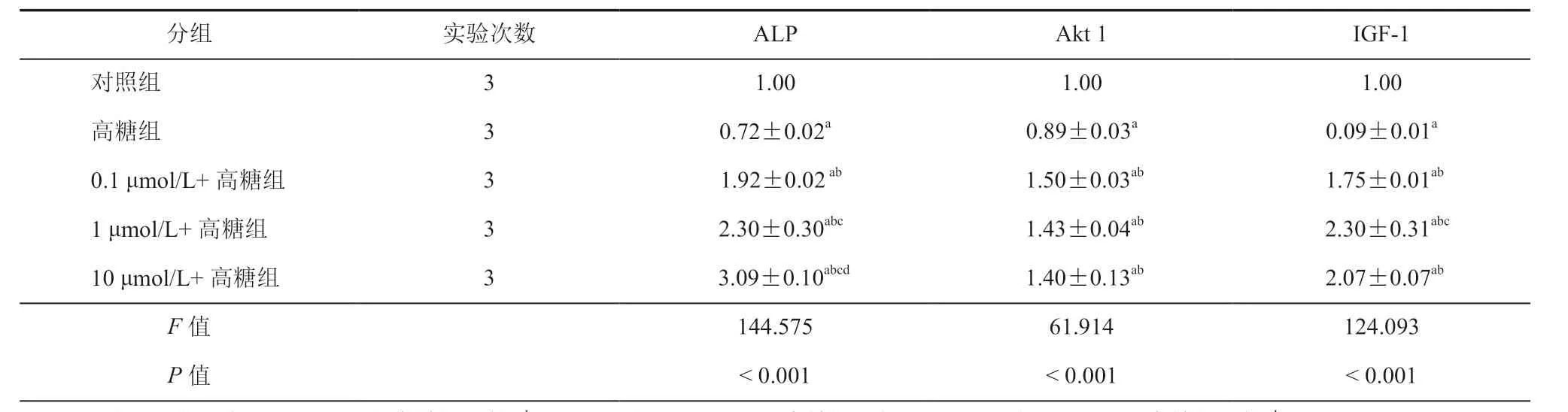
表6 干预48 h后不同浓度NG 对高糖环境下MC3T3-E1细胞ALP、Akt1、IGF-1 蛋白表达的影响(± s)
注:与对照组比较,aP < 0.05;与高糖组比较,bP < 0.05;与0.1 μmol/L+高糖组比较cP < 0.05;与1 μmol/L+高糖组比较dP < 0.05
分组 实验次数 ALP Akt 1 IGF-1对照组 3 1.00 1.00 1.00高糖组 3 0.72±0.02a 0.89±0.03a 0.09±0.01a 0.1 μmol/L+高糖组 3 1.92±0.02 ab 1.50±0.03ab 1.75±0.01ab 1 μmol/L+高糖组 3 2.30±0.30abc 1.43±0.04ab 2.30±0.31abc 10 μmol/L+高糖组 3 3.09±0.10abcd 1.40±0.13ab 2.07±0.07ab F 值 144.575 61.914 124.093 P 值 < 0.001 < 0.001 < 0.001
讨 论
骨质疏松症是常见的代谢性骨病,研究发现高糖明显降低成骨细胞增殖和矿化结节明显减少[9],引发骨保护素减少、矿物质量的降低[10]。糖尿病性骨质疏松是糖尿病在骨骼系统的重要并发症之一,患者骨组织微结构改变,成骨细胞数量减少,骨强度降低、脆性增加,骨折发生风险明显增加[11]。
NG 具有促进骨髓间充质干细胞骨向分化的能力[12],可以促进成骨细胞增殖、分化[13]。容婵等[14]研究表明NG 可以抑制地塞米松诱导的小鼠MC3T3-E1细胞凋亡。在钛颗粒诱导的糖尿病小鼠颅骨骨溶解实验中发现NG 有促进骨形成的作用[15]。MC3T3-E1细胞具有体外培养成骨细胞的多种生物学特性,是研究药物对成骨细胞影响的有价值的体外细胞模型。丁佩惠等[16]研究发现高浓度NG(10、1、0.1 μmol/L)在干预12 h 和24 h后促进MC3T3-E1细胞增殖,且几乎不影响细胞生长。本研究中,以MC3T3-E1细胞为研究对象,将不同浓度NG 溶液(10、1、0.1 μmol/L)+25 mmol/L 葡萄糖混合培养液,分别干预12、24、48 h后,观察到各个时间点高糖组均显著抑制MC3T3-E1细胞增殖,加入不同浓度NG 干预后,发现NG 在高糖环境下可促进MC3T3-E1细胞增殖,并呈一定的浓度依赖性,以10 μmol/LNG 组效果最显著。
IGF-1 可增加成骨细胞数目和活性以促进骨形成[17],是骨生成的刺激因子,青春期可增加成骨细胞数量,成年期可维持骨量[18]。孙凯等[19]选取220例糖尿病患者,分为合并骨质疏松的观察组和无骨质疏松的对照组,对比发现观察组的IGF-1 水平明显低于对照组。邓子阳等[20]研究发现IGF-1 可增加糖尿病大鼠胫骨钙磷含量,其机制可能与IGF-1 促进骨骼重组人骨形态发生蛋白-2表达,提高骨碱性磷酸酶含量有关。因而,提高成骨细胞数量及IGF-1水平是预防和治疗糖尿病性骨质疏松的一个重要方向。
Akt 是一种丝氨酸/苏氨酸蛋白激酶,在调控细胞存活和凋亡中起重要作用,Akt 激酶家族包括Akt1、Akt2 和Akt3 3个成员,与磷脂酰肌醇3 激酶(P13K)共同组成P13K/Akt 信号通路。PI3K/Akt信号通路是IGF-1 发挥作用的关键环节。江健[21]等研究发现盐酸小檗碱可以促进小鼠前成骨细胞的分化与矿化,其机制可能与其激活 PI3K/Akt 信号通路有关。丹参素通过活化 PI3K/Akt通路减少骨质疏松大鼠成骨细胞的凋亡[22]。张立超等[23]通过实验发现杜仲叶提取物可通过Akt通路促进大鼠成骨细胞增殖。Ulici 等[24]研究表明敲除Akt1 的小鼠骨骼变短,次级骨化中心的形成也相应延迟。有实验表明把能持久表达Akt1 的基因导入MC3T3-E1细胞中,Runx2表达增强,而使表达Akt1 的基因沉默后,Runx2表达也随之下降。Runx2 是骨形成最早的标志基因,是成骨细胞开始分化的标志,能够激活骨钙蛋白、骨桥素、骨涎蛋白和CO1I基因的转录和表达[25],还可促进成骨细胞成熟和骨吸收[26]。Inada等[27]研究发现,Runx2基因敲除的小鼠表现出软骨细胞ALP 活性水平低,软骨内骨化被抑制。ALP 是骨形成的代谢指标,是成骨细胞早期分化的标记物,是骨折愈合和骨重建的重要生物标志[28]。元建民等[29]的研究发现高糖显著抑制了细胞的ALP 活性和分泌。朱聪等[30]的研究发现在成骨诱导14 d后,应力刺激组种子细胞的ALP 和Ca 结节染色阳性率增强。李念虎等[31]用NG 对体外培养的骨髓基质细胞进行干预后,发现NG 能明显提高细胞碱性磷酸酶ALP、骨钙素的表达,并应用NG 对卵巢摘除诱发骨质疏松的大鼠灌胃2个月后,发现其骨质疏松得到有效逆转。徐展望等[32]研究也发现NG 增强骨质疏松模型大鼠的骨强度,增大骨小梁面积,促进体外培养的骨髓间充质干细胞中Runx-2 的表达。
Runx2 是成骨细胞的转录因子,对骨组织的形成和重建起到重要作用。然而,Runx2 能促进成骨细胞早期分化,但对骨细胞的成熟有一定的抑制作用,因此,其蛋白水平的表达在本研究中无法给我们最明确的信息;此外,Runx2 的功能多样,不仅仅影响成骨,对破骨,软骨也有影响,机制复杂,但其基因水平的表达情况为我们实验有很好的提示作用。而ALP 是成骨细胞分化的直接指标,能直接反应前成骨细胞的分化状态与活力。Akt1 是P13K/Akt通路的重要组成部分,张健博等[33]研究也发现通过靶向下调Akt1 抑制OA 软骨细胞的增殖,促进细胞凋亡。综合考虑,本研究主要检测MC3T3-E1细胞Akt1、Runx2 和IGF-1 mRNA 和IGF-1、Akt1、ALP 蛋白的表达水平。研究发现,24 h 和48 h 高糖组显著下调MC3T3-EI细胞Akt1、Runx2 的mRNA 的表达,24 h 下调了IGF-1 的mRNA 的表达,而不同浓度NG 组在干预24、48 h后,明显上调了MC3T3-E1细胞IGF-1、Akt1、Runx2 mRNA 的表达水平,并呈浓度依赖性,以10 μmol/LNG 组效果最明显。Western blot 法检测发现,高糖组显著下调MC3T3-E1细胞IGF-1、ALP、Akt1 蛋白的表达水平;而不同浓度NG 组明显上调ALP、IGF-1、Akt1 蛋白的表达水平,同样呈浓度依赖性。通过实验说明高糖抑制了MC3T3-E1细胞IGF-1、Akt1、Runx2 mRNA 和IGF-1、Akt1、ALP 蛋白的表达水平,而NG 在高糖环境下则明显改善高糖的抑制作用,促进MC3T3-E1细胞IGF-1、Akt1、Runx2 mRNA 和IGF- 1、Akt1、ALP 蛋白的表达。
综上所述,NG 在高糖环境下具有促进前成骨细胞生长的潜能,其机制可能通过刺激IGF-1表达,激活Akt 信号通路及其下游因子Runx2,提高ALP 的表达,从而促进MC3T3-E1细胞的生长,促进骨形成,为临床应用NG 治疗糖尿病性骨质疏松提供了一定的实验依据。
