ω-3 PUFAs对小鼠炎症性肠病调节性T细胞影响的研究
2021-01-13冯晓玲高鸿亮
冯晓玲 高鸿亮
炎症性肠病(inf lammatory bowel disease,IBD)分为溃疡性结肠炎与克罗恩病,是特发性肠道炎症疾病,具有发病早、病程缓和易复发特点,患者发病后需要接受长时间治疗,严重影响患者正常生活[1]。目前仅了解IBD 发病主要由遗传、肠道细菌、环境以及肠道免疫系统失调等众多因素一同导致[2]。炎症反应过程与机体免疫系统功能关系密切,探究肠道炎症发生时机体免疫功能变化对于了解肠道炎症疾病合理免疫治疗方案制定具有重要意义。调节性T细胞(Treg)可通过细胞之间相互作用与因子释放达到减少辅助T细胞增殖、抑制促炎因子分泌、减少免疫损伤和巩固免疫耐受的目的[3]。ω-3 多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFAs)作为人体正常运转必需脂肪酸之一,其主要由二十碳五烯酸与二十二碳六烯酸(docosahexaenoic acid,DHA)组成,不仅可以为机体提供能量,还可以作为药物治疗自身免疫性疾病,甚至能够抑制T细胞及淋巴细胞增殖[4]。本研究以IBD 小鼠为模型,进一步明确ω-3 PUFAs对IBDTreg细胞的影响。
材料和方法
一、材料
1.动物和试剂:小鼠来自新疆医科大学第五附属医院动物研究中心,三硝基苯磺酸、维甲酸(美国Sigma公司),ω-3 PUFAs、DHA、饱和脂肪酸硬脂酸(美国Peprotech公司),RPMI- 1640 培养基、PBS 磷酸盐缓冲液(上海士峰生物科技有效公司),胎牛血清(美国Thermo Scientif ic公司),annexinV- FITC 凋亡检测试剂盒(上海碧云天公司),FITC- anti-CD4、
PE- ant- CTLA- 4、APC-anti-Foxp3、PE-anti- CD39、PE- anti- CD25、anti-CD3、anti-CD28 单克隆抗体、固定/通透液、高尔基体阻断剂BD Golgistop 蛋白转运抑制剂(丹麦eBioscience公司),鼠CD4+CD25+Treg 分离试剂盒(上海强智生物科技有限公司),TGF-β、IL-2(南京欧凯生物公司),CFSE 及anti-CD3/CD28 beats(美国Gibcolifetechnologies 公司),白介素-10(IL-10)、Foxp3 以及干扰素-γ(IFN-γ)酶联免疫吸附试剂盒(美国Invitrogen公司)。
2.仪器:FYL-YS-150L型号细胞培养箱(中国北京福意联医疗设备有限公司),MA100型号倒置显微镜(日本尼康公司),LDZ5-2型号离心机(中国北京时代北利离心机有限公司),Accuri C6型号流式细胞仪(美国BD公司)。
二、方法
1.动物分组以及处理:120 只雄性健康Balb/C小鼠均为SPF级别,5~9 周龄,平均为(6.14±0.82)周,体质量17~22 g,平均(20.51±0.47)g,小鼠均给予质量体积为1%三硝基甲苯30%乙醇溶液处理,以形成IBD 小鼠模型,三硝基甲苯乙醇溶液处理浓度为100 mg/kg。随后将所有小鼠按照随机数字表分组方法分为4 组,分别以2.5g/(kg·d)浓度腹腔注射ω-3 PUFAs(ω-3 PUFAs组)、饱和脂肪酸硬脂酸(硬脂酸对照组)、DHA(DHA 组),同时设置注入相同浓度生理盐水作为空白对照组,随后小鼠均连续注入14 d。14 d后将小鼠处死,部分结肠采用甲醛固定用于组织学分析,部分则用于Treg细胞功能检测。
2.组织学分析:结肠组织应用10%甲醛固定后进行脱水、石蜡包埋、切片以及染色处理,最后采用相关文献[5]进行评分以及组织学分析。
3.Treg细胞水平测定:小鼠结肠组织研磨后应用100 目筛网过滤后获取细胞悬液,随后经由裂解后离心并采用PBS 清洗3次,调节细胞浓度为6×105个/mL,添加PE-CD25 抗体,在4℃环境下进行避光孵育30 min。胞内细胞因子染色分析需要在培养完成4~6 h 给予蛋白转运抑制剂以阻断处理,添加标准为含有106个细胞2 mL 培养液需要添加4 μL 蛋白转运抑制剂。避光孵育结束后采用PBS 进行1~2次洗涤后应用200 μL 固定/通透液处理,此过程需要在4℃环境下避光30 min,结束后应用通透洗涤液进行2次洗涤,采用通透液(100 μL)重悬,并加入细胞因子与表型分析抗体PE- anti- Foxp3,同样在4℃环境下避光孵育30 min,结束后应用通透液洗涤,最终采用PBS(200 μL)重悬后选择流式细胞仪予以检查并分析。
4.细胞内因子mRNA表达水平测定:检测使用Real- time PCR,应用Trizol 法对nTregs 与iTregs细胞总RNA 进行抽提与纯化,随后逆转录为cDNA,将其作为模板予以PCR 扩增。Real-time PCR 操作参照对应试剂盒说明书进行,1 μL cDNA 对应10 μL PCR 引物,反应条件设置为95℃进行预变性,时间为30 s,95℃持续30 s,最终为60℃ 30 s,一共40个循环。内参选择GAPDH,并应用 2-ΔΔCT计算对应细胞因子mRNA表达水平。所用引物序列见表1。

表1 引物序列信息
5.细胞因子水平测定:将小鼠结肠组织制成组织匀浆,随后采用酶联免疫吸附法测定上清液中IL- 10、Foxp3 以及IFN-γ 水平,检测按照对应试剂盒进行操作。
6.观察指标:比较各组小鼠组织学评分,Treg细胞表型,细胞内部因子mRNA表达水平,上清液中细胞因子水平。
三、统计学分析方法
采用SPSS20.0 软件进行统计学分析,计量资料如小鼠组织学评分、Treg细胞表型比例、细胞内部因子mRNA表达水平、上清液中细胞因子水平均以x±s表示,多组间比较采用单因素方差比较,两两比较应用SNK 检验,以P< 0.05 为差异有统计学意义。
结 果
一、小鼠结肠组织组织学分析
空白对照组小鼠结肠观察到显著水肿、充血和糜烂,上皮细胞可以观察到明显溃疡以及坏死,有明显淋巴细胞以及中性粒细胞浸润,硬脂酸对照组、DHA 组与ω-3 PUFAs组炎症细胞浸润程度逐渐减轻,可以观察到少量淋巴组织增生周围组织可见明显黏连(图1)。与空白对照组比较,硬脂酸对照组、DHA 组与ω-3 PUFAs组小鼠组织学评分 [(4.12±0.89)分 比(3.82±0.51)分、(2.51±0.74)分、(1.04±0.36)分]均下降,差异具有统计学意义(F= 137.469,P< 0.05),各组间两两比较均有统计学意义(P< 0.05),仅空白对照组与硬脂酸组比较差异无统计学意义(P> 0.05)。
二、各组Treg细胞表型比例比较
与空白对照组比较,硬脂酸对照组、DHA组与ω-3 PUFAs组Treg细胞表型比例[(3.80±0.89)%比(3.90±0.75)%、(7.22±1.13)%、(10.10±1.29)%] 均升高,与空白对照组比较,硬脂酸对照组、DHA 组以及ω-3 PUFAs组Treg细胞表型比例升高,差异存在统计学意义(F= 304.301,P<0.05),各组间两两比较均有统计学意义(P< 0.05),其中仅空白对照组与硬脂酸对照组比较差异无统计学意义(P> 0.05,图2)。
三、各组细胞内部因子mRNA表达水平比较

图1 光学显微镜下观察四组小鼠结肠组织病理情况(HE染色,×400)

图2 四组Tr eg细胞表型检测
与空白对照组比较,ω-3 PUFAs组、硬脂酸对照组、DHA 组细胞内部Foxp3、IL-10 mRNA表达水平均升高(P< 0.05),与硬脂酸对照组比较,ω-3 PUFAs组 与DHA 组 细 胞 内 部Foxp3、IL-10 mRNA表 达水平均升高,且ω-3 PUFAs组高于DHA 组(P均<0.05,表1)。
表1 各组细胞内部因子mRNA表达水平比较(± s)
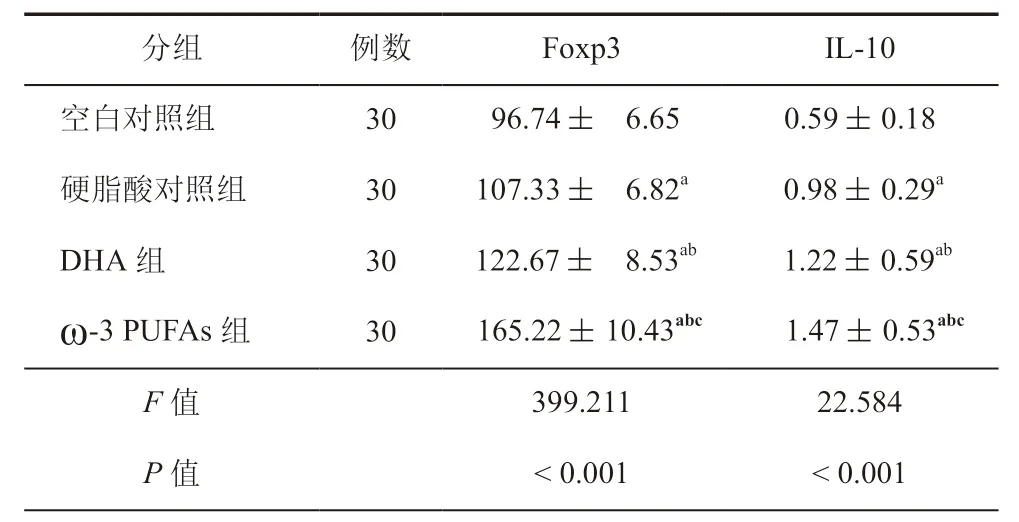
表1 各组细胞内部因子mRNA表达水平比较(± s)
注:与空白对照组比较,aP < 0.05,与硬脂酸对照组比较,bP < 0.05,与DHA 组比较,cP < 0.05
分组例数 Foxp3 IL-10空白对照组 30 96.74 ± 6.65 0.59 ± 0.18硬脂酸对照组 30 107.33 ± 6.82a 0.98 ± 0.29a DHA 组 30 122.67 ± 8.53ab 1.22 ± 0.59ab ω-3 PUFAs组 30 165.22 ± 10.43abc 1.47 ± 0.53abc F 值 399.211 22.584 P 值 < 0.001 < 0.001
四、各组上清液中细胞因子水平比较
与空白对照组比较,ω-3 PUFAs组、硬脂酸对照组、DHA 组上清液中细胞因子IL-10、Foxp3 水平升高,IFN-γ 水平降低(P<0.05),与硬脂酸对照组比较,ω-3 PUFAs组与DHA 组上清液中细胞因子IL-10、Foxp3 水平升高,IFN-γ 水平降低(P<0.05),与DHA 组 比较,ω-3 PUFAs组上清液中IL-10、Foxp3 水平升高,IFN-γ 水平降低(P<0.05,表2)。
表2 各组上清液中细胞因子水平比较(± s)
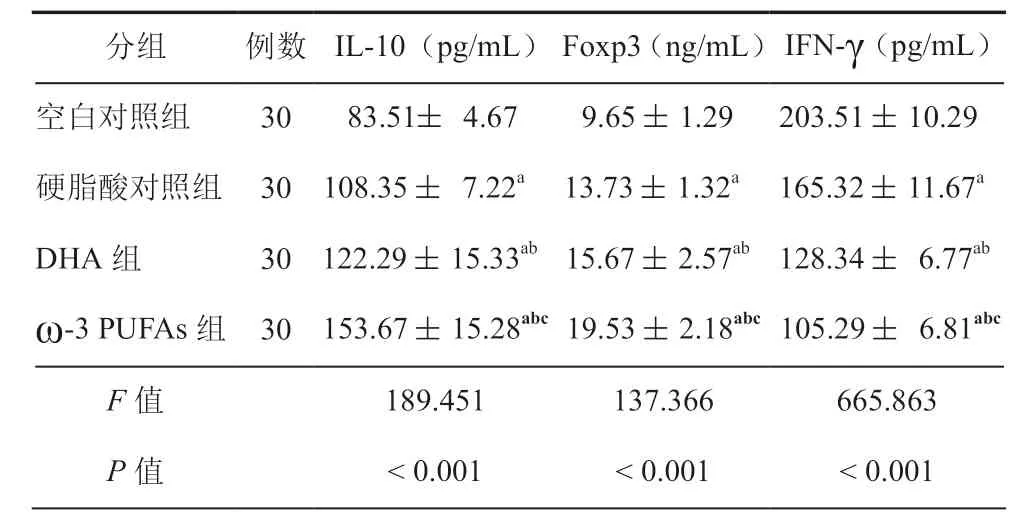
表2 各组上清液中细胞因子水平比较(± s)
注:与空白对照组比较,aP < 0.05;与硬脂酸对照组比较,bP < 0.05;与DHA 组比较,cP < 0.05
分组例数 IL-10(pg/mL)Foxp3(ng/mL)IFN-γ(pg/mL)空白对照组 30 83.51± 4.67 9.65 ± 1.29 203.51 ± 10.29硬脂酸对照组 30 108.35 ± 7.22a 13.73 ± 1.32a 165.32 ± 11.67a DHA 组 30 122.29 ± 15.33ab 15.67 ± 2.57ab 128.34 ± 6.77ab ω-3 PUFAs组 30 153.67 ± 15.28abc 19.53 ± 2.18abc 105.29 ± 6.81abc F 值 189.451 137.366 665.863 P 值 < 0.001 < 0.001 < 0.001
讨 论
IBD 为胃肠道组织出现慢性炎症性疾病,目前认为其发病主要由胃肠道免疫功能损伤以及黏膜反应过度所致。已有研究证实Treg细胞是保证机体免疫耐受的重要细胞,其功能障碍或者数量减少会导致IBD 发生[7]。动物实验更是进一步证实将CD4+CD25-T 淋巴细胞转移至T 淋巴功能障碍小鼠体内,会导致小鼠出现一系列自身免疫性疾病如类风湿关节炎、IBD 等,而将CD4+CD25+T 淋巴细胞转移给同样小鼠,其免疫缺陷疾病则可以有效避免[8]。因此,IBD 治疗应以纠正患者免疫功能紊乱,改善Treg细胞水平为主。
ω-3PUFAs 主要由EPA 与DHA 组成,其中EPA可以有效促进抗炎细胞因子释放,抑制炎症反应过度,改善免疫功能,DHA 为膜磷脂形成重要组成,对细胞膜具有保护稳定作用[9]。研究显示癌症患者Treg细胞水平异常上升,患者通过摄入ω-3PUFAs可以抑制Tregs细胞功能,减少细胞对免疫抑制相关因子释放,间接改善B细胞、抗原呈递细胞以及CD8+细胞功能,纠正机体免疫紊乱达到抗肿瘤作用[10]。IBD 发病则主要是由Tregs细胞减少以及功能异常所致,所以其治疗应以促进Treg细胞成熟与分化,改善其功能为主。已有研究证实IBD患者外周血Treg细胞水平明显少于健康者,而在炎症恢复期患者Treg细胞水平与健康者差异逐渐减少,显示患者炎症缓解主要为Tregs细胞被募集至炎症位置发挥免疫调节作用[11]。Foxp3 是反映Tregs细胞功能成熟作用特异性标记物,Treg细胞逐渐增加结直肠癌患者病灶组织中Foxp3+Tregs表达增加,而摄入高剂量ω-3PUFAs 结直肠癌患者Foxp3+Tregs表达水平有效降低,显示ω-3PUFAs 可以通过Foxp3 介导Tregs细胞免疫调节作用[12]。本研究中ω-3 PUFAs组与DHA 组Treg细胞表型比例高于硬脂酸对照组与空白对照组,显示IBD患者体内Tregs细胞减少,而使用ω-3 PUFAs 以及DHA 处理后,Tregs细胞水平有效改善。正常情况下肠道菌群处于平衡状态,这种平衡作用主要由Tregs/Th17细胞调节,炎症性肠炎发生时,Treg细胞减少,机体免疫调节作用紊乱;而ω-3PUFAs 处理后可以从改善细胞内部脂肪酸代谢、细胞膜磷脂水平、调节氧化酶作用以及影响细胞膜流动性等多方面调节机体肠道免疫作用,减轻肠道炎症[13-14]。
胃肠道Treg细胞与肠道菌群关系密切,肠道菌群清除小鼠Tregs细胞数量减少,而肠道菌群代谢产物可以有效上调Treg细胞数量以及IL-10 达到减轻肠道炎症目的[15],进一步显示Treg细胞及其分泌细胞因子在肠道免疫功能以及炎症反应过程中作用重大。本研究中ω-3 PUFAs组、硬脂酸对照组、DHA 组细胞内部Foxp3、IL-10 mRNA表达水平均高于空白对照组,ω-3 PUFAs组与DHA 组细胞内部Foxp3、IL-10 mRNA表达水平高于硬脂酸对照组,显示添加脂肪酸可以有效调节Foxp3、IL-10表达,而ω-3PUFAs 有效成分EPA 与DHA 对Foxp3、IL-10表达调节作用更显著。Foxp3 作为Tregs细胞特异性标志物,其mRNA表达水平变化显示了Tregs细胞功能变化,Tregs细胞进行免疫调节作用主要由其分泌细胞因子IL-10、IFN-γ 等以及细胞接触期间细胞毒性T 淋巴细胞抗原-4 信号传递发挥作用,IL-10 作为抑制炎症细胞因子,在IBD 中具有显著免疫抑制以及抗炎作用[16-17]。其后分析上清液中炎症因子水平发现,脂肪酸尤其是ω-3 PUFAs 与DHA 处理后上清液中细胞因子IL-10、Foxp3 水平显著增加,IFN-γ 水平显著下降,由此本研究推测,ω-3PUFAs 通过刺激Foxp3 以及IL-10 水平增加,刺激CD4+CD25-Tregs细胞向Tregs细胞转化,增加IL- 10、Foxp3 水平,下调IFN-γ 水平,调节免疫反应,缓解炎症。
综上,ω-3PUFAs 可以通过激活Tregs细胞,释放抑炎细胞因子,下调促炎细胞因子水平达到纠正IBD 小鼠紊乱免疫应激,减轻炎症作用,其有望为IBD 治疗提供新思路。
