非编码RNA在前列腺癌上皮间质转化中的研究进展*
2021-01-13丁明霞陈振杰综述王玉明审校
尹 冶,丁明霞,陈振杰 综述,王玉明 审校
昆明医科大学第二附属医院:1.检验科;2.泌尿外科,云南昆明 650000
前列腺癌是严重威胁全球中老年男性健康的恶性肿瘤之一,到2020年美国前列腺癌确诊人数预计达19万余人,3.3万余人死于该病[1]。近十年来,前列腺癌已成为我国增速最快的男性恶性肿瘤,且晚期患者比例较西方国家更高,80%的患者虽得益于初期的雄激素剥夺疗法,但最终均会抵抗雄激素剥夺疗法,发展为去势抵抗性前列腺癌[2]。去势抵抗性前列腺癌极具转移性和侵袭性的特点使得器官转移成为多数患者死亡的主要原因,恶性肿瘤转移的机制极为复杂,其中,上皮间质转化(EMT)被认为是这一行为特征的关键因素。
EMT是指上皮细胞失去上皮表型,并获得间质表型后转化为间质细胞的过程。起源于前列腺上皮而恶性增殖的癌细胞经过EMT失去细胞极性,导致细胞间黏附力减弱,侵袭与迁移能力增强,同时,伴随上皮细胞标志物E-钙黏蛋白(E-cadherin)、β-连环素(β-catenin)和紧密连接蛋白ZO-1的表达下调,以及间质细胞标志物N-钙黏蛋白(N-cadherin)和波形蛋白(vimentin)的表达上调[3]。EMT作为前列腺癌恶化转移的重要环节,它的激活受到一系列基因表达变化的调控。其中,长链非编码RNA(lncRNA)、微小RNA(miRNA)及环状RNA(circRNA)等多种非编码RNA(ncRNA)可通过转录和表观遗传等多水平调控肿瘤相关基因的表达。研究表明,ncRNA可通过多种途径对Snail超家族(Snail,Slug)、碱性螺旋-环-螺旋蛋白家族(Twist1)和E盒结合锌指蛋白家族(Zeb1,Zeb2)等EMT相关转录因子的表达进行调控,也可调控转化生长因子β(TGF-β)、表皮细胞生长因子(EGF)和肿瘤坏死因子(TNF)的表达,从而参与到前列腺癌的EMT进程中[4-5]。本文通过综述3类ncRNA的相关研究,总结并探讨其调控前列腺癌EMT的作用机制,以期深刻认识EMT在前列腺癌中的分子机制,同时为获得前列腺癌新的治疗靶点提供依据。
1miRNA与前列腺癌EMT
1.1miR-200家族与前列腺癌EMT 作为与恶性肿瘤EMT高度相关的基因系列家族,miR-200家族(miR-200a/b/c、miR-141和miR-429)被广泛研究,目前认为其主要靶向调控Zeb家族参与EMT进程[6]。近年来,miR-200家族调控前列腺癌EMT的机制也取得了一定的突破。
研究表明,miR-200-3c可通过靶向调控Zeb2抑制前列腺癌细胞的侵袭和迁移,从而上调E-cadherin的表达,抑制EMT进程[7]。此外,转录因子Zeb1和Slug可直接相互作用于vimentin启动子中的E-box序列,miR-200c可对二者进行转录、抑制,从而阻碍前列腺癌的EMT进程[8]。这提示了miR-200c可逆转前列腺癌的细胞表型从上皮向间质的转变,Zeb1-Slug轴的分子重编程或许可以作为转移性前列腺癌的潜在治疗靶点。基于此,ABISOYE等[9]发现转录抑制因子Kaiso可通过激活表皮细胞生长因子受体(EGFR)信号通路,促使miR-200沉默。Kaiso作为转录抑制物,可通过结合E-cadherin的甲基化区域参与到调控多种恶性肿瘤的EMT进程中[10]。该研究在LNCaP细胞中过表达Kaiso后,miR-200表达下调,Zeb1和EGFR表达上调。经验证,EGFR-Kaiso信号轴是miR-200-Zeb1反馈环的关键环节,可加速前列腺癌的EMT进程。由此看来,Zeb1/Zeb2作为miR-200家族的直接靶标,或以更为复杂的机制调控前列腺癌的EMT进程。另外,上皮可塑性相关基因的选择性剪接作为miR-200调控EMT的新机制被初次报道[11]。RNA结合蛋白QKI-5可指导间质相关基因的剪切变化,尤其是发生EMT时,可改变与肌动蛋白细胞骨架变化相关的基因。该蛋白可在EMT进程中直接结合并调控数百个可变剪接靶标,发挥多效作用,例如调控上皮与间质状态之间的可塑性,以促进细胞的迁移和侵袭[11]。研究表明,miR-200和miR-375可通过抑制QKI-5的翻译,对EMT相关的选择性剪接变化进行广泛的约束,从而抑制前列腺癌的EMT进程[12]。上皮可塑性相关基因与EMT紧密相关,以此为出发点或能深入探究miRNA调控前列腺癌EMT的复杂机制。
1.2其他miRNA与前列腺癌EMT
1.2.1促癌miRNA与前列腺癌EMT 除miR-200家族外,其他miRNA在前列腺癌EMT中的调控也有重要意义。ZHANG等[13]研究发现,miR-410-3p可作用于磷酸酶及张力蛋白同源基因PTEN来调控AKT/mTOR信号通路,从而加速前列腺癌EMT的进程。PTEN作为强大的肿瘤抑制因子,可负向调控PI3K/AKT信号通路,其表达的缺失可促进不同癌细胞的增殖,并减少凋亡。miR-498也被证实可通过结合PTEN的3′-UTR调节AKT信号通路,从而促进前列腺癌细胞的增殖、侵袭和EMT进程[14]。肿瘤的恶性增殖和转移严重影响前列腺癌患者的生活质量和生存时间,一些失调的miRNA是器官转移的关键介质。研究表明,miR-141-3p可通过激活核因子(NF)-κB信号通路促进前列腺癌的骨转移,上调PC3细胞的miR-141-3p后,棒状或长纺锤形的间充质表型转化为明显的鹅卵石样或短纺锤形的上皮轮廓,表明EMT进程受到抑制。而NF-κB途径在肿瘤中具有核心作用,可促进肿瘤的发生与转移[15]。miR-210-3p可通过靶向抑制NF-κB信号通路的负调节剂来维持NF-κB信号的持续激活,从而诱导前列腺癌EMT和骨转移的发生[16]。由此看来,肿瘤信号通路的调控在前列腺癌EMT中依然占据重要地位,但要将高效的靶点进行临床转化,仍需大量数据验证出特异的信号途径。另外,LO等[17]研究发现γ干扰素(IFN-γ)可诱导前列腺癌的体外细胞侵袭和体内肺转移,其具体机制可能是IFN-γ诱导的四肽重复序列5复合体降解部分前体miRNA(pre-miRNA),包括pre-miR-363、pre-miR-101和pre-miR-128,通过阻断pre-miRNA对EMT相关转录因子的靶向调控,从而促进远端转移和EMT。这一结论与LIU等[18]研究INF-γ通过抑制miRNA调控前列腺癌EMT的结果一致。因此,从相关抑制剂或阻断剂的方向进行探索,或许能更全面地探讨其机制,并为有效抑制剂的开发提供依据。
1.2.2抑癌miRNA与前列腺癌EMT 肿瘤miRNA表达谱分析的主要挑战是细胞亚群和肿瘤组织的异质性。因此,ZONI等[19]分析了前列腺癌上皮祖细胞亚群中miRNA的表达,确定miR-25在祖细胞亚群中低表达,而在前列腺癌细胞系中高表达,该研究表明,miR-25可通过与αv/α6-整合蛋白直接相互作用影响EMT相关细胞骨架变化,从而减少前列腺癌的体外迁移和体内转移,miR-25作为肿瘤抑制因子,是前列腺癌的关键调节剂。不仅肿瘤转移与EMT相关(Ⅲ型EMT),胚胎生长发育(Ⅰ型EMT)和组织再生(Ⅱ型EMT)等也与其紧密相关。SOX基因家族与生长发育存在密切关系,该家族的异常表达可导致多种恶性肿瘤。研究表明,部分miRNA可通过调控SOX家族影响前列腺癌的EMT[20],其中,miR-139-5p通过靶向SOX5,下调Twist1、N-cadherin和vimentin的表达,从而抑制前列腺癌EMT的进程。另一项研究则基于生物信息学工具和荧光素酶报告基因检测确定SOX4作为EMT的一种关键调节剂,miR-132、miR-212可通过直接靶向SOX4破坏EMT,抑制前列腺癌的恶化与转移[21]。miR-19a-3p也可通过抑制SOX4下调N-cadherin、α-平滑肌肌动蛋白,以及与肿瘤浸润转移相关的基质金属蛋白酶2、金属蛋白酶9,从而抑制前列腺癌的EMT进程[22]。同样,通过靶向调控SOX家族延缓前列腺癌EMT的miRNA还包括miR-140、miR-653等。这些结果提示肿瘤抑制因子和生长发育相关基因可能是miRNA调控前列腺癌EMT的连接桥梁,且与胚胎生长发育和组织再生相关的基因对Ⅲ型EMT的机制研究也有较大的探索价值。
尽管目前miRNA调控前列腺癌EMT的机制研究缺乏足够的深入性和统一性,但从零散的研究中发现,EMT相关因子和肿瘤相关基因是探索此机制的主要方向。以此为基础展开研究得到的分子机制线索,为前列腺癌miRNA靶点的发掘提供了依据。见图1。
2lncRNA与前列腺癌EMT
2.1与竞争性内源RNA(ceRNA)机制相关的lncRNA lncRNA具有一级序列信息,可以通过碱基互补与核酸分子相互作用,也可以通过其二级结构与蛋白质、核酸分子及RNA-蛋白质复合物相互作用,此种基因共表达或基因间相互调控的模式是研究lncRNA在癌症中发挥生物学功能的重要方法。miRNA可以通过结合mRNA导致基因沉默,而lncRNA作为ceRNA可以竞争性地结合miRNA来调节基因表达,从而影响miRNA导致的基因沉默。lncRNA通过此种ceRNA机制调控前列腺癌的EMT进程。研究表明,lncRNA MALAT1可作为ceRNA,与冠状蛋白1C竞争miR-1-3p的结合位点,通过抑制miR-1-3p的表达诱导冠状蛋白1C上调,下调N-cadherin、vimentin、Snail和Slug的表达水平,从而促进前列腺癌的侵袭、迁移和EMT进程[5]。基于ceRNA机制证实了lncRNA在前列腺癌EMT调控中占据重要地位,关键是ceRNA机制将与前列腺癌EMT相关的lncRNA与miRNA联系起来,为揭开lncRNA调控功能带来更多可靠的证据。见表1。
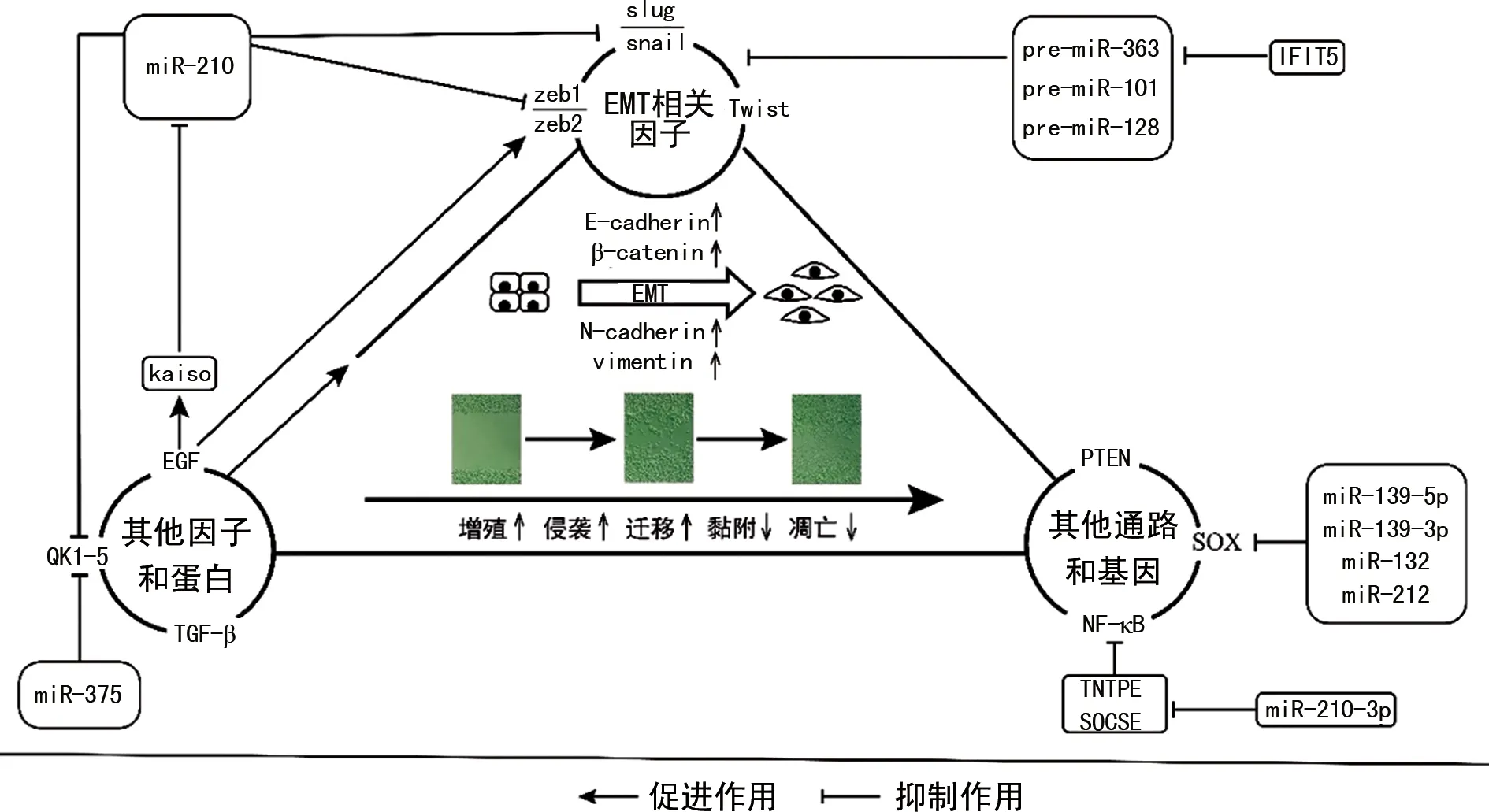
图1 miRNA调控前列腺癌EMT的分子机制

表1 lncRNA作为ceRNA调控前列腺癌EMT的分子机制
2.2与其他机制相关的lncRNA 部分lncRNA可通过直接作用在前列腺癌的EMT中发挥调控作用。前列腺癌抗原3(PCA3)是首个用于前列腺癌诊断的lncRNA[30]。研究发现下调LNCaP细胞的PCA3后,E-cadherin、紧密连接蛋白3、紧密连接蛋白4和细胞角蛋白8的表达上调,而Snail、Slug、Twist及vimentin的表达下调[30]。PCA3的下调与部分EMT标志物的表达逆转有关,因此,针对PCA3开发有效抑制剂或许可以为前列腺癌转移的阻断带来新的转机。XIAO等[31]发现lncRNA H19可以充当细胞黏附分子的转录抑制剂,沉默PC3细胞的lncRNA H19后,E-cadherin、整合素β3、整合素β4上调,细胞运动性和侵袭性减弱,提示lncRNA H19可通过调控E-cadherin、整合素β3、整合素β4控制前列腺癌的EMT进展。同样,lncRNA PCAT-1、lncRNA VIM-AS1和lncRNA 01638等也通过直接影响EMT相关蛋白标记物的作用方式来调控前列腺癌的侵袭、转移。而另一些lncRNA则通过调控癌症信号通路等参与EMT进程。LI等[32]证明lncRNA PlncRNA-1可通过TGF-β1途径调节前列腺癌的细胞周期和EMT进程。TGF-β1信号通路是稳定细胞生长动态平衡的重要通路,细胞致瘤后可通过激活TGF-β1获得迁移能力并促进EMT进程。位于TGF-β1下游的lncRNA ATB是前列腺癌患者无复发生存的独立影响因素,其表达水平可因TGF-β1的过表达而上调。研究表明,lncRNA ATB可通过细胞外调剂蛋白激酶和PI3K/AKT信号通路刺激Zeb1和Zeb217的表达,从而促进前列腺癌的EMT进程[33]。因此,lncRNA ATB有成为预测前列腺癌患者预后新指标的潜力,而TGF-β1作为部分lncRNA调控EMT的核心指标,在lncRNA靶点相关阻断剂的研究中也极具价值。此外,PAN等[34]证明lncRNA MNX1-AS1可通过调控增殖细胞核抗原和磷酸化组蛋白H3影响DU145细胞中EMT标记蛋白的表达水平,从而抑制其EMT进程。这提示了在lncRNA与EMT相关蛋白直接作用的背后,其他潜在的作用因子和调控机制有待探究。
综上所述,目前的研究多集中于ceRNA机制,或局限于已知的转化相关因子和信号通路。但lncRNA是参与前列腺癌EMT调控中涉及基因蛋白互作最多的ncRNA,在前列腺癌高效靶点的发掘及临床转化中极具潜力,后继仍需更多深入的研究将其中的复杂机制阐述清楚。
3circRNA与前列腺癌EMT
circRNA是没有5′端或3′尾巴的独特共价闭合环状RNA分子,能以较强的稳定性在哺乳动物细胞中广泛表达[35]。在膀胱癌、乳腺癌和肝癌等癌症中表达失调的circRNA,可通过包含ceRNA在内的多种机制影响肿瘤的发生、发展。但其在前列腺癌中的调控作用还处于初步探索阶段,对前列腺癌EMT的分子机制更是知之甚少。
YAN等[36]在IFN-γ诱导的PC3细胞中以高通量测序筛选了差异表达的circRNA,其中,800多种circRNA经京都基因与基因组百科全书富集分析后均富集于与EMT相关的信号通路中,表明这些circRNA可能调控前列腺癌的EMT进程。研究表明,IFN-γ处理组的E-cadherin表达水平下调,Twist1表达水平上调,构建的circRNA-miRNA-mRNA网络提示,circ0001165可通过miR-187-3p调节TNF以诱导前列腺癌细胞中EMT的发生,circ0001085则通过miR-196b-5p间接调节PI3K/AKT和TGF-β信号通路,进而调控EMT进程[36]。然而,这些数据分析提供的机制线索需要加以验证。生物信息学分析提示,在前列腺癌组织中上调的circ0005276是X连锁凋亡蛋白抑制剂(XIAP)的宿主基因,研究表明circ0005276通过与RNA结合蛋白相互作用激活XIAP的转录,从而促进前列腺癌细胞的的增殖和EMT进程[37]。作为后起之秀,circRNA同样可作为ceRNA以“miRNA海绵”参与促进或抑制前列腺癌的EMT进程。JIN等[38]证实,沉默前列腺癌中高表达的circZNF609,PC3细胞的vimentin、蛋白水解酶3、蛋白水解酶9和基质金属蛋白酶9下调。circZNF609可通过上调miR-186-5p,负向调控Yes相关蛋白1通路和单磷酸腺苷活化蛋白激酶信号途径,从而抑制前列腺癌的细胞迁移和侵袭。另外,YANG等[39]研究发现,过表达前列腺癌细胞中的circSMAD2可致miR-9水平下调,E-cadherin水平上调,vimentin水平下调,表明EMT进程受阻。结果显示,circSMAD2可通过下调miR-9抑制前列腺癌的EMT进程[39]。在前列腺癌中低表达的circAMOTL1L则可充当miR-193a-5p的海绵,通过弱化原钙黏蛋白超家族中的Pcdha基因簇抑制miR-193a-5p,下调E-cadherin和β-catenin,从而促进前列腺癌的EMT进程[40]。同样在前列腺癌中低表达的circITCH与前列腺特异性抗原、肿瘤分期和Gleason评分等高度相关,过表达该基因可抑制前列腺癌的恶性表型转化,circITCH可通过充当miR-17-5p的海绵,上调HOXB13基因的表达,从而促进前列腺癌的恶性进展[41]。无论是促癌或抑癌基因,这些circRNA的初步研究结果均有指示意义,为circRNA的深入探究做了铺垫。
尽管circRNA在前列腺癌EMT中有调控作用,但具体机制和调控方式仍不清楚。circRNA作为结构稳定性最强的ncRNA,其在细胞中的差异表达被认为与肿瘤的恶性侵袭有密切关系,miRNA和lncRNA在前列腺癌EMT中的调控机制或许可以为起步较晚的circRNA提供一定线索,甚至发现更多关于这3种ncRNA共同调控前列腺癌上皮向间充质转化的潜在联系。
4 总结与展望
EMT是一个多途径且多基因参与的生物学过程,在前列腺癌的恶化转移中极为关键。因ceRNA模式而紧密联系起来的ncRNA,在前列腺癌EMT中构成庞大的调节网络,与其他潜在机制一同为前列腺癌EMT的深层探究提供了全新、全面的视角。尽管对ncRNA调控前列腺癌EMT的研究有所收获,但其具体机制仍需更多可靠的数据。且安全有效的癌基因传递系统和有效肿瘤抑制剂的开发也亟需解决,以此才能促进靶点的临床转化。相信随着高通量测序技术和生物信息学的日益进步,高效的ncRNA分子靶标将被成功运用于临床,攻克前列腺癌恶性转移的难题。
