大黄酸对CCl4中毒肝纤维化大鼠肝脏中α-SMA、MMP-13及TIMP-1的影响①
2021-01-12卢凤美位小杰张晓波刘东璞佳木斯大学基础医学院黑龙江佳木斯154007
郭 冶,卢凤美,黄 蓉,位小杰,张晓波,刘东璞(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
肝脏疾病(肝炎、肝硬化、肝癌等)是导致人们健康负担的重要原因,据报道:全球肝硬化患者死亡人数1980年约67.6万[1],2013年约122.1万[2],而肝纤维化(hepatic fibrosis)是其发生、发展的中间环节。肝纤维化是指各种病因,如感染、病毒、寄生虫、药物、酒精、遗传、化学毒物等,引起肝细胞发生炎症及坏死等变化,刺激并激活静止的肝星状细胞(quiescent HSCs, qHSCs),活化的肝星状细胞(activated HSCs, aHSCs)转化成可以释放大量α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的肌成纤维细胞(myofibroblast, MFB),进而肝脏中细胞外基质(extracellular matrix, ECM)的合成与降解平衡失调,导致肝内纤维胶原组织异常沉积的病理过程。随着“补充和替代医疗(Complementary and Alternative Medicine,CAM)”的发展,新型生物活性物质,如特性中药成份及早干预肝纤维化是有效的[3]。通过本实验研究大黄酸有抑制肝纤维化发展的作用[4,5]。
1 材料与方法
1.1 材料
1.1.1 实验动物
健康成年SPF级SD雄性大鼠(180~220g)60只。由佳木斯大学实验动物中心提供,使用许可证号:[SYXK(黑)2016-014)。本研究根据美国第8版《实验动物饲养管理和使用指南》中国际公认的实验室动物使用和护理原则,健康和营养状况在同一水平的大鼠进行观察喂养,进行实验。
1.1.2 实验试剂
大黄酸购于淮安市巍伟植化研究所,秋水仙碱(国药准字H20113208)广东彼迪药业有限公司生产,α-SMA多克隆抗体购于Boster公司,MMP-13及TIMP-1单克隆抗体购于Abcam公司,RT-PCR试剂盒均购于Foregene公司。
1.2 方法
1.2.1 动物分组
将60只大鼠饲养于恒温(22±2)℃条件下,标准柱粒状饲料饲养,自由饮水,观察3d后随机分为5组,分别为:空白对照组(N组),CCl4模型对照组(M组)、秋水仙碱干预组(C组)、大黄酸低剂量干预组(RL组)、大黄酸高剂量干预组(RH组)。每组各12只。
1.2.2 动物模型建立
肝纤维化模型制备:M、C、RL、RH组大鼠腹腔注射40%CCl4与花生油混合物,3mL/kg,2次/周。N组腹腔注射等体积的花生油,共7周。
1.2.3 动物给药方法
造模后3周,C、RL、RH组大鼠分别给予秋水仙碱0.2mg/kg、大黄酸50mg/kg、大黄酸100mg/kg溶于生理盐水的混悬液灌胃治疗,3次/周,共4周。N组、M组给予等体积的生理盐水灌胃。
1.2.4 肝组织病理学、IHC及RT-PCR观察
各组大鼠肝脏组织取制作好的石蜡切片,进行苏木素&伊红(H&E)染色,采用SABC法进行IHC实验,光学显微镜下观察α- SMA、MMP-13及TIMP-1蛋白阳性结果表达情况。按照RT-PCR试剂盒从肝脏组织中提取总RNA,再以1.0ug总RNA作为模板, 去gDNA 42℃ 2min, 失活 gDNase42℃ 15min,失活逆转录酶85℃ 5sec,合成cDNA。进行荧光定量实时PCR扩增反应,95℃ 10min,95℃ 15sec,60℃ 1min进行40个循环,从而得出同时测出的需检测基因与内参基因扩增产物Ct值,进而检测2-ΔΔCt值进行靶基因细胞因子的定量分析。以上述观察肝纤维化活跃程度。引物由通用生物合成,见表1。
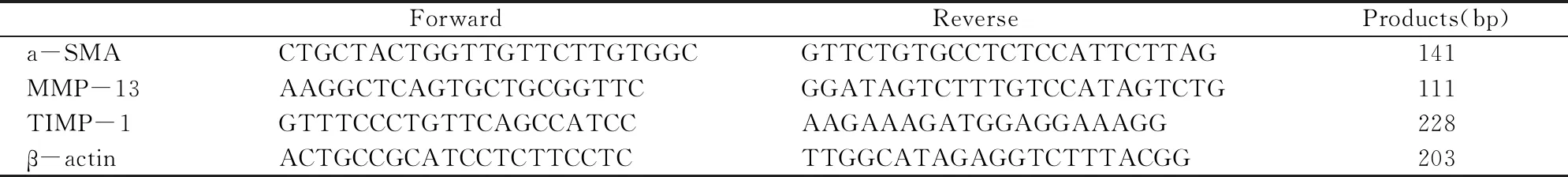
表1 实时PCR反应的引物设计
1.3 统计学方法
2 结果
2.1 大鼠肝脏组织病理学观察
大鼠肝脏组织切片进行H&E染色后,经病理科医师判定诊断:N组肝小叶结构排列整齐,肝细胞形态正常;与N组比较,M组肝小叶结构紊乱,肝小叶间大量纤维胶原组织增生,较宽,延伸入小叶间,有少量形成完整假小叶间隔,肝条索间隙增宽,伴肝细胞脂肪变及气球样变;与M组比较,C、RL、RH组纤维胶原组织明显减少,其中RH组纤维化程度最轻。见图1。
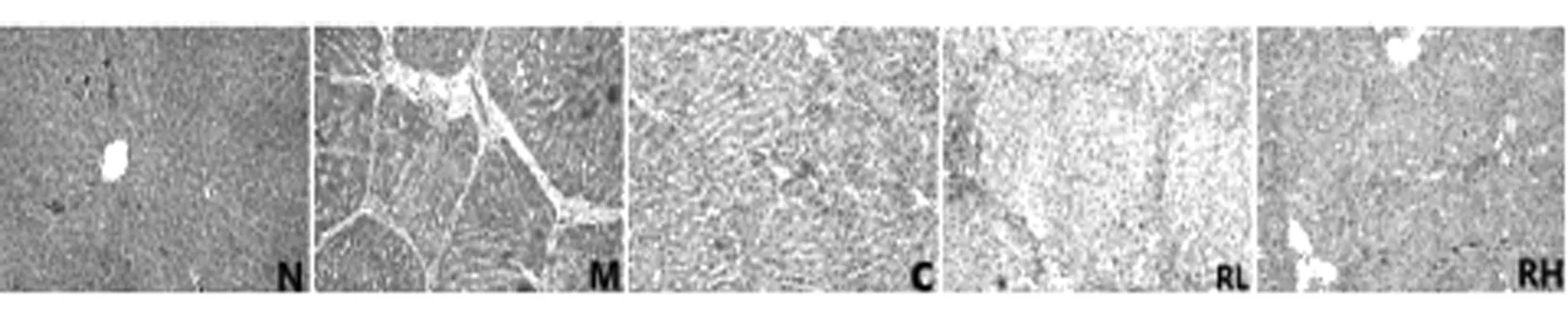
图1 实验第7周末各组大鼠肝脏组织病理学结构(H&E,×200)
2.2 大鼠肝脏组织IHC中a-SMA和MMP-13蛋白的表达
大鼠肝脏组织IHC切片观察,纤维胶原组织呈棕黄色为阳性表达。见图2、3。在α-SMA蛋白表达中,N组阴性表达,中央静脉边缘少量棕黄色着色;与N组比较,M组肝纤维胶原组织及中央静脉区全部表达阳性;与M组比较,C、RL、RH组阳性表达明显减少,其中RH组阳性表达程度最轻,说明肝纤维化程度越轻。在MMP-13蛋白表达中,N组阴性表达;与N组比较,M、C、RL、RH组阳性表达相对增加,其中RH组阳性表达程度最高,说明肝纤维化程度最轻。见表2。

表2 5组大鼠肝脏组织IHC中α-SMA、MMP-13因子AOD值的表达
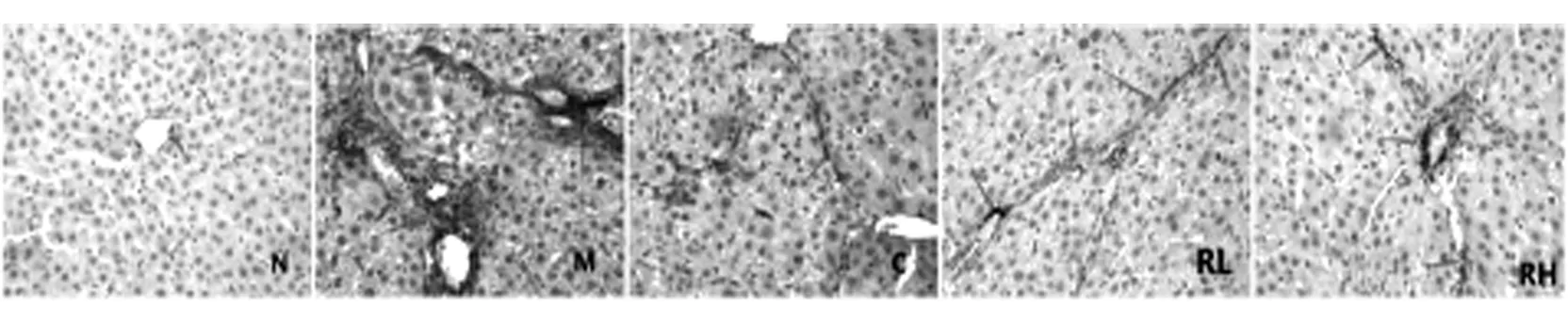
图2 实验第7周末各组大鼠肝脏组织a-SMA蛋白的表达(IHC,×400)

图3 实验第7周末各组大鼠肝脏组织MMP-13蛋白的表达(IHC,×400)
2.3 大鼠肝脏组织RT-PCR中a-SMA、MMP-13及TIMP-1 mRNA的表达
大鼠肝脏组织RT-PCR中a-SMA及TIMP-1 mRNA的表达,N组含量少,条带亮度轻;与N组比较,RH、C、RL、M组表达量逐渐升高,M组含量最高,条带亮度最重;MMP-13 mRNA的表达,M组表达最少,与M组比较,N、C、RL、RH组表达量及亮度逐渐升高,其中RH含量最高。见图4。
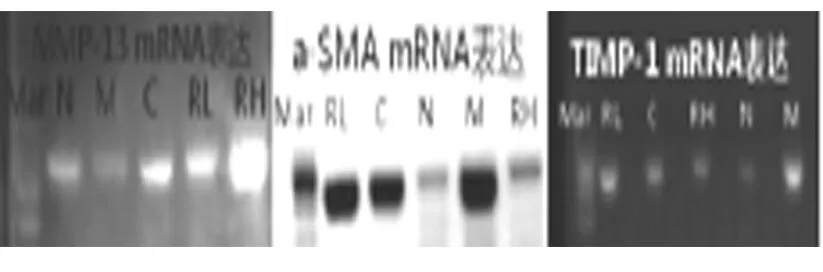
图4 实验第7周末各组肝脏组织琼脂糖凝胶电泳
3 讨论
肝纤维化早期阶段,胶原沉积在Disse间隙内皮下,使间隙变小甚至完全消失,进而肝窦毛细血管化,肝细胞间的物质运输受阻,终因缺血缺氧、变性坏死,导致功能障碍;晚期阶段(即肝硬化),形成假小叶及结节,甚至发展到肝癌等严重肝病时,肝移植仍是唯一的根治途径[6]。截止到目前,即使临床上广泛应用非侵入性检测方法,但活检仍然是诊断肝纤维化分期的金标准[7]。α-SMA是HSC活化的标志物,血小板衍生生长因子-D(PDGF-D)未能增强α-SMA的产生,能上调TIMP-1表达的能力[8]。干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)和表皮生长因子(EGF)能通过刺激Smad7蛋白表达来抑制TGF-β/Smad诱导的包括肝纤维化的反应[9]。活化的肝星状细胞分泌金属蛋白酶组织抑制剂(TIMPs),抑制基质金属蛋白酶(MMPs)的活性,并抑制它们降解ECM中的纤维化物质[10]。
大黄酸作为一种天然自噬调节因子,可通过调节AMPK / mTOR信号途径有效抑制肾小管细胞的自噬活性[11],通过TGF-β/ Smad和Wnt /β-catenin信号通路,显著降低了肾细胞中TGF-β引起的Klotho启动子转录,从而起到抗肾纤维化作用[12]。屈艳等人通过大黄酸抑制miR-21及干预TGF-β1/ Smad7通路的研究,证实大黄酸抗肺纤维化作用[13]。郭美姿等人通过CCl4造模大鼠肝纤维化进一步检测TGF-β1和α-SMA的表达,给予大黄酸高低剂量,从大黄酸抗炎、抗氧化及抑制肝星状细胞的活化,抑制TGF-β1作用等可能相关角度考虑,从而验证大黄酸抗肝纤维化作用[14]。
本实验通过细胞因子mRNA及蛋白的表达情况验证了大黄酸有延缓肝纤维化进展的作用,大黄酸低剂量组与临床常用西药秋水仙碱组比较差异不显著,无统计学意义(P>0.05),大黄酸高剂量组疗效明显优于秋水仙碱组(P<0.05)差异显著。由于本次实验方法与条件有限,只做了IHC及RT-PCR,还不能揭示大黄酸抗肝纤维化的分子机制,将来还可以通过细胞因子作用的通路和基因敲除等进一步探究肝纤维化的作用机制,我们渴望在未完全进入临床前做大量动物及细胞实验,进而做出正确的判定,为今后在临床中的应用打好提前战。
