氮肥和种植密度对燕麦叶片衰老特性及细胞结构的影响
2021-01-09贾志锋琚泽亮刘凯强赵桂琴
贾志锋,马 祥,琚泽亮,刘凯强,赵桂琴
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.青海大学畜牧兽医科学院,青海省青藏高原优良牧草种质资源利用重点实验室,青海 西宁 810016)
叶片不仅是光合作用的主要器官,同时也是植株与外界进行物质和能量交换的纽带[1-2]。叶片提前终止发育阶段严重影响后期产量积累,有研究表明生物或非生物胁迫造成的作物叶片过早衰老,可使作物减产50%,在世界范围内是粮食减产的首要原因[3]。叶片衰老是叶片发育的最终阶段,是一种程序性的细胞死亡,衰老是生物界普遍存在的一种现象[4-5]。衰老是叶片开始衰变的重要信号,其并不是一个被动的衰退过程[6],一方面严格受基因调控[7],另一方面也被生存环境所影响。Lohman等[8]研究拟南芥(Arabidopsisthaliana)发现,SAG系列基因与衰老相关,并证明SAG12基因与衰老高度特异;Xia等[9]在小麦(Triticumaestivum)叶片和叶鞘中鉴定出叶片衰老的负调控因子NAC1,该转录因子上调表达可以延缓小麦叶片衰老速度,增加产量和籽粒蛋白含量。良好的生境延缓叶片衰老的发生和速度,甚至可以逆转一些早期已经衰老的表型,而逆境则加速衰老进程[10]。前人研究提出的激素平衡[11-12]、营养胁迫[13]和程序性细胞死亡[14]等理论较为合理的解释了叶片衰老的机理,在此基础上,学者们对叶片衰老本质和延缓叶片衰老措施的研究也在不断深入,对提升作物生产力具有重要意义。
优化氮肥施量和种植密度是优化群体结构、提高作物产量、改善作物品质的有效途径[15]。在丰产栽培试验中,通过管理措施调控延缓作物叶片在生殖生长阶段的衰老速度,使之能持续不断地向生殖器官输送养分,是作物增产行之有效的手段之一[16]。氮素影响植物的代谢过程和生长发育,被认为是植物的生命元素[17],过量施氮或氮肥不足都会引起营养体氮素再分配比率失衡,加速叶片的衰老,进而影响产量。Pommel等[28]研究发现,衰老速度不同的玉米(Zeamays)品种,在良好的氮肥环境能延缓早衰型玉米的穗下叶衰老速度,并且增加成熟期向种子转移物质的比率。增施氮肥改善小麦的产量构成,提高旗叶叶绿素含量、可溶性蛋白含量,提高超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)活性,减少膜脂过氧化和丙二醛(Malondialdehyde,MDA)积累,使旗叶保持较长的绿叶期,增加生产潜力[18]。不同品种各生育期的绿叶面积和叶绿素含量受到氮肥施量的影响[19-20],在一定范围内随着种植密度的增加而提高,但种植密度进一步增加会缩短叶片功能期、降低叶片的光合性能,使其提前衰老,进而造成减产[21],因此种植密度是影响叶片衰老的另一关键因素。
燕麦(Avenasativa)是我国高寒区和半农半牧区广泛种植的粮饲兼用型作物[22],因其耐寒、耐瘠薄、抗逆性强、病虫害少、抗杂类草等特点,在青藏高原地区得到大面积推广,推动了该地区畜牧业的良性发展。燕麦营养价值丰富、茎叶柔嫩多汁、青刈饲料和青干草品质优异,是冬季牧场重要的补饲来源,对缓解冬季草场压力和保护生态方面起着重要作用[23]。提高燕麦生产力有利于改善草畜矛盾、增加经济产出,而燕麦叶片衰老、过早进入失绿阶段对产量增加影响极大。因此,本研究以青海省本地推广品种‘青燕1号’为试验对象,通过不同的栽培管理,探究氮肥施量与种植密度对燕麦衰老的影响,以维持燕麦较高的绿叶期,增加产出效益,为生产提供技术指导。
1 材料与方法
1.1 试验地概况
试验地位于青海省湟中县上新庄村(101°37′ E,36°28′ N),海拔2 620 m,气候寒冷潮湿,无绝对无霜期,年均温3.7℃,年平均降水量481 mm。试验土地平整,质地为栗钙土,土壤全氮含量为1.4 g·kg-1,有效磷含量为22.2 mg·kg-1,速效钾含量为98.5 mg·kg-1,pH值为7.9。前茬作物为荞麦(FagopyrumesculentumM.)。
1.2 试验材料
供试材料为‘青燕1号’(A.sativa‘Qingyan No.1’),由青海省畜牧兽医科学院种质资源库提供,为2015年收获种子。
1.3 试验设计
分别设置氮肥3个水平,0 kg·hm-2(N0),90 kg·hm-2(N1),180 kg·hm-2(N2),氮肥品种为尿素(含N46%);种植密度设3个水平,60 kg·hm-2(D1),180 kg·hm-2(D2),300 kg·hm-2(D3)。试验共9个处理,3次重复,随机区组排列。小区3 m×5 m,种植行距25 cm,小区间隔1 m,区组间隔1 m。
种植前进行了深耕灭茬、耙耱碎土、平整和镇压紧实等一系列作业,试验于2016年4月23日条播种植。磷肥作为基肥在种植时一次施入。出苗后进行消除田间杂草及病虫害防治等管理措施。除施氮肥外,每公顷施磷肥(P2O5)90 kg·hm-2,品种为过磷酸钙(P2O512%)。
1.4 测定指标及方法

1.4.2切片制作 采用常规石蜡切片技术,并根据试验具体情况加以改进。于开花期在每小区中间随机挑选长势一致的燕麦植株20株,采集旗叶供试。取叶片中段6~8 mm,FAA(甲醇:冰乙酸:70%乙醇= 1∶1∶18)固定液固定24 h,用酒精系列脱水,以95%伊红酒精溶液替代95%酒精溶液,避免材料丢失,二甲苯逐级透明,54℃~56℃石蜡逐步浸蜡、包埋,Hestion自动轮转式石蜡切片机(ERM 3000,常州市郝思琳医用仪器有限公司)切片,切片厚度为10 μm,40℃下展片,37℃充分烤片,再以番红(30 min)-固绿(5 s)2重染色法染色。Olympus BX61正置万能显微镜下观察并拍照,Image-Pro Plus 5.0软件对上、下表皮厚度、叶片厚度、主维管束面积、相邻维管束间距进行测量,并对叶绿体数目进行统计。
1.5 数据分析
采用Microsoft Excel 2016软件进行数据整理,数据分析采用SPSS 16.0软件进行方差分析、Duncan多重比较,采用Origin 2018作图。
2 结果与分析
2.1 氮肥和密度对燕麦叶片衰老特性的影响
不同氮肥和密度对燕麦叶片衰老指标的影响的方差分析见表1,氮肥、密度以及二者互作对各指标的影响均达到极显著差异水平(P<0.01)。
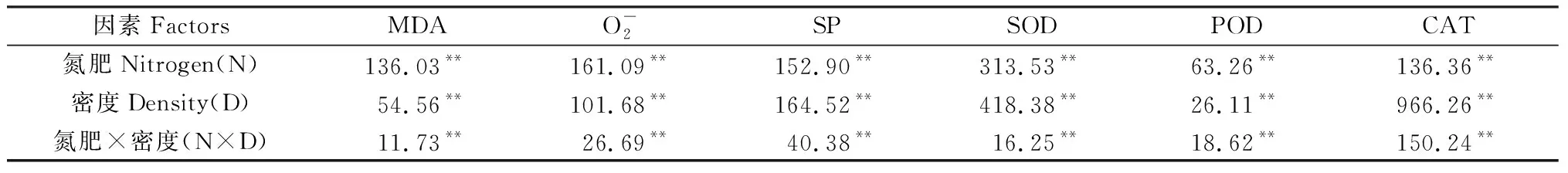
表1 氮肥和密度对燕麦叶片衰老特性影响的方差分析Table 1 Variance analysis of effects of nitrogen and density on leaf senescence characteristic of oat

SOD,POD和CAT作为植物抗氧化系统的关键酶,其活性的大小经常评价叶片生理状况是否良好的重要参数,同一氮肥水平下,随着种植密度增加,SP含量均以D3最低,分别为17.39,21.62和15.45 mg·g-1,说明高密度种植不利于SP的积累;SOD活性随着种植密度增加在各氮肥水平下均不断下降,种植密度对其影响明显;POD活性在N0和N1水平下随种植密度增加无显著差异,但在N2水平下有明显下降趋势;CAT活性整体随种植密度增加先增后减,分别以D2密度水平最高,D3最低。
同一种植密度下,SP在D1密度下随施氮量显著增加,在D2和D3密度下随氮肥增加先增后减,以N1水平最高;SOD活性随着施氮量增加,在D1和D2水平下以N1施肥量最高,在D3水平下以N1和N2施肥量最高;POD活性在D1,D2和D3水平下随施氮量的增加先增后降,且D2和D3水平下N2施肥量POD活性显著低于N1施肥量;CAT活性在D1和D2水平下随着随施氮量增加而增加,在D3水平下随施氮量增加而减小。
综上可得,高氮密植会增加燕麦叶片的氧化胁迫程度,降低抗氧化酶及可溶性蛋白的活性和含量,加速叶片的衰老,因此,适当的施氮和合理的种植密度是保持叶片良好的生理状态、提高产量的重要手段。
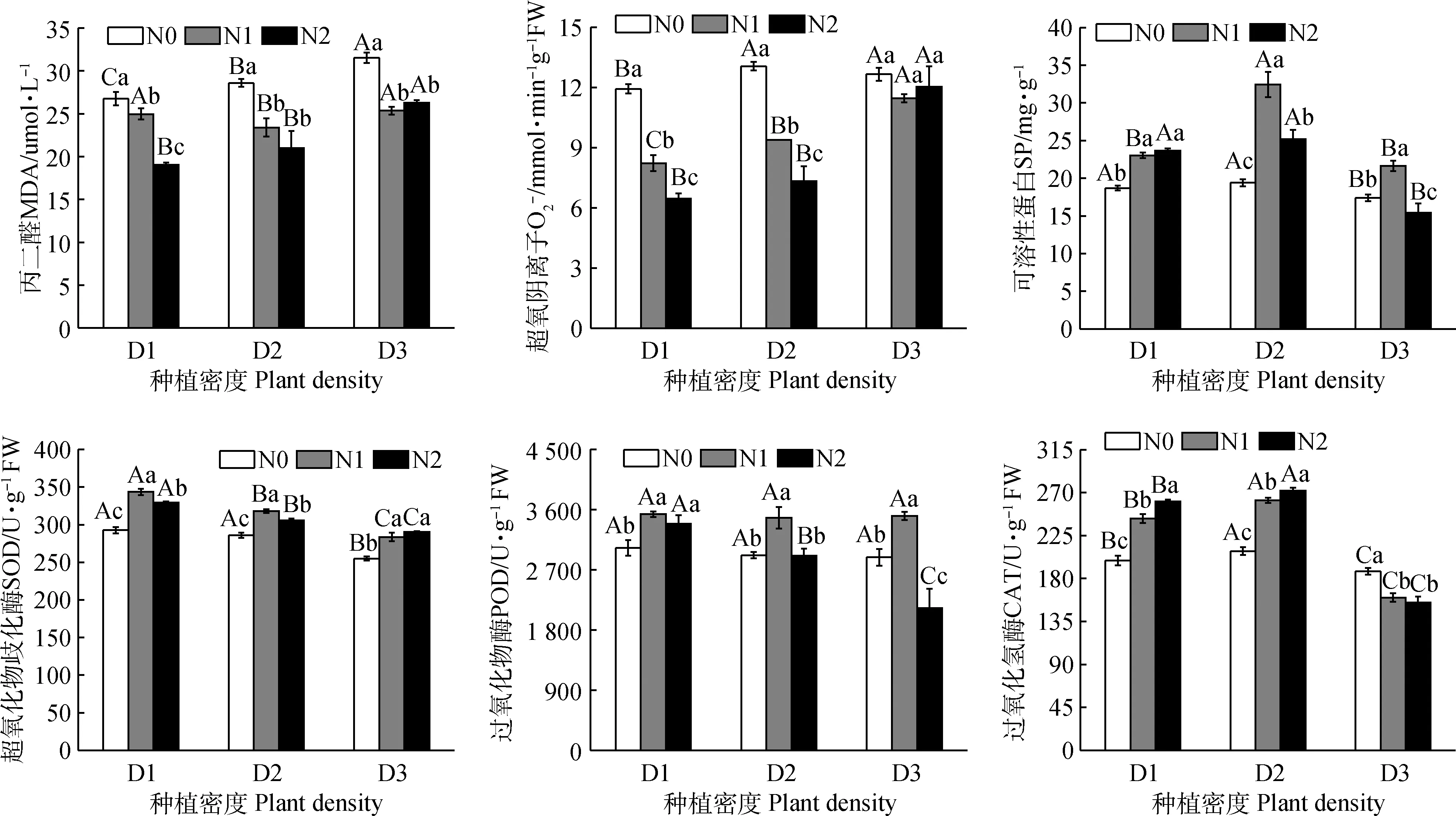
图1 氮肥和密度对燕麦叶片衰老指标的影响Fig.1 Effects of nitrogen and plant density on leaf senescence index of oat注:不同大写字母表示同一氮肥水平下各种植密度间差异显著(P<0.05);不同小写字母表示同一种植密度下各氮肥水平间差异显著(P<0.05);N0,N1和N2分别表示0,90和180 kg·hm-2的施氮量,D1,D2和D3分别表示60,180和300 kg·hm-2的播种量。下同Note:Different capital letters indicated significant differences among different plant density under the same level of nitrogen (P<0.05);different lowercase letters indicated significant differences among different levels of nitrogen under the same plant density (P< 0.05);N0,N1 and N2 represent nitrogen fertilizer rates at five levels of 0,90 and 180 kg·hm-2,respectively,D1,D2 and D3 represent sowing rate at three levels of 60,180,and 300 kg·hm-2,respectively. The same as below
2.2 燕麦叶片显微结构变化
燕麦叶片为等面叶,结构比较简单,主要由3部分组成,分别是表皮、叶肉和叶脉(图2)。叶片的上、下表皮各由一层细胞组成,细胞较小且排列紧密。上表皮不同于下表皮,其上分布有泡状细胞,呈水滴状,不含叶绿体。叶肉组织也比较简单,由4~6层叶肉细胞及围绕着维管束排列的薄壁细胞组成,含有叶绿体。叶脉由一个大的主脉维管束和若干小维管束共同组成,起支撑作用,穿插分布于叶肉细胞内,是燕麦叶片的骨架部分。维管束鞘细胞由1~2层薄壁细胞组成,不含或很少叶绿体,没有与叶肉细胞组成C4植物特有的花环结构,因此,叶片解剖结构显示燕麦属于C3植物。
不同氮肥和密度对燕麦叶片细胞结构的影响的方差分析见表2,氮肥处理下上表皮厚度、下表皮厚度、叶片厚度、主维管束面积、相邻维管束间距和叶绿体数量均达显著(P<0.05)或极显著(P<0.01)水平;密度处理下除叶片厚度外,其余指标均达极显著(P<0.01)差异水平;而氮肥和密度二者互作仅在叶片厚度、主维管束面积、相邻维管束间距和叶绿体数量达到极显著差异(P<0.01)。

图2 燕麦叶片解剖结构Fig.2 Anatomical structure of leaf in oat注:A:叶尖;B:叶片中部;C:叶脉;ue:上表皮;le:下表皮;mc:叶肉细胞;bc:泡状细胞;gc:保卫细胞;st:气孔;ac:孔下室;ch:叶绿体;vb:维管束;xy:木质部;ph:韧皮部;mt:机械组织。下同Note:A:Leaf apex;B:Middle part of leaf;C:Vein;ue:Upper epidermis;le:Lower epidermis;mc:Mesophyll cell;bc:Bulliform cell;gc:Guard cell;st:Stomata;ac:Air cavity;ch:Chloroplast;vb:Vascular bundle;xy:Xylem;ph:Phloem;mt:Mechanical tissue. the same as below
2.2.1叶片上表皮厚度变化 施氮后随着种植密度的变化,燕麦叶片上表皮厚度在N0和N1水平下无明显差异(表3),但在N2水平下随着种植密度的增加上表皮厚度下降显著(P<0.05)。在同一种植密度下,随着氮肥施量增加,上表皮厚度总体呈现增加的趋势,其中以N2D1处理最高,说明增施氮肥和疏植对上表皮细胞发育具有一定的促进作用。
2.2.2叶片下表皮厚度变化 氮肥和密度配置对燕麦叶片下表皮厚度的影响变化与上表皮厚度相似,N0和N1施量对各种植密度下叶片的下表皮厚度无显著影响,施氮量增至N2水平后,随着种植密度增加叶片下表皮厚度开始下降;在D1和D2密度下,施氮(N1和N2)较不施氮(N0)叶片下表皮厚度增加了1.2~3.4 μm,但在D3密度下氮肥增施对下表皮厚度无显著影响。
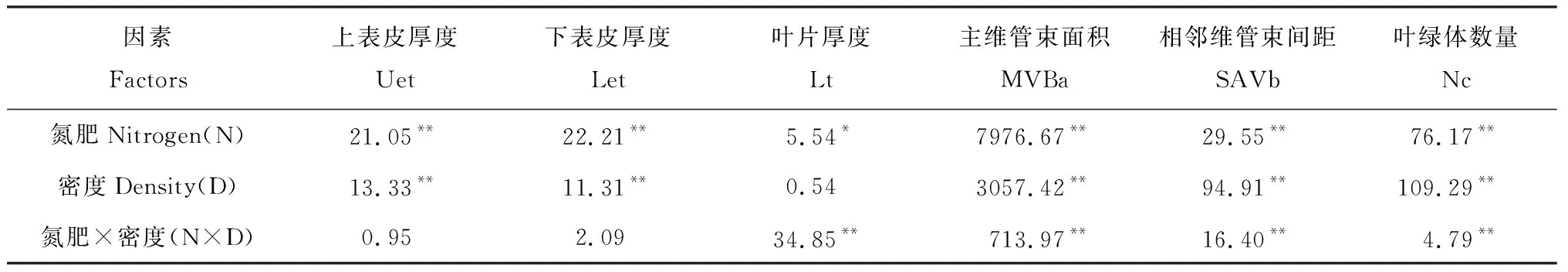
表2 氮肥和密度对燕麦叶片细胞结构影响的方差分析Table 2 Variance analysis of effects of nitrogen and density on cell structure of leaf in oat
2.2.3叶片厚度变化 施氮后燕麦叶片厚度随种植密度增加变化各异,以N1D1处理最高(257.2 μm),其次为N0D3处理(254.8 μm),叶片厚度受施氮量和种植密度影响较大,不同施氮量与密度组合对叶片厚度影响差异较大,尤其在D2和D3密度下,随着施氮量增加叶片厚度变化趋势相反。
2.2.4叶片主维管束面积变化 氮肥和种植密度对叶片主维管束面积大小影响显著(P<0.05),且不同施氮和种植密度组合影响程度不同。施氮肥后随着种植密度增加主维管束面积不断降低,且均以D3种植密度最低;在相同种植密度下随着氮肥施量提高,主维管束面积呈增加趋势。不同氮肥和密度处理下以N2D1处理最高,较最低处理N0D3高2.66倍,因此低氮密植不利于主维管束面积增加。
2.2.5叶片相邻维管束间距变化 随着种植密度增加,各施氮量下叶片相邻维管束间距变化不同,在N0和N2水平下,种植密度增加会减小叶片相邻维管束间距,而在N1水平下无显著影响;在相同种植密度下,除D2密度无明显变化外,氮肥施量增加增加了相邻维管束间距。
2.2.6叶片叶绿体数量变化 氮肥和种植密度改变后,叶绿体数量发生显著变化(P<0.05),单位面积叶绿体数量变化在7.0~18.3个之间。在相同施氮量下增加种植密度会减少叶绿体的数量,在同一种植密度下增施氮肥能缓解密度对叶绿体数量的抑制效应。
2.3 氮肥和密度对燕麦叶片解剖结构的影响
不同氮肥和种植密度水平下燕麦叶片解剖结构变化见图3,氮肥和种植密度的改变影响了叶片组织结构发育。从图中可以看出,施氮后随着种植密度增加,燕麦叶片的叶绿体数量下降明显,机械组织细胞数量明显减少,木质化程度降低,孔下室数量降低,导致叶片的通气能力下降,木质部导管面积和数量减小,疏导能力下降。由图3可知,在同一种植密度下,增施氮肥能缓解上述不良效应,随着氮肥施量的增加,燕麦叶片的叶绿体数量、机械组织和疏导组织大小均有不同程度提高,可见氮肥在一定程度上能缓解密度增加带来的抑制效应。

表3 氮肥和密度对燕麦叶片显微结构的影响Table 3 Variance analysis of effects of nitrogen and density on leaf microstructure of oat

图3 氮肥和密度对燕麦叶片解剖结构的影响Fig.3 Effects nitrogen and density on anatomical structure of leaf in oat
3 讨论

植物在叶片结构特征上的改变是对环境的适应性表现,叶片结构的差异与抗逆性和抗病能力密切相关[36-37]。外界环境的改变会引起植物叶片厚度、表皮细胞大小的改变。上表皮的厚度可以调节叶片表观量子效率,一方面上表皮层可以避免强光对叶肉细胞的灼伤,另一方面可以影响光量子的反射途径从而增加叶片内部光量子的密度[38]。因此,叶片厚度和上表皮厚度可以调节叶片内部水分平衡,更好的吸收漫射光和散射光,提高光能的截获效率[39]。本试验中,施氮肥后随着种植密度增加,叶片上表皮和下表皮厚度仅在180 kg·hm-2的施氮量下表现出差异,而相同种植密度下,施氮量增加提高了上表皮和下表皮厚度,可见氮肥对上下表皮厚度影响更大;叶片厚度受氮肥和密度互作影响显著,高密度种植下施氮量增加会使叶片变薄,这会造成叶片的储水能力下降、蒸腾效率降低,进而影响光能利用。一般而言,维管束面积、数目与植物对养分吸收的能力成正比[40]。维管束数量减少,水分运送效率就会降低,碳水化合物及矿物质不能及时运送到植物各个器官,进而导致机体代谢变缓,叶片合成及输送营养物质的能力下降,逐渐进入衰老阶段,这也是大多数植物生长后期叶片开始大量衰老脱落的重要原因。本试验中,低氮密植有利于减小相邻维管束间距,增加单位面积的维管束数量,而高氮疏植会增加主维管束面积,因此,在尽可能增加维管束面积的同时,增加单位面积的维管束数量,需要合理的氮肥和密度配置。
叶绿体是植物进行光合同化的关键器官,叶绿体的数量决定了叶片光合速率的上限,Ford等[41]认为衰老过程通常分为两个阶段,首先是叶绿体功能下降,其次是叶绿体含量下降和丧失的短暂终末期,而Inada等[42]认为只有在叶片的衰老后期才会发生叶绿体数量的改变。本试验中,低种植密度下各施氮水平均保持较高的叶绿体数量,密度对叶绿体数量的影响高于其他因素,因此,低密度种植有利于增加叶片的光合效率,延缓衰老。
4 结论