荒漠灌区苜蓿后茬轮作不同作物对土壤细菌群落的影响
2021-01-09南丽丽郭全恩刘雪强
南丽丽,郭全恩,刘雪强
(甘肃农业大学草业学院,甘肃 兰州 730070)
微生物量碳氮和酶活性作为土壤微生物活性的重要指标,是土壤养分转化和有机质分解的关键因子,常被用于评价土壤质量的生物学特性[1-4]。土壤呼吸是土壤碳库的主要输出途径,可以衡量土壤的生物活性,其大小能反映土壤的养分转化和供应能力[5]。大量研究表明,与单一连作的种植模式相比,在相同管理条件下与不同作物轮作能改变土壤微生物组成,增加细菌多样性,保持地力,缓解连作障碍[6-7]。
紫花苜蓿(Medicagosativa)作为多年生优质豆科牧草,在世界和中国广泛栽培。然而,苜蓿生长多年会导致土壤自毒物质的积累,随着苜蓿生产年限的增加,土壤养分及水分会显著下降,导致土壤环境恶化,使苜蓿产量、品质下降[8]。科学轮作可以有效缓解连作障碍引起的土壤环境恶化,使土壤中微生物活性增强、多样性增加,为后续作物生长提供健康稳定的土壤生态环境[9]。鉴于此,本试验以5年生紫花苜蓿地为研究对象,研究苜蓿长期生长及轮茬不同作物对土壤生物学活性及细菌群落多样性的影响,旨在为荒漠灌区采用轮作措施消减紫花苜蓿连作土壤自毒效应提供科学依据,同时也为草地生态环境保护提供理论指导。
1 材料与方法
1.1 研究区概况
1.2 试验材料与样地
试验采用完全随机设计,共5个处理,分别为CK:6年生苜蓿地,T1:5年生苜蓿地轮作小麦(Triticumaestivum),T2:5年生苜蓿地轮作油菜(Brassicachinensis),T3:5年生苜蓿地轮作葵花(Helianthusannuus),T4:5年生苜蓿地轮作玉米(Zeamays),每个处理3次重复。供试苜蓿、小麦、油菜、葵花、玉米品种分别为‘甘农3号’紫花苜蓿(M.sativaL.‘Gannong No.3’)、‘陇春29号’(T.aestivum.‘Longchun No.29’)、‘圣光402’(B.chinensis‘Shenguang No.402’)、‘食葵LD5009’(H.annuus‘No.LD5009’)、‘陇单10号’(Z.mays‘Longdan No.10’),种子均由甘肃农业大学草业学院提供。
2014年7月15日人工开沟条播苜蓿,播深2 cm,播量20.0 kg·hm-2,行距20 cm,小区面积667 m2;2018年9月底用机械挖除苜蓿(留100 m2苜蓿地),人工捡拾苜蓿根系,于2019年4月25日在连种5年苜蓿地上,人工开沟条播小麦和油菜(行距20 cm)、覆膜点播玉米和葵花(行距20 cm,株距20 cm),播种量分别为150.0 kg·hm-2,15.0 kg·hm-2,150.0 kg·hm-2,15.0 kg·hm-2,除油菜播深为1~2 cm外,其余播深均为3~4 cm,每个处理3次重复,小区面积20 m2(4 m×5 m),播前浇一次底墒水,未施肥,田间管理一致。于2019年9月14日用土钻在各小区按“S”形路线5点取样法采取0~20 cm土层土样,3次重复。土样混匀后装入已灭菌袋中用冰盒迅速带回。将土样分为两份,一份在4℃冰箱中保存用于土壤生物学指标测定,另一份在-80℃冰箱中保存用于土壤微生物总DNA提取。
1.3 土壤生物学指标测定
土壤微生物量碳(soil microbial biomass carbon,SMBC)含量[10]、土壤微生物量氮(soil microbial biomass nitrogen,SMBN)含量[11]采用氯仿熏蒸法测定,
SMBC=EC/KEC
EC=熏蒸土壤有机碳质量分数-未熏蒸土壤有机碳质量分数。
SMBN=EN/KEN
EN=熏蒸土壤全氮质量分数-未熏蒸土壤全氮质量分数。
KEC:转换系数,取值0.38;KEN:转换系数,取值0.45。
土壤脲酶活性(Urease activity,UA)采用靛酚蓝比色法测定[12],以24 h后1 g土壤中NH3-N质量(mg)表示;碱性磷酸酶活性(Alkaline phosphatase activity,APA)采用磷酸苯二钠(用硼酸缓冲液)比色法测定[12],以24 h后1 g土壤中释放出的酚质量(mg)表示;蔗糖酶活性(Sucrase activity,SA)采用3,5-二硝基水杨酸比色法测定,以24 h后1 g土壤中的葡萄糖的质量(mg)表示[12];过氧化氢酶活性(Catalase activity,CA)采用紫外分光光度法测定[13],以20 min内1 g土壤中分解的过氧化氢的质量(mg)表示;土壤呼吸速率(Soil respiration,SR)采用LICOR-6400便携式光合作用仪连接6400-09土壤叶室(Li-Cor Inc,Lincoln,NE,USA)测定[14],每次测定时,齐地面剪去管中的作物;测定所用PVC基座直径10 cm、高5 cm,提前24 h嵌入土中约3 cm,每个小区3次重复;pH值采用土水比1∶5悬液用pHS-4智能酸度计测定。
1.4 土壤总DNA提取及细菌16S rRNA基因扩增
采用十六烷基三甲基溴化铵(cetyltrimethyammonium ammonium bromide,CTAB)方法对样本的基因组DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng·μL-1。以稀释后的基因组DNA为模板,对细菌16SrRNA基因V4区采用带Barcode的特异性引物[15](515F和806R)进行PCR扩增,每个样品3次重复。根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序。
第二,学校要完善社团的申报制度。学生社团需要上报社团的学期计划、社团成员的名单、社团的活动开展情况及每学期的社团的工作总结。
1.5 生物信息学分析
根据Barcode序列和PCR扩增引物序列从测定数据中拆分出各样品数据,截去Barcode和引物序列后对每个样品的reads进行拼接[16]后得到原始测序数据;原始测序数据经质检和嵌合体去除得到有效数据(effective tags)。利用Uparse软件对样品的有效序列进行操作分类单元(operational taxonomic units,OTUs)聚类(相似度97%以上),用Mothur方法[17]与Silva软件的SSUrRNA数据库[18]进行物种注释(设定阈值为0.8~1.0);采用MUSCLE(3.8.31)软件[19]进行快速多序列比对,最后对测序数据进行标准化处理,采用Qiime(1.9.1)软件计算Alpha多样性指数,使用R软件(2.15.3)绘制稀释曲线。Alpha多样性指数中,Chao1和Observed-species为菌群丰度指数。Chao1计算公式为:
式中,Sobs是观察到的物种数,n1是观察到的Singletons的种类数,n2是观察到的Doubletons的种类数。
Observed-species为试验中检测出的种类数;
式中,H表示Shannon Index值,R表示样品中物种的种类数,pi第i个物种所占百分比;Simpson反映一个种群的优势度,Simpson公式如下:
D=1-∑pi2
式中,pi表示物种i在样品中的比例。
1.6 数据分析
所有数据均采用SPSS 20.0软件进行处理分析,One-way ANOVA和Duncan氏新复极差法分析差异显著性。采用CANOCO 4.0软件对丰度前10的细菌门优势群落与土壤环境指标间的相互关系进行冗余分析。
2 结果与分析
2.1 各处理土壤生物学性质分析
由表1可知,不同处理对土壤生物学各指标均有显著影响(P<0.05)。其中微生物量碳含量、微生物量氮含量、土壤呼吸速率、pH值变化范围分别为120.61~360.31 mg·kg-1,54.82~101.74 mg·kg-1,4.38~11.10 μmol CO2·m-2·s-1,8.02~8.36,微生物量碳含量以T2处理最大,微生物氮含量和土壤呼吸速率以T4处理最高,pH值以CK最大;与CK相比,处理T1,T2,T3,T4的脲酶活性较CK处理分别增加了44.38%,13.03%,35.76%,53.98%,碱性磷酸酶活性是CK处理的1.53,7.78,4.25,7.28倍,过氧化氢酶活性较CK处理分别提高了8.96%,27.90%,13.56%,6.24%,蔗糖酶活性是CK处理的1.11,1.38,1.14,1.74倍。
2.2 土壤细菌群落丰度与Alpha多样性分析
由表2可知,通过Illumina HiSeq PE250高通量测序,得到有效序列、优质序列、OTUs分别为84 221~93 784条、75 522~82 720条、3 004~3 250个。各样品文库的覆盖度均在98%以上,并结合样品稀释曲线均趋于平缓,说明本研究测序数据合理,能够准确反映出土壤细菌群落的真实信息(图1)。不同处理土壤细菌群落丰富度指数(Chao1指数和ACE指数)为T2>T1>CK>T3>T4;细菌群落多样性指数(Simpson和Shannon-wiener指数)依次分别为CK=T1=T3>T2=T4,CK>T1>T3>T2>T4。如图2所示,所有样品中共有OTUs数目为2 712个,其中处理CK,T1,T2,T3,T4中所特有的OTUs数目分别为322,236,253,180和235个。

图1 样品稀释曲线Fig.1 Rarefaction curves for samples
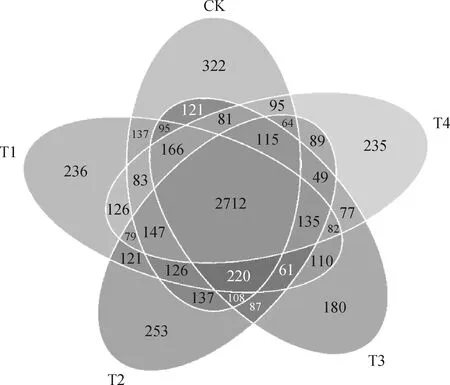
图2 样品韦恩图Fig.2 Venn diagrams of samples

表1 各样地土壤生物学性质Table 1 Soil biological properties of different soil sampling sites

表2 样品序列数统计、丰富度与多样性指数Table 2 Statistics of sample sequence numbers,and richness and diversity index
2.3 苜蓿后茬轮作不同作物土壤细菌群落分布特征分析
2.3.1门水平上的群落组成 由图3可知,各处理细菌群落相对丰度前10的细菌门分别为:变形菌门(Proteobacteria)(38.02%~44.69%)、酸杆菌门(Acidobacteria)(15.37%~21.80%)、芽单胞菌门(Gemmatimonadetes)(9.72%~14.08%)、放线菌门(Actinobacteria)(7.50%~12.51%)、类杆菌门(Bacteroidetes)(2.67%~5.43%)、蓝藻门(Cyanobacteria)(0.03%~4.42%)、奇古菌门(Thaumarchaeota)(0.22%~3.96%)、厚壁菌门(Firmicutes)(0.85%~3.88%)、绿弯菌门(Chloroflexi)(2.73%~3.57%)、棒状杆菌门(Rokubacteria)(0.75%~1.74%),共占细菌总数的94.21%~96.12%。其中变形菌门、酸杆菌门、芽单胞菌门和放线菌门相对丰度占细菌总数的79.32%~86.01%,说明这4个门的细菌为优势菌群。不同处理细菌在门分类水平上,相对丰度存在一定的变化趋势。与CK处理相比,轮茬后其变形菌门、芽单胞菌门、放线菌门、厚壁菌门、绿弯菌门、棒状杆菌门相对丰度呈减小趋势,其中T1,T2,T3,T4处理放线菌门、厚壁菌门、棒状杆菌门相对丰度较CK处理分别下降了15.59%,5.27%,1.78%和21.69%,11.75%,25.14%,24.28%和36.44%,5.25%,9.05%,23.30%和42.00%;而酸杆菌门、类杆菌门、蓝藻门、奇古菌门相对丰度呈增大趋势,蓝藻门、奇古菌门相对丰度T1,T2,T3,T4处理是CK的3.72,1.89,2.74,28.27倍,2.41,4.87,1.67,2.64倍。
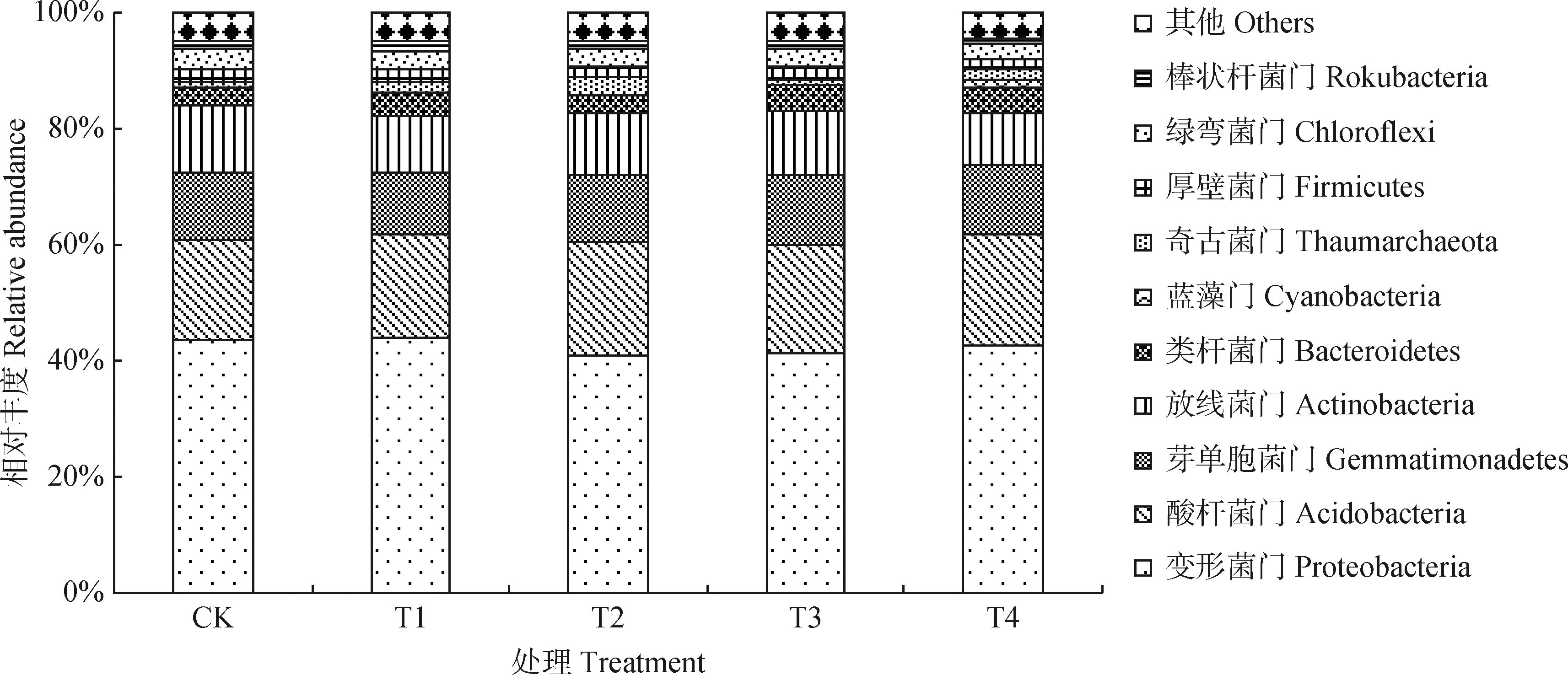
图3 不同处理门分类水平下土壤细菌群落相对丰度Fig.3 Relative abundance of soil bacterial community at phylum level of different treatments
2.3.2属水平上的群落组成 由图4可知,各处理细菌群落相对丰度前10的细菌属分别为:鞘氨醇单胞菌属(Sphingomonas)、未分类酸杆菌属、未分类胶鞘藻属(Coleofasciculaceae)、抗锑斯科曼氏球菌属(Skermanella)、摩根氏菌属(Morganella)、Haliangium属、芽单胞菌属(Gemmatimonas)、Stenotrophobacter属、溶杆菌属(Lysobacter)、交替红杆菌属(Altererythrobacter),相对丰度低于1%的类群占80.64%~86.28%。5龄苜蓿地轮作不同作物土壤细菌在属分类水平上,相对丰度存在一定变化趋势。与CK处理相比,其鞘氨醇单胞菌属(T3处理除外)、未分类胶鞘藻属、摩根氏菌属、芽单胞菌属、Stenotrophobacter属、溶杆菌属(T4处理除外)相对丰度呈增大趋势,而未分类酸杆菌属、抗锑斯科曼氏球菌属、Haliangium属、交替红杆菌属(T4处理除外)相对丰度呈降低趋势。
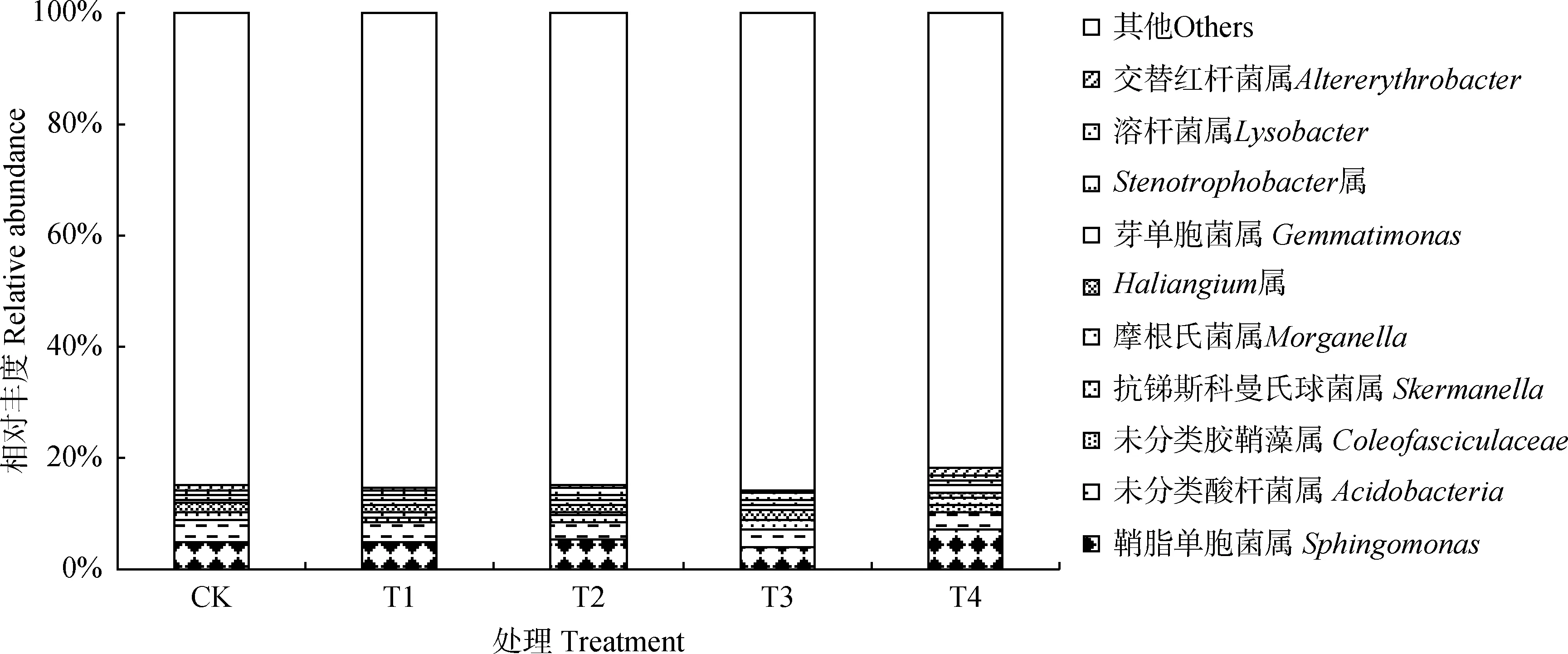
图4 不同处理属分类水平下土壤细菌群落相对丰度Fig.4 Relative abundance of soil bacterial community at genus level of different treatments
2.4 细菌优势类群与土壤环境因子间RDA分析
通过RDA分析表明:第一、二排序轴累计解释率分别为25.53%和17.70%(图5)。其中,类杆菌门、蓝藻门、变形菌门相对丰度与土壤呼吸速率、微生物量氮含量、脲酶活性、pH值呈正相关;酸杆菌门、奇古菌门相对丰度与碱性磷酸酶和蔗糖酶活性呈正相关,与微生物量碳含量、过氧化氢酶活性呈负相关;厚壁菌门、棒状杆菌门、绿弯菌门、放线菌门相对丰度与微生物量碳含量、过氧化氢酶活性呈正相关,与蔗糖酶和碱性磷酸酶活性呈负相关;芽单胞菌门相对丰度与碱性磷酸酶活性呈正相关,与其他环境因子均呈负相关。

图5 细菌群落与土壤环境因子冗余分析Fig.5 Redundancy analysis for bacterial community and soil environmental factors注:x1,x2,x3,x4,x5,x6,x7,x8分别代表土壤呼吸速率,微生物量碳含量,微生物量氮含量,脲酶活性,碱性磷酸酶活性,过氧化氢酶活性,蔗糖酶活性,pH值Note: x1,x2,x3,x4,x5,x6,x7,x8 represent soil respiration, soil microbial biomass carbon, soil microbial biomass nitrogen, urease, alkaline phosphatase, catalase, sucrase, and pH value, respectively
3 讨论
土壤细菌群落结构受种植作物的影响[20],作物种类不同其土壤微生物所处环境不同,细菌组成和丰度大小有差异,不同的农田土壤中存在共有和特异的细菌种群[21]。本研究表明,不同处理下土壤细菌主要门类为变形菌门、酸杆菌门、芽单胞菌门和放线菌门,这与禾豆混播草地土壤细菌群落结构的研究结论相似[22],但与荒漠灌区苜蓿后茬分别轮作1年玉米和小麦、2年玉米和小麦后土壤细菌群落结构的研究结论不完全一致[23],这可能与后茬作物种类、轮作时间长短有关[24]。与苜蓿连作(CK)相比,苜蓿后茬轮作不同作物后其变形菌门、放线菌门、芽单胞菌门相对丰度呈降低趋势,而酸杆菌门相对丰度呈增加趋势。变形菌门在苜蓿连作(CK)处理中相对丰度最高,这可能是因为苜蓿根瘤菌属于α-变形菌,其连作有利于苜蓿土壤中根瘤菌的成长和积累[2];此外,也可能是由于变形菌门具有较好的耐盐性[25],在盐碱土壤中(本研究pH为8.01~8.36)相对丰度较高[26-27]。酸杆菌门是嗜酸性细菌,碱性土壤环境不利于其生长,所以在碱性环境中酸杆菌门细菌丰度相对较低[28],但本研究结果却表明酸杆菌门细菌是仅次于变形菌门细菌的第二优势种群,这可能是因为苜蓿地轮茬作物后未施肥,作物对土壤养分的消耗使土壤肥力下降,而酸杆菌门可以较好的生长在土壤养分较缺的环境中[29]。放线菌适宜生长在中性偏碱性pH值的土壤中[30],而轮作降低了土壤pH值,故苜蓿后茬轮作不同作物后土壤细菌放线菌门相对丰度有所降低。厚壁菌对土壤病原真菌具有拮抗作用[31],而本研究轮茬处理土壤中,厚壁菌相对丰度低于连作土壤,这与江淮地区苜蓿后茬轮作玉米、高粱后厚壁菌门在连作土壤中最高的研究结论相似[2],但与黑胡椒(Pipernigrum)随连作年限的增加,其厚壁菌相对丰度呈逐年降低的结论不一致[31],其原因可能与作物种类有关,苜蓿连作可能有利于厚壁菌的积累及生长。
Alpha多样性可分析样品内菌种类别的丰富度和菌种数目的均匀度,Alpha多样性越高,细菌种类越丰富,群落越稳定[32]。本研究结果表明,苜蓿后茬轮作不同作物后Shannon指数无显著性变化,说明样地土壤细菌群落均匀度较高,可能是因为样地具有相同的田间管理模式,因此细菌群落具有较好的均匀性。本研究Chao1指数和ACE指数,处理T1,T2均高于CK,处理T3,T4均低于CK,说明轮茬油菜、小麦会使细菌丰富度和多样性上升,土壤活力增强,肥力更高,营养元素的循环代谢更为高效,而轮茬葵花和玉米不及苜蓿连作,可能是由于不同轮茬作物根系分泌物的不同影响了土壤细菌群落多样性[33]。
土壤酶活性大小可以反映土壤养分转化的能力,脲酶和碱性磷酸酶参与氮磷循环和有机质分解,过氧化氢酶能减轻生物体内的毒素,蔗糖酶能够催化蔗糖水解为葡萄糖和果糖,进而提高土壤生物学活性,增加土壤营养[34]。本研究表明,苜蓿后茬轮作后土壤脲酶、碱性磷酸酶、蔗糖酶活性均显著高于苜蓿连作(CK),与李争艳等[2]的研究结果相似。其研究表明,轮茬玉米与高粱后土壤过氧化氢酶及脲酶活性均显著高于苜蓿连种土壤。张鹏鹏等[35]在棉花、小麦玉米轮作试验中也发现轮作能够提高土壤过氧化氢酶、蔗糖酶及相关酶活性。综上,轮茬处理提高了土壤酶活性,增强了土壤的氧化还原能力,提高了养分的吸收及循环水平。
4 结论
本研究采用高通量测序技术研究了荒漠灌区5年生苜蓿地轮作不同作物后土壤细菌的群落特征。结果显示,轮茬不同作物后,土壤脲酶、碱性磷酸酶、过氧化氢酶及蔗糖酶活性均显著高于苜蓿连作;微生物量碳含量、微生物量氮含量和土壤呼吸速率分别以轮茬小麦和油菜、玉米、葵花和玉米最大;土壤细菌优势菌门为变形菌门、酸杆菌门、芽单胞菌门、放线菌门,轮茬后变形菌门、放线菌门、芽单胞菌门相对丰度呈降低趋势,酸杆菌门相对丰度呈增加趋势;轮茬小麦和油菜后土壤细菌群落丰富度指数Chao1和ACE均显著高于苜蓿连作。
