PEG干旱胁迫对3种葱属植物种子萌发期渗透调节物质及酶活性的影响
2021-01-09秦立刚李韦瑶崔国文
秦立刚,李 雪,李韦瑶,胡 尧,李 俊,崔国文*
(1. 东北农业大学动物科学技术学院, 黑龙江 哈尔滨, 150030; 2. 中国农业科学院草原研究所, 内蒙古 呼和浩特, 010000)
葱属植物(AlliumL.)大多数是多年生草本植物,鳞茎呈圆柱形状,部分呈圆球形状,且具有膜质、革质或纤维质鳞茎皮[1]。葱属植物分布广泛,具有药用、食用和观赏价值[2]。野韭(AlliumramosumL.)、山韭(AlliumsenescensL.)和蒙古韭(AlliummongolicumRegel)在我国东北地区属于常见的野生葱属植物,且都具有很高的药用和食用价值[3-5]。由于全球气候变化的影响,干旱变成了全世界面临的一个重要问题,也是我国农林产业发展的主要限制因素之一[6]。黑龙江省地处我国东北部,由于地形和气候影响多为干旱半干旱土地,每年受干旱面积多达37.5万hm2。因此,从野生乡土植物资源角度,筛选适生的抗旱草本植物[7],对于该地区的植被快速恢复有主要意义。野生葱属植物在东北地区适应性较强,在沙石地也可大量繁殖,具有较强的抗旱性,可在干旱半干旱地区的植被恢复中进行广泛应用。
干旱胁迫下植物细胞膜透性被破坏[8],相对电导率升高,并且随着细胞脱水,丙二醛(Malondialdehyde,MDA)和脯氨酸不断积累,可溶性糖和可溶性蛋白含量也会持续升高[9]。但植物可以产生自我保护的抗氧化酶,这些酶可以维持活性氧的动态平衡[10]。在抗氧化酶系统中,植物在响应干旱胁迫时以超氧化物歧化酶(Superoxide,SOD)、过氧化氢酶(Catalase,CAT)为主[11],SOD,CAT和过氧化物酶(Peroxidase,POD)是主要作用酶[12]。多酚氧化酶(Polyphenol oxidase,PPO)能通过分子氧氧化酚和多酚形成醌类化合物,构成植物的保护性屏障[13]。种子萌发和幼苗生长是植物生长的关键阶段,萌发期间种子耐旱性更能反映植物的抗旱性[14]。因此,本试验通过测定3种葱属植物种子萌发期渗透调节物质及酶活性指标的变化,通过主成份分析及隶属函数分析对其进行耐旱性评价,为东北地区旱区葱属植物的人工驯化提供理论依据。
1 材料与方法
1.1 试验材料
山韭种子来自东北农业大学草业科学实验室,野韭和蒙古韭种子来自中国农业科学院草原研究所。
1.2 试验设计
试验采用培养皿滤纸萌发法,分别选取山韭、野韭和蒙古韭3种植物的饱满均一的种子,放置于0.5%的高锰酸钾消毒液中消毒5 min,然后将种子在去离子水下冲洗干净,晾干备用。试验采用不同浓度的PEG-6000溶液模拟干旱条件,按照浓度0(CK)、5%(质量分数,下同)、10%,15%,20%,30%设置6个处理[15],其中CK为去离子水处理,各处理均重复3次。在培养皿底层铺2层滤纸,分别加入10 mL不同浓度梯度的PEG-6000溶液或去离子水,再将消毒过的种子均匀放置于培养皿中,每个培养皿中放置100粒。将培养皿置于26℃下培养。每72 h更换一次滤纸和溶液,确保种子所处的溶液浓度不变。培养2~3 d开始观察种子的萌发情况。当胚根开始突破种皮的时候作为种子萌发初期,萌发3 d后进行取样测定。
1.3 测定指标与方法
相对电导率使用DDS-11A型数字显示电导仪测定。渗透调节物质及酶活性均采用索莱宝生物科技有限公司试剂盒进行测定,其中:MDA含量测定使用试剂盒BC0020,脯氨酸含量使用试剂BC0290,可溶性糖含量使用试剂盒BC0030,可溶性蛋白含量测定使用试剂盒BC1720,SOD活性测定使用试剂盒BC0170,CAT活性测定使用试剂盒BC0200,POD活性测定使用试剂盒BC0090。
1.4 统计方法
利用Excel 2010 进行数据整理和作图。采用SPSS软件对各指标进行0.05水平下多重比较和方差分析,并进行主成分分析。采用隶属函数法对3种葱属植物进行耐旱性综合比较[16],各指标权重由主成分分析得到。不同葱属植物各测定指标的隶属函数计算公式如下:X(ab)=[Xab-Xbmin]/[Xbmax-Xbmin]。式中:X(ab)为a材料b指标在某一处理下的隶属值。Xbmax为该处理下b指标测定的最大值,Xbmin为该处理下b指标测定的最小值,如果a为负指标则用如下公式:X(ab)=1-[Xab-Xbmin]/[Xbmax-Xbmin]。然后把b指标在各个处理下的隶属值相加,求其平均值即可得出a材料b指标的隶属函数值。
2 结果与分析
2.1 干旱胁迫对种子萌发期渗透调节物质的影响
2.1.1干旱胁迫下相对电导率的变化 随着PEG浓度的升高,3种植物种子的相对电导率呈持续上升的趋势(图1)。山韭在PEG浓度30%,蒙古韭和野韭在PEG浓度20%和30%时,相对电导率显著高于其他PEG浓度(P<0.05),并均在PEG浓度30%时达到最大值,表明随着干旱胁迫的加强,3种植物均受到了较大的影响。在PEG浓度20%时,野韭相对电导率显著高于其他两种植物(P<0.05),山韭相对电导率最低,表明在此干旱胁迫程度下,山韭受到的影响最小。PEG浓度在30%时,野韭相对电导值仍最高(P<0.05),山韭和蒙古韭相对电导率无显著差异,但山韭较低于蒙古韭。

图1 PEG-6000胁迫下相对电导率的变化Fig.1 Changes of relative conductivity under different PEG-6000 concentrations注:不同大写字母表示同种不同PEG浓度下差异显著(P<0.05),不同小写字母表示同一PEG浓度不同种间差异显著(P<0.05),下同Note:Different uppercase letters indicated significant differences in different PEG concentrations of the same species at the 0.05 level,while different lowercase letters indicated significant differences in different species of the same PEG concentration at the 0.05 level. The same as below
2.1.2干旱胁迫下MDA含量的变化 随着PEG浓度的升高,3种葱属植物种子的MDA含量呈先上升后下降的趋势(图2)。PEG浓度在15%和20%时,3种植物的MDA含量显著高于其他PEG浓度(P<0.05),并均在PEG浓度20%时达到最大值,分别为:野韭67.36 nmol·g-1FW,山韭51.14 nmol·g-1FW,蒙古韭62.27 nmol·g-1FW,表明随着干旱胁迫的加强,3种植物均受到了较大的影响。野韭MDA含量在PEG浓度20%,15%,5%,30%和对照处理下,均存在显著差异,表明野韭在受到干旱胁迫时,MDA含量的变化表现的更加敏感。山韭的MDA含量在各处理下均低于其他两种植物,说明其受到的干旱胁迫影响较小。
2.1.3干旱胁迫下脯氨酸含量的变化 随着PEG浓度的升高,3种植物的脯氨酸含量均呈现先上升后下降的趋势(图3)。但3者变化程度不同,蒙古韭在PEG浓度10%时达到最大值,为134.71 μg·g-1,野韭和山韭在PEG浓度15%时达到最大值,分别为97.15 μg·g-1和158.34 μg·g-1。3种植物相比,在PEG浓度10%时,野韭脯氨酸含量显著低于另外两者(P<0.05),山韭脯氨酸含量最高。在PEG浓度为15%,20%和30%时,山韭脯氨酸含量显著高于其他两种植物(P<0.05),说明在这3种处理下山韭的脯氨酸含量的变化表现得更加敏感。

图2 PEG-6000胁迫下MDA含量的变化Fig.2 Changes of MDA content under different PEG-6000 concentrations
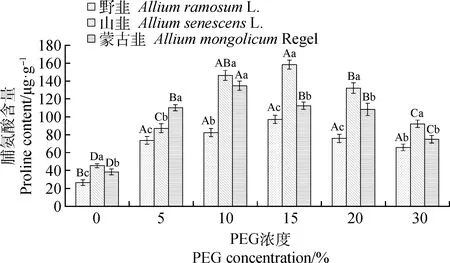
图3 PEG-6000胁迫下脯氨酸的含量变化Fig.3 Changes of proline content under different PEG-6000 concentrations
2.1.4干旱胁迫下可溶性糖含量的变化 随着PEG浓度的升高,3种植物种子的可溶性糖含量均呈现先上升后下降的趋势(图4)。PEG浓度在15%时,3种植物可溶性糖含量均达到最高,分别为:野韭5.13 mg·g-1,山韭6.82 mg·g-1,蒙古韭5.91 mg·g-1。3种植物相比,在PEG浓度15%时,山韭可溶性糖含量显著高于其他两种植物(P<0.05),野韭可溶性糖含量最低(P<0.05),说明在PEG-6000(浓度为15%)胁迫下,山韭具有更好的渗透调节能力。
2.1.5干旱胁迫下可溶性蛋白含量的变化 随着PEG浓度的升高,3种植物种子可溶性蛋白含量均呈现先上升后下降的趋势(图5)。PEG浓度在15%时,3种植物可溶性蛋白含量显著高于其他PEG浓度(P<0.05),并均此时达到最大值,分别为:野韭0.34 mg·g-1,山韭0.37 mg·g-1,蒙古韭0.36 mg·g-1,表明随着干旱胁迫的加强,3种植物均受到了较大的影响。在PEG浓度为15%时,山韭可溶性蛋白含量显著高于其他两种植物(P<0.05),野韭可溶性蛋白含量最低(P<0.05)。

图4 PEG-6000胁迫下可溶性糖的含量变化Fig.4 Changes of soluble sugar content under different PEG-6000 concentrations

图5 PEG-6000胁迫下可溶性蛋白的含量变化Fig.5 Changes of soluble protein content under different PEG-6000 concentrations
2.2 干旱胁迫对种子萌发期酶活性的影响
2.2.1干旱胁迫对SOD活性的影响 随着PEG浓度的升高,3种植物种子的SOD活性均呈现先上升后下降的趋势(图6)。PEG浓度在10%时,3种植物SOD活性显著高于其他PEG浓度(P<0.05),并均此时达到最大值,分别为:野韭106.26 U·g-1FW·min-1,山韭128.56 U·g-1FW·min-1,蒙古韭113.15 U·g-1FW·min-1。3种植物相比,在PEG浓度10%时,山韭SOD活性最高,显著高于野韭(P<0.05)。
2.2.2干旱胁迫对CAT活性的影响 随着PEG浓度的升高,3种植物种子的CAT活性均呈现先上升后下降的趋势(图7)。在PEG浓度10%和15%时,山韭和蒙古韭CAT活性显著高于其他PEG浓度(P<0.05),并且野韭和山韭的CAT活性在PEG浓度为15%时达到最大值,分别为:野韭58.34 U·g-1FW·min-1,山韭61.25 U·g-1FW·min-1。蒙古韭的CAT活性在PEG浓度为10%时达到最大值113.15 U·g-1FW·min-1。在PEG浓度10%时,山韭和蒙古韭CAT活性显著高于野韭(P<0.05)。在PEG浓度为15%时,野韭和山韭CAT浓度显著高于蒙古韭(P<0.05)。

图6 不同PEG-6000浓度下SOD的活性变化Fig.6 Changes of SOD activity under different PEG-6000 concentrations
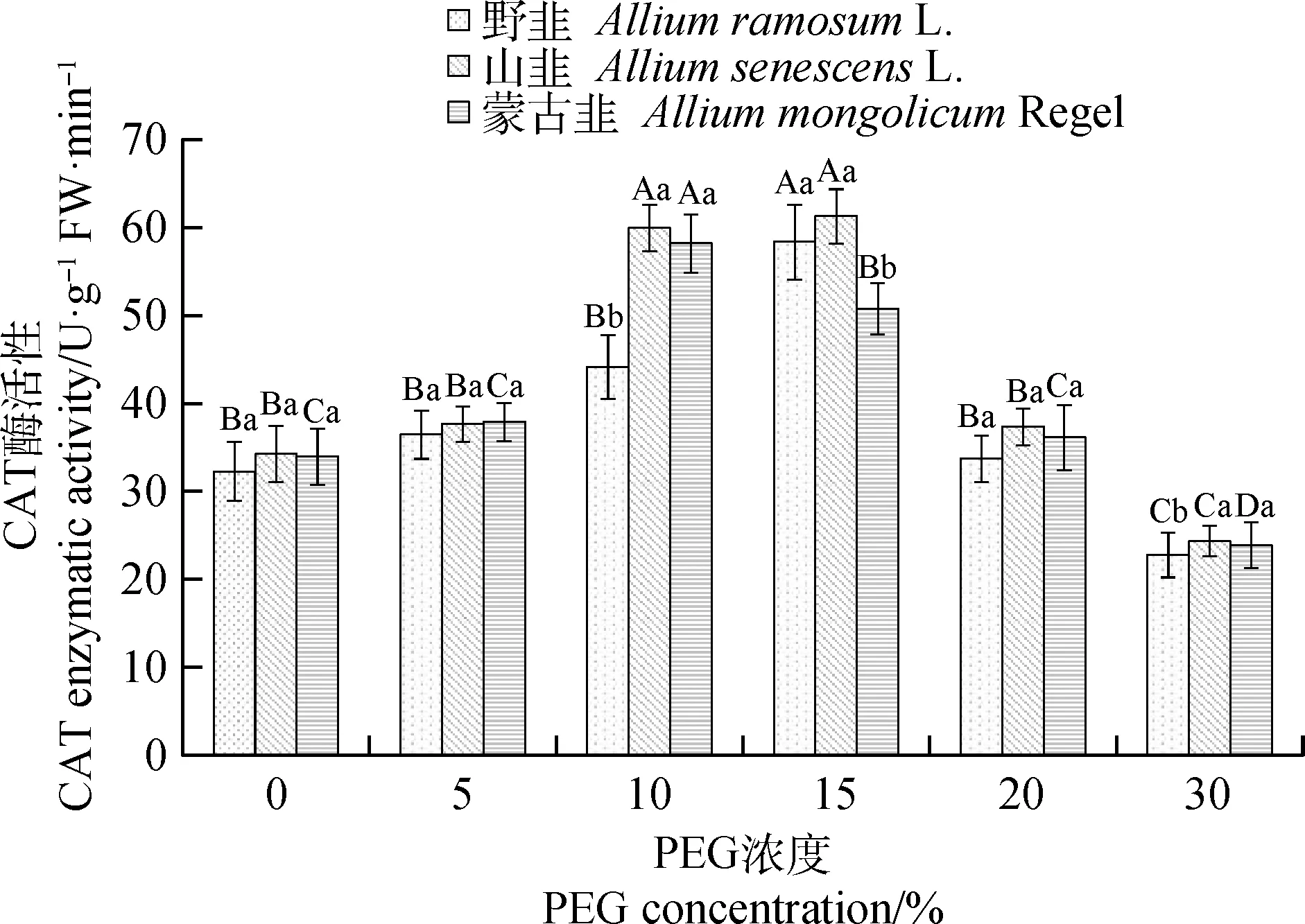
图7 不同PEG-6000浓度下CAT的活性变化Fig.7 Changes of CAT activity at different PEG-6000 concentrations
2.2.3干旱胁迫对POD活性的影响 随着PEG浓度的升高,3种植物种子的POD活性均呈现先上升后下降的趋势(图8)。PEG浓度在10%和15%时,3种植物POD活性显著高于其他PEG浓度(P<0.05),并且山韭和蒙古韭的POD活性在PEG浓度为10%时达到最大值,分别为:山韭182.27 U·g-1FW·min-1,蒙古韭134.72 U·g-1FW·min-1。野韭的POD活性在PEG浓度为15%时达到最大值为:121.32 U·g-1FW·min-1。3种植物相比,山韭在各PEG浓度处理下POD活性均显著高于其他两种植物(P<0.05)。表明山韭在受到干旱胁迫时,POD活性较野韭和蒙古韭显著提高,表现出较强的抗氧化能力。

图8 不同PEG-6000浓度下POD的活性变化Fig.8 Changes of POD activity at different PEG-6000 concentrations
2.2.4干旱胁迫对PPO活性的影响 随着PEG浓度的升高,3种植物种子的PPO活性均呈现先上升后下降的趋势(图9)。PEG浓度在10%和15%时,3种植物PPO活性显著高于其他PEG浓度(P<0.05),并均在PEG浓度10%时达到最大值,分别为:野韭3.11 U·g-1FW·min-1,山韭3.43 U·g-1FW·min-1,蒙古韭3.48 U·g-1FW·min-1。在PEG浓度15%时,山韭的PPO活性显著高于其他两种植物(P<0.05)。
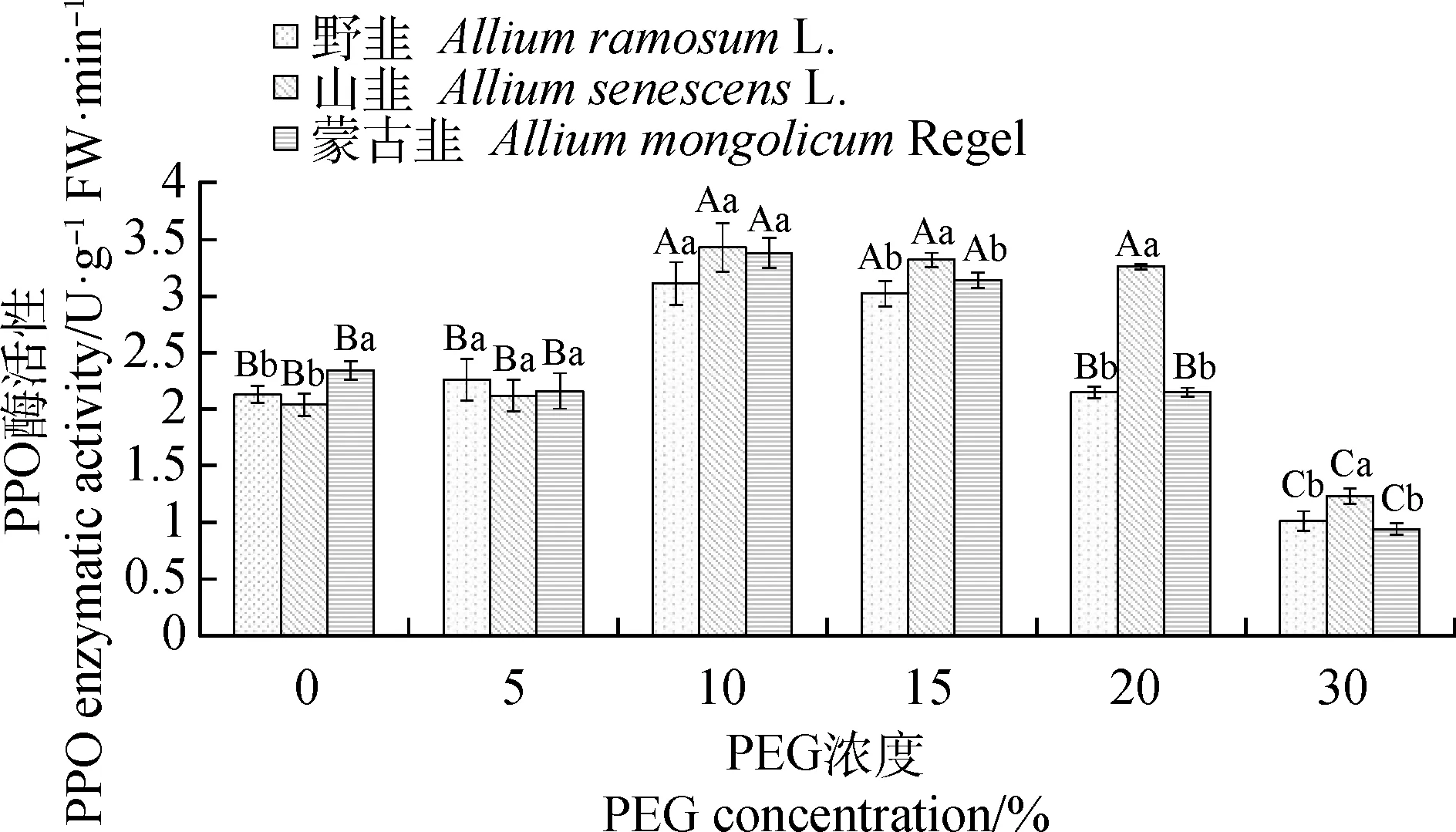
图9 不同PEG-6000浓度下PPO活性变化Fig.9 Changes of PPO activity under different PEG-6000 concentrations
2.3 渗透调节物质与酶活性应对干旱胁迫的主成分分析
如表1所示,对3种葱属植物种子在PEG模拟干旱胁迫下渗透调节物质和酶活性进行主成分分析。第一主成分和第二主成分累积贡献率达到80.38%,可以综合反映抗旱性指标的绝大部分信息,因此利用主成分分析方法来研究3种葱属植物抗旱能力是可行的。
如图10(A)所示,各指标之间的距离反映了各指标的相关性,其中,SOD,POD,CAT和PPO活性之间距离较近,显示出较强的相关性,可溶性蛋白、脯氨酸和可溶性糖含量之间相关性也较强,并与MDA具有一定的相关性。由图10(B)可以看出,在0和5%PEG浓度下3种葱属植物均聚集在第三象限,10%PEG浓度下的3种葱属植物聚集在第四象限,15%PEG浓度下3种葱属植物和20%浓度下的山韭均聚集在第一象限,20%浓度下野韭、蒙古韭和30%浓度下3种葱属植物均已聚集在第二象限。
综合来看,未干旱和干旱初期(5%PEG浓度),葱属植物渗透调节物质和酶活性均未发生显著变化。在10%PEG浓度的干旱胁迫下,3种葱属植物主要通过调节4种酶活性来应对干旱胁迫。随着PEG浓度的增加,3种植物在15%PEG浓度下和山韭在20%PEG浓度下,可溶性糖、可溶性蛋白、MDA和脯氨酸在应对干旱胁迫中起主要作用。20%PEG浓度下野韭和蒙古韭、30%PEG浓度下3种葱属植物相对电导率均有显著的变化。同时,野韭与蒙古韭整体较为接近,其抗旱能力相似,山韭抗旱能力相比其他两种葱属植物更强。
2.4 抗旱能力综合评价
葱属植物抗旱能力并非由单一指标决定,因此,本研究通过对5种渗透调节物质和4种酶活性指标进行隶属函数分析,对3种葱属植物种子萌发期抗旱能力进行综合评价。其中,各个指标的权重通过以上主成分分析得出。分析7个测定指标的隶属函数值,进而得到3种葱属植物种子萌发期耐旱隶属函数加权平均值(表2)。其中以山韭得分最高,蒙古韭得分最低。抗旱能力强弱顺序依次为:山韭>野韭>蒙古韭,与主成分分析结果基本一致。
3 讨论
干旱胁迫发生时,植物细胞膜易受到损伤,导致质膜透性增大,细胞内含物外渗[17-18],外渗液电导率增大,且质膜损伤程度越大,电导率越高[19]。干旱胁迫下3种葱属植物种子萌发期相对电导率与对照相比均有所升高。当PEG浓度为30%时,野韭种子相对电导率最高,而相同条件下,山韭与蒙古韭种子电导率的增加幅度显著低于野韭种子。由此可以看出,在干旱胁迫发生时野韭种子的膜损伤程度最大,而山韭和蒙古韭种子的膜损伤程度相比之下更轻一些。

表1 方差分解主成分Table 1 Variance decomposition of principal components
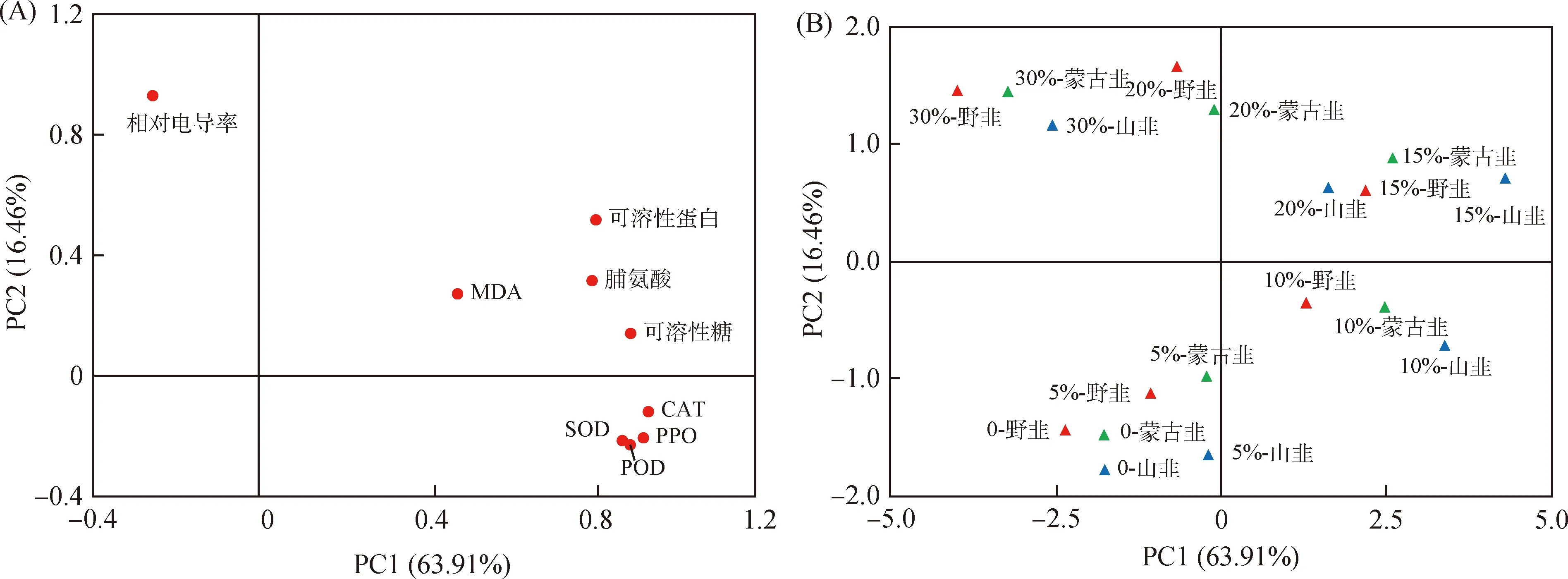
图10 主成分分析图Fig.10 Principal component analysis diagram注:图(A)为因子载荷图,图(B)为样品得分图Note:Figure (A) is the factor load diagram,and figure (B) is the sample score chart

表2 3种葱属植物种子萌发期指标隶属值及抗旱性综合评价Table 2 Seed germination index and drought resistance comprehensive evaluation of 3 Allium L. species
MDA是植物细胞膜脂过氧化物之一,能与细胞内多种成分发生反应引起细胞的严重损伤,MDA的含量可以侧面反映非生物胁迫下植物细胞的受损情况[20-21]。3种葱属植物种子的MDA含量均在PEG浓度为20%时达到最高,而在30%的PEG浓度下3种植物种子的MDA含量又有所下降,这可能是由于植物中的保护酶作用使MDA含量下降,从而保护植物应对干旱胁迫。这与李州等关于不同叶型白三叶(TrifoliumrepensL.)抗氧化保护及渗透调节生理对干旱胁迫的响应的研究结果相一致[22]。脯氨酸是调节植物水分胁迫条件下细胞水势的物质之一,脯氨酸对干旱胁迫十分敏感。干旱胁迫条件下脯氨酸含量往往和对照相比会有所上升,脯氨酸含量的积累反映了植物对不良环境的忍耐能力[23]。3种植物中在多数处理下山韭的脯氨酸含量都要高于同处理下的另外两种植物种子。另外随着PEG浓度的升高,3种植物种子的脯氨酸含量均呈现先上升后下降的趋势,这一趋势与MDA的变化趋势相似。根据渗透调节物质的主成分分析可以看出脯氨酸和MDA具有一定程度的相关性。可溶性糖和可溶性蛋白是植物在干旱胁迫下重要的渗透调节物质,当渗透胁迫来临时会显著增加,以增强植物的抗旱能力[24]。当PEG浓度为15%时,3种植物的可溶性糖和可溶性蛋白含量最高,此时山韭种子的可溶性糖和可溶性蛋白含量要显著高于另外两种植物,结合山韭种子在干旱胁迫下的脯氨酸和MDA含量可以得出:山韭种子在干旱胁迫下渗透调节物质的含量最高,可以有效地调节细胞渗透势,对于植物细胞的保护能力最强。
在植物的抗氧化防御系统中,SOD催化超氧化物的歧化反应,减轻活性氧对植物细胞的毒害作用。研究表明,提高SOD酶活性对植物抗旱具有关键性作用,较高的SOD活性能够有效的清除过量积累的活性氧,从而提高植物的抗旱性[25]。植物在逆境胁迫下,会产生有毒有害物质,CAT作为细胞中的抗氧化防御酶,在植物受外界环境胁迫时可以清除由于植物体内的过氧化氢,是植物重要的保护酶之一[26]。POD主要通过催化分解H2O2或其他过氧化物来氧化底物,从而清除体内活性氧和参与体内代谢活动,是生物体内重要的抗氧化酶之一[27]。POD的表达和活性与植物的抗逆性密切相关。有研究表明,植物通过增强抗氧化酶活性及增强活性氧代谢来增强植物耐受性[28]。在本试验中,随着PEG浓度的增加3种植物的SOD,CAT和POD活性的变化趋势较为一致,都呈现先上升后下降的趋势。这一结果与陈爱萍[29]等关于伊犁绢蒿(Seriphidiumtransiliense)幼苗在干旱胁迫下通过积累渗透调节物质和提高抗氧化酶活性维持生长的试验结果相一致。通过本文中酶活性应对干旱胁迫的主成分分析可以看出3种保护酶距离较近,具有较强的相关性。
PPO与植物抗逆作用有极大的关系。衰老、逆境胁迫以及病原菌、病虫侵害都能引起PPO活性的变化[30]。PPO在发挥作用的过程中会与酚类物质作用,酚类物质的积累被认为与植物抵御非生物胁迫有关,在冷胁迫、水分胁迫和热胁迫条件下均观察到该现象,这些酚类物质与抑制PPO活性、增加抗氧化酶和自由基清除剂酶活性相关[31]。在本试验中,3种葱属植物种子中PPO活性的变化趋势大致相同,只是野韭和蒙古韭种子中PPO的活性在PEG-6000浓度为20%是迅速下降,而山韭种子中的PPO活性在30%时才发生显著下降。另外PPO与SOD,POD和CAT之间距离较近,同样也显示出了较强的相关性。
4 结论
干旱胁迫下,3种葱属植物种子萌发期丙二醛含量、相对电导率、脯氨酸含量、可溶性糖含量、可溶性蛋白含量、超氧化物歧化酶、过氧化氢酶、过氧化物酶和多酚氧化酶活性和对照相比均显著上升;在干旱胁迫发生时野韭种子的膜损伤程度最大。山韭种子在干旱胁迫下渗透调节物质的含量最高。SOD,POD,CAT和PPO活性之间显示出较强的相关性,可溶性蛋白、脯氨酸和可溶性糖含量之间相关性也较强,并与MDA含量具有一定的相关性。通过隶属函数分析得出3种植物种子的抗旱性由高到低依次为:山韭>野韭>蒙古韭。
