电解锰渣盐酸浸取钙的动力学研究
2021-01-08杨晓红薛希仕张露露
杨晓红,薛希仕,张露露,常 军
(1.铜仁学院材料与化学工程学院,贵州铜仁554300;2.贵州开盛钾业科技有限公司)
电解锰渣是碳酸锰矿石经过硫酸酸浸、中和、压滤后产生的酸性废渣。中国是世界上主要的电解锰生产国,据统计,2018年中国电解金属锰产能达226万t,实际产量为140 万t,约占世界电解金属锰总产量的97%[1],随着锰矿石的不断开采,矿石品位降低,导致每生产1 t 电解锰产品将产生10~12 t 的酸性浸渣渣量[2-4],以此推断,中国每年产生的电解锰渣量将超过1 000 万t[5-6],目前中国电解锰渣的堆存量已超过1.5 亿t[7-9],并且随着锰矿石品味的不断降低,锰渣堆积的状况将会不断恶化。大量锰渣的堆积,不仅占用大量的土地资源,而且对周围环境造成极大的污染,严重制约了行业的可持续发展[10-11]。因此,如何有效地利用电解锰渣成为行业内亟待解决的问题。
电解锰渣主要由 CaSO4、SiO2、Al2O3、Fe2O3、MnO、SO3等物质组成,其物相构成以二水石膏和二氧化硅为主。其中CaO 主要存在形式为二水石膏,且质量分数高达20%以上[12-13]。锰渣中高钙组分给锰渣的资源化利用过程中的产品纯化带来困扰,目前国内外学者对电解锰渣的研究主要集中于锰渣中锰的提取、 氨氮的无害化处理及利用锰渣中组分的物理性能制备建筑材料等研究,对锰渣中钙的处理则研究较少[14-15]。本研究拟采用盐酸溶液对电解锰渣进行溶解,并对溶解过程中锰渣中钙的溶出动力学进行研究分析,探讨钙的溶出规律并建立动力学模型,为今后电解锰渣的资源化利用奠定理论基础。
1 实验部分
1.1 实验原料
实验中所用电解锰渣为铜仁某电解锰企业产生的酸性废渣,通过45 ℃低温烘干,研磨至粒径<150 μm,混合均匀后所得样品。锰渣中主要化学成分分析如表1 所示,锰渣中CaO 的含量较高,其质量分数为12.61%。
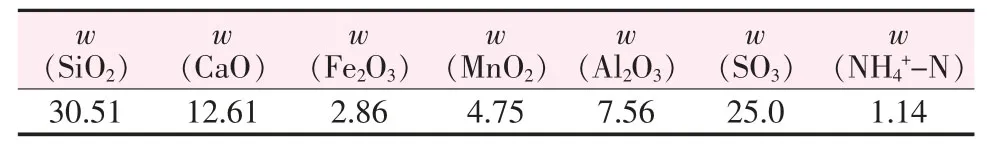
表1 电解锰渣的化学组成 %
锰渣的X 射线衍射(XRD)分析结果见图1。由图1 可知,锰渣中主要物相组成为低温石英(SiO2)、二水石膏(CaSO4·2H2O)、钙长石(CaAl2Si2O8)、六水硫酸锰铵[(NH4)2Mn(SO4)2·6H2O]等,在酸性体系中,二水石膏、钙长石中的钙溶出。

图1 电解锰渣的XRD 谱图
1.2 实验方法与仪器
取一定已知浓度的盐酸溶液于三口烧瓶中,置于DF-101S 型集热式恒温加热磁力搅拌器中加热至设定温度,加入一定质量经45 ℃于101-2AB 型电热鼓风干燥箱烘干研磨后的锰渣粉,于一定温度条件下反应,反应一定时间后采用真空抽滤,滤液采用ICP-9000 型电感耦合等离子体发射光谱仪测定溶液中钙离子浓度,以此计算锰渣中钙的浸取率。锰渣中钙的浸出动力学实验中,在反应过程到达指定时间时需迅速移取定量反应液进行过滤,用电感耦合等离子体发射光谱仪测定溶液中钙离子的浓度,并计算反应时间点钙的浸取率。锰渣中钙的浸取率以ηCa(%)表示,按下式计算:

对不同温度下钙离子的浸取率与时间的关系作图,从而确定该酸浸反应的反应模型,并且进一步计算浸取反应的反应活化能。
2 实验结果与讨论
2.1 反应时间对钙浸取率的影响
固定盐酸浓度为1.5 mol/L、反应温度为65 ℃、反应的液固比(盐酸与锰渣的体积质量比)为6 mL/g,改变反应时间,考察其对钙浸取率的影响,结果见图2。由图2 可知,随着反应时间的增加,钙的浸取率不断增加,反应时间达到60 min 后,继续增加反应时间钙的浸取率增加缓慢,故确定最佳反应时间为60 min。

图2 反应时间对钙浸取率的影响
2.2 反应的液固比对钙浸取率的影响

图3 反应液固比对钙浸取率的影响
固定反应时间为60 min、盐酸浓度为1.5 mol/L、反应温度为65 ℃,改变反应的液固比,考察液固比分别在8、7、6、5、4 mL/g 条件下钙的浸取率的变化情况,结果如图3 所示。由图3 可知,随着反应体系的液固比不断增加,浸取反应中钙的浸取率不断增加,在液固比为6 mL/g 后锰渣中钙的浸取率趋于平稳。浸取反应过程中,随着体系液固比增加,反应体系中H+与锰渣颗粒间的有效碰撞次数增加,钙的浸取率增加明显,当体系液固比达到一定程度后,受反应体系中产物外扩散影响,生成的产物不能及时脱离颗粒表面,H+与颗粒表面反应的难度增加,从而反应过程中钙的浸取率增加缓慢。体系中反应产物的初始浓度降低,有利于反应的正向进行,并且液固比提高利于提高产物的流动性,降低产物扩散的难度,促使反应更易进行。
2.3 反应温度对钙浸取率的影响
固定反应液固比为6 mL/g、反应时间为60 min、盐酸浓度为1.5 mol/L,改变浸出反应温度,考察钙浸取率的变化情况,结果如图4 所示。由图4 可知,随着温度的升高,钙的浸取率升高,即升高温度,反应体系中活化分子的比例增加,提高了反应的速率,使钙的浸取率升高,温度达到80 ℃后浸取率变化趋于平缓,进一步升高温度不仅增加能耗,同时高温增加盐酸挥发,造成反应物损失,故确定反应温度为80 ℃。
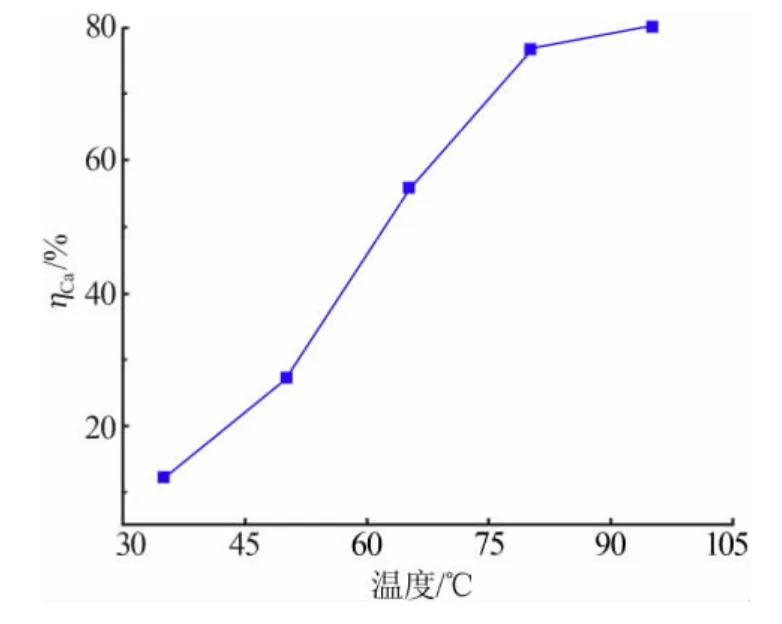
图4 反应温度对钙浸取率的影响
2.4 盐酸浓度对钙浸取率的影响
固定反应的液固比为6 mL/g、反应时间为60 min、反应温度为80 ℃,考察盐酸浓度对锰渣中钙的浸取率的影响,结果如图5 所示。由图5 可知,随着盐酸浓度的升高,锰渣中钙离子的浸取率呈上升趋势,盐酸浓度达到3 mol/L 后钙浸取率的变化趋于平缓。盐酸浓度增加,单位体积内活化分子的数量增加,提高了反应的速率与传质推动力,加速了钙的浸出反应进行,当盐酸浓度进一步升高时反应受产物的外扩散控制,故钙的浸取率增加缓慢,因此确定反应过程中盐酸浓度为3 mol/L。

图5 盐酸浓度对钙浸取率的影响
2.5 优化实验
由以上单因素实验所确定的最佳浸取条件:即反应时间为60 min、 液固比为6 mL/g、 反应温度为80 ℃、盐酸浓度为3 mol/L,在此条件下进行优化实验,钙的浸取率达94.3%。
2.6 钙的浸出动力学模型
由电解锰渣的XRD 谱图可知,锰渣中钙主要以二水石膏、钙长石等物相形式存在,在酸性环境下,二水石膏优先被盐酸溶解,其主要化学反应为:

鉴于锰渣成分的复杂性,动力学模型建立时需要简化其反应模型,假设粉碎后的锰渣为致密球形,盐酸为液体,两者反应属于固液多相反应,且无固相产物生成,其浸出过程可用“核缩减模型”进行描述[16]。浸出过程主要由5 个步骤构成:1)浸取液由液相主体向固体颗粒表面扩散(外扩散);2)浸取液通过固体膜扩散(内扩散);3)浸取液与钙发生化学反应;4)反应产物在产物层内部扩散(内扩散);5)浸出产物从产物层向外部扩散(外扩散)。
动力学反应控制过程主要有内扩散控制、 化学反应控制、外扩散控制[17-18],当反应为化学反应控制时,其酸浸反应动力学方程可表示为:

当通过在固相产物层(或未反应的物体层)中的扩散来支配反应时,其酸浸反应的方程式可以表示如下:

在反应过程中出现的反应物颗粒的连续缩小是由粒子收缩产生的,这是收缩芯模型的特征之一,并且形成无固相产物层并将产物溶解在溶液中也是其特征[19]。当用液体滞流膜扩散控制时,酸浸出反应的动力学方程表示为:

式中:x 为钙的浸取率,%;t 为反应时间,min;k 为反应速率常数。
2.6.1 温度对酸浸速率常数的影响
在盐酸浓度为1.5 mol/L、液固比为6 mL/g 条件下,分别考察温度在50、65、80 ℃条件下,钙的浸取率f(x)和反应时间t 的关系,用尝试法将不同温度下所得实验数据代入不同控制步骤的动力学模型,其中f(x)=1-(1-x)1/3与时间t 呈现良好的线性关系,结果如图6 所示,不同反应温度下,该浸出过程属于化学反应控制步骤。

图6 不同温度下1-(1-x)1/3 与浸出时间t 的关系曲线
在酸浸实验过程中,温度对化学反应速率常数的影响可用阿仑尼乌斯(Arrhenius)方程表示。
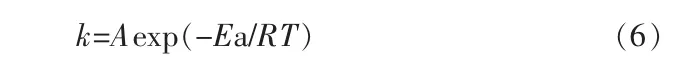
两边同时取对数得:

式中:A 为频率因子,s-1;T 为浸出反应的热力学温度,K;R 为理想气体常数,8.314 510 J/(mol·K);Ea为反应的表观活化能,J/mol。
以ln k 为纵坐标,1/T 为横坐标作图,结果如图7 所示。由图7 可知,求得反应的表观活化能Ea为43.96 kJ/mol,所得直线方程为:y=-5.287 4x+10.081,线性相关系数为0.989 6。根据前人研究及文献报道,化学反应中活化能大于40 kJ/mol 时符合化学反应控制,并且当活化能小于62.78 kJ/mol 时化学反应速率较快[20-21],因此进一步验证锰渣中盐酸浸出钙的反应属化学反应控制。

图7 浸出体系反应的Arrhenius 图
2.6.2 盐酸浓度对酸浸速率常数的影响
在温度为65 ℃、液固比为6 mL/g 条件下,分别考察盐酸浓度在0.5、1.5、2.5 mol/L 条件下钙的浸取率f(x)和反应时间t 的关系,结果见图8。锰渣中的二水石膏(CaSO4·2H2O)与盐酸反应产物为氯化钙、硫酸,均可溶于体系中且没有固相物质产生,剩余钙长石、石英等物相与盐酸不反应,反应在二水石膏表面进行,盐酸在二水石膏界面反应很快,产物通过扩散离开反应物界面。由图8 可知,不同浓度条件下f(x)=1-(1-x)1/3与时间t 呈现良好的线性关系,说明锰渣与盐酸反应受化学反应控制。

图8 不同浓度下1-(1-x)1/3 与浸出时间t 的关系曲线
依据碰撞理论,在锰渣酸浸过程中,锰渣中钙的浸取率不仅与反应体系的温度有关,同时与反应过程中盐酸溶液的浓度有关,即反应过程中频率因子是浓度的函数:

式中A0、n 均为常数。两边取对数,即为

式中ln A 与ln C 成线性关系,对ln A—ln C 作图,得到方程:ln A=0.872 5ln C-3.398 4,R2=0.976 6,如图9 所示,其中截距为ln A0,斜率为n,即反应级数为0.872 5。
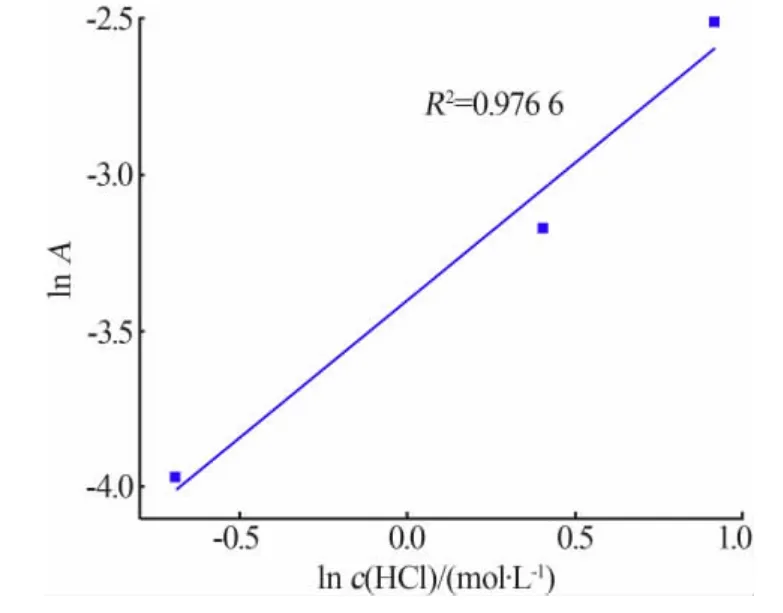
图9 ln A 与盐酸浓度c(HCl)的关系图
结合式(6)、式(8),可以得到速率常数与反应温度、反应浓度之间的关系为:
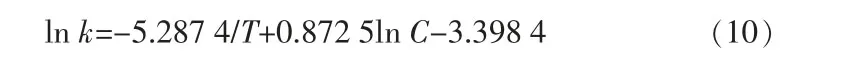
由式(10)可知,增加反应温度T 可以提高反应速率,增加盐酸浓度也可以提高反应速率,这与单因素、动力学实验数据变化趋势相吻合。温度升高可以使体系中的活性分子增多,增加单位时间内锰渣中二水硫酸钙与氢离子的碰撞,加快反应物和产物的扩散速度,从而增大化学反应速率。盐酸浓度增加使反应体系中氢离子浓度梯度增加,锰渣表面与酸的接触概率变大,反应速度加快,增大了扩散的推动力,从而使锰渣中钙的浸取速率提高。
3 结论
1)通过锰渣酸浸条件实验,得到优化工艺条件为:盐酸浓度为3 mol/L、液固比为6 mL/g、反应温度为80 ℃、反应时间为60 min,优化条件下钙的浸取率为94.3%。
2)盐酸浸取锰渣动力学过程是一个复杂的液固多相反应过程,属于收缩核模型反应,符合1-(1-x)1/3=k1t,主要受化学反应控制,反应的表观活化能Ea 为43.96 kJ/mol,反应级数为0.872 5,反应速率常数k与反应温度T、盐酸浓度C 之间的关系为:ln k=-5.287 4/T+0.872 5ln C-3.398 4,即升高温度或增大盐酸浓度,均有利于浸取反应速率常数升高,从而提高反应速率。
3)通过对盐酸作用于锰渣中钙元素的浸取工艺动力学的研究,旨在寻找一种绿色、环保的开发利用工艺,为高效、低耗、合理地利用锰渣等固体废弃矿渣提供了一条新的途径,也为现阶段化学法分解锰渣并资源化利用其中钙、硅、锰等有价元素的工业应用提供了理论依据。
