283.15 K 下三元KCl-NH4Cl-H2O 和KH2PO4-NH4H2PO4-H2O 体系固-液相平衡测定与关联
2021-01-08杨家敏李天祥
杨家敏,朱 静,胡 雪,吴 强,李天祥
(贵州大学化学与化工学院,贵州贵阳550025)
固-液相平衡是结晶、精馏、萃取等分离过程研究的理论基础,相图用于描述相平衡系统物质组成、性质、温度和压力等之间的关系,且能够直观判断体系共饱和点数量、 结晶区的数目和结晶区范围等。固-液相平衡数据理论值的模型有很多,在20 世纪70年代,研究者将电解质理论和非电解质溶液模型有机结合,开发了许多有效的电解质溶液模型,如半经验Pitzer 模型[1-2]、Wilson 模型[3]、NRTL 模型[4]、UNIQUAC 模型[5]等。其中,Pitzer 模型成功应用于高温、高压、高浓度溶液、熔盐系统和混合溶剂系统,是目前应用最广的电解质溶液理论模型。
国内外许多研究人员对一些形成固溶体体系的相平衡实验和理论研究已见报道,F.Fatima、X.Yu、B.Zhao 等[6-8]给 出 了 三 元KCl-NH4Cl-H2O 体系在298.15、333.15、353.15 K 的溶解度数据,三元KCl-NH4Cl-H2O 体系平衡固相形成两种固溶体(K,NH4)Cl 和(NH4,K)Cl。赵长伟、樊彩梅等[9-10]不仅给出了该体系相平衡数据还运用Pitzer 模型拟合了KCl-NH4Cl-H2O 体系在308.15 K 和298.15 K 下的溶解度。
为研究一种采用冷却结晶技术生产的含尿素、磷酸二氢钾和氯化钾的水溶肥,必须先研究该体系的相平衡,因为相平衡是结晶、精馏、萃取等分离技术 的 理 论 基 础。研 究(NH2)2CO-NH4H2PO4-KCl-H2O 体系的共结晶,需研究该体系不同温度的相平衡,就必须先研究其三元子系和四元子系在不同温度下的固-液相平衡,这些数据虽有零散的报道,但极其不完整;为此,本课题组拟对该体系相平衡进行系统研究,前期已报道了3 个三元子体系NH4H2PO4-(NH2)2CO-H2O、KH2PO4-KCl-H2O、NH4H2PO4-NH4Cl-H2O 在283.15 K 条件下的相平衡数据[11-12]。本文研究了283.15 K 下两个含固溶体三元体系KCl-NH4Cl-H2O 和KH2PO4-NH4H2PO4-H2O的相平衡数据,两体系为(NH2)2CO-NH4H2PO4-KCl-H2O 的三元子体系,为进一步研究该体系的相平衡提供了理论基础和经验。
1 实验
1.1 仪器和化学品
仪器:DC-4006 型低温恒温槽;HX-T(100Z)型电子天平;S10-3 型磁力搅拌器;UV-6100S 型紫外可见分光光度计;GZX-9146MBE 型电热鼓风干燥箱;D8 Advance 型X 射线粉末衍射仪;0~50 ℃(刻度0.1 ℃)温度计;250 mL 夹套容器(自制)。
用于测定固-液相平衡的装置与三元体系NH4H2PO4-(NH2)2CO-H2O[11]的装置一致。
原料:氯化钾、氯化铵、磷酸二氢钾、磷酸二氢铵,均为分析纯。
1.2 实验方法
为验证实验装置和方法的可行性,分别测定了4种纯物质在283.15 K 下水中的溶解度数据,结果见表1,实验数据与文献值[13]高度一致,表明此装置和方法是可靠的。
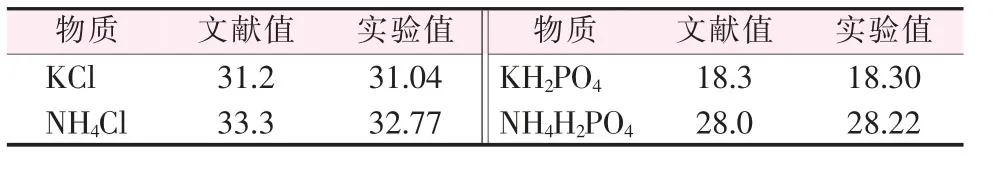
表1 283.15 K 下单组分在100 g 水中的溶解度 g
根据两元体系共饱和结晶点组成含量,再将适量的另一种盐和去离子水一起加入到夹套容器中,并将夹套容器放置在磁力搅拌器上进行搅拌。低温恒温槽温度控制在(283.15±0.1)K,搅拌器转速设定为500 r/min。在第一次实验中,为确定体系组成达到相平衡所需要的搅拌时间,在4 h 后进行第一次取样,使用装有聚醚砜(PES,孔径为0.45 μm)、预热好的5 mL 注射器吸取上清液,并做好称样记录,之后每隔1 h 取样,测定各组分浓度。结果表明,搅拌8 h,液相各组分含量不变,系统达到相平衡。固相采用Schreinemaker 方法和X 射线衍射仪进行测定。
1.3 分析方法
2 结果与讨论

表2 在283.15 K 下三元体系KCl-NH4Cl-H2O的固-液相平衡数据
在283.15 K 下三元体系KCl-NH4Cl-H2O 的固-液相平衡数据和溶解度数据相图分别见表2 和图1。从表2 和图1 看出,KCl-NH4Cl-H2O 体系是复合体系,形成具有可变组成的(NH4,K)Cl 和(K,NH4)Cl两种固溶体。从图1 可见,相图中有一个共饱和点b,由表2 可知,平衡固相为(NH4,K)Cl 和(K,NH4)Cl的混合物,平衡溶液的组成为:w(NH4Cl)=18.63%,w(KCl)=11.54%。点a 表示单盐KCl 在水中283.15 K的溶解度,点d 表示单盐NH4Cl 在水中283.15 K 的溶解度。有两条单变量曲线ab 和bd,对应的6 个区域:单盐NH4Cl、KCl 结晶区;Aabd 区域为不饱和区;Ceba 区域是以氯化钾为主要成分的 (K,NH4)Cl 固溶体结晶区,且NH4Cl 达到最大浓度值见图1 中的e点;Bcbd 区 域 是 氯 化 铵 为 主 要 成 分 的(NH4,K)Cl固溶体结晶区,且KCl 达到最大浓度值见图1 中c点;cbe 区域是两种固溶体的共饱和结晶区。

图1 283.15K 下KCl-NH4Cl-H2O 溶解度数据相图
表3 是KH2PO4-NH4H2PO4-H2O 体系的溶解度实验数据,根据实验数据绘制了图2,由表3 和图2可知,体系平衡固相也产生两种不同的固溶体。从图2 上看,体系存在1 个共饱和点b1,由表3 可知,平 衡 固 相 为(NH4,K)H2PO4和(K,NH4)H2PO4的 混合物,平衡溶液的组成为:w(NH4H2PO4) =15.32%,w(KH2PO4)=10.43%。A1、B1和C1分别表示液态水、固态KH2PO4和NH4H2PO4。点a1表示单盐NH4H2PO4在水中283.15 K 的溶解度,点d1表示单盐KH2PO4在水中283.15 K 的溶解度,有两条单变量曲线a1b1、b1d1,对应的6 个区域为:NH4H2PO4和KH2PO4结晶区;A1a1b1d1区域为不饱和区;B1c1b1d1区域为磷酸二氢钾为主要成分的(K,NH4)H2PO4固溶体结晶区,NH4H2PO4达到最大浓度值见图2 中的c1点;C1a1b1e1区域是以磷酸二氢铵为主要成分的(NH4,K)H2PO4固溶体结晶区,KH2PO4达到最大浓度值见图2 中e1点;c1b1e1是两种固溶体的共饱和结晶区。
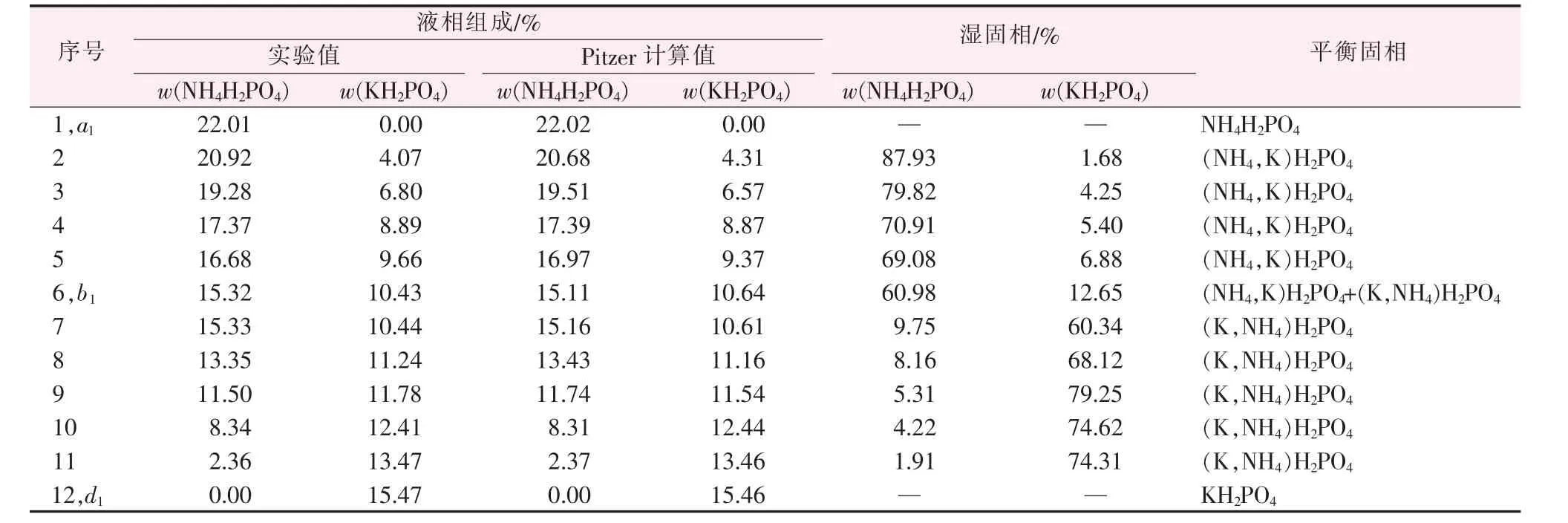
表3 在283.15 K 下三元体系KH2PO4-NH4H2PO4-H2O 的固-液相平衡数据

图2 283.15 K 下KH2PO4-NH4H2PO4-H2O 溶解度数据相图
图3~图6 是运用X 射线粉末衍射仪测定的部分互溶固溶体的XRD 谱图。以KCl-NH4Cl-H2O 系统为例进行说明,在图3 中,与KCl 标准卡相比,样品的峰向左移动。这是因为钾离子半径为0.138 nm,铵离子半径为0.143 nm。当铵离子替代钾离子形成固溶体时,晶面间距增大,峰向低角度移动。在图4 中,与NH4Cl 标准卡相比,样品的峰向右移动。由于钾离子半径为0.138 nm,铵离子半径为0.143 nm,因此钾离子代替铵离子形成固溶体,导致晶面间距减小,因此峰向高角度偏移。另KH2PO4-NH4H2PO4-H2O 体系同理。
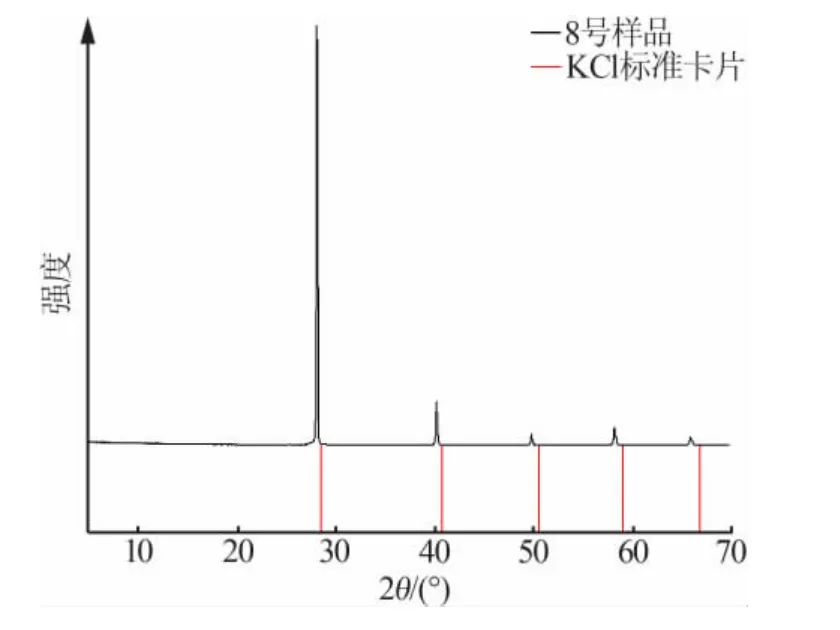
图3 表2 中8 号样品实验所得的固溶体(K,NH4)Cl 的XRD 谱图
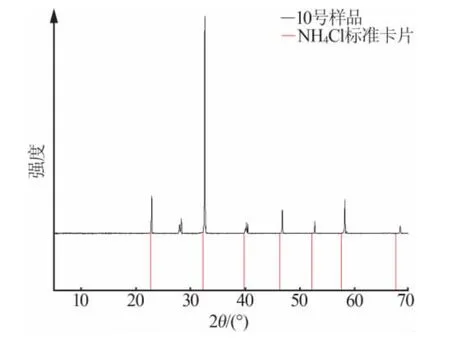
图4 表2 中10 号样品实验所得的固溶体(NH4,K)Cl 的XRD 谱图
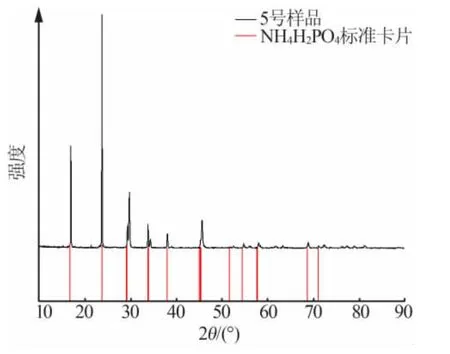
图5 表3 中5 号样品实验所得的固溶体(NH4,K)H2PO4 的XRD 谱图

图6 表3 中8 号样品实验所得的固溶体(K,NH4)H2PO4 的XRD 谱图
3 理论关联
Pitzer 模型在实际工业中得到了广泛的应用,如高温、高压、高浓度溶液系统等。Pitzer 给出的模型适用于单组分电解质体系,1980—1984年C.E.Harvie 等[17]重新整理了Pitzer 模型,得出了混合电解质的H-W 公式:

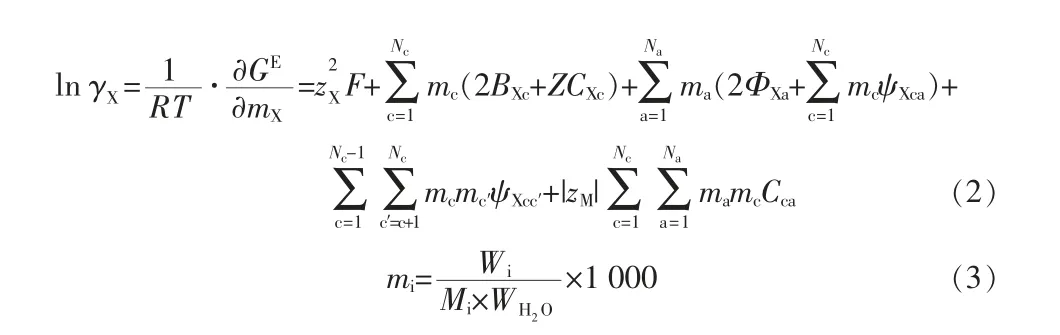
阴离子的质量摩尔浓度(mi)是两个阳离子的质量摩尔浓度之和:

式中,M、c′、c 代表阳离子;X、a′、a 代表阴离子;Nc、Na是阳离子、阴离子的种类数。Zi=1,a1=2.0 kg1/2/mol1/2,a2=0,b=1.2 kg1/2/mol1/2,AΦ=0.382 69 kg1/2/mol1/2。B、B′、ΦФij、Φij、Φ′ij为第二维里参数,是离子强度I 的函数。
β(0)、β(1)、CΦ为Pitzer 模型的特征参数,在1973年Pitzer 通过溶解度数据测出了298.15 K 下240 种电解质的参数[18-20]。Pitzer 模型特征参数与溶解度、电解质性质和温度均有关联,Pitzer 运用Pitzer 模型拟合出1-1、2-1、3-1 和2-2 型电解质的温度系数[21]。结合298.15 K 单盐特征参数值和温度系数得出本文中所涉及的特征参数,见表4。
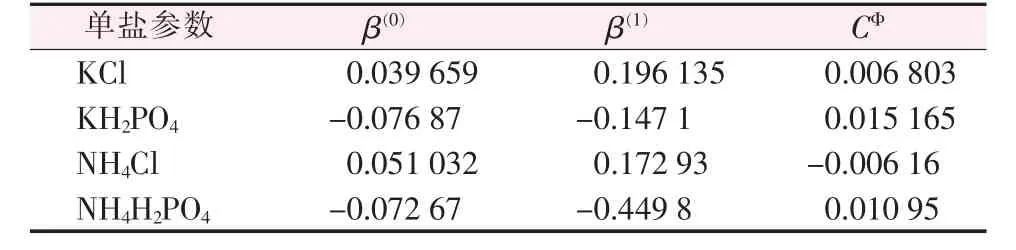
表4 在283.15 K 时单组分电解质的Pitzer 特征参数值
两个体系结晶固相中产生不完全互溶固溶体,组成随浓度变化有所改变,其溶解平衡常数不是一个定值。组分盐的溶解平衡常数等于组成该盐的离子、分子的活度积,且离子或分子的活度等于它们的组分物质的量与它们的活度系数的乘积。以KCl-NH4Cl-H2O 体系说明,单变量线ab 上活度积与组分的关系可表示为:
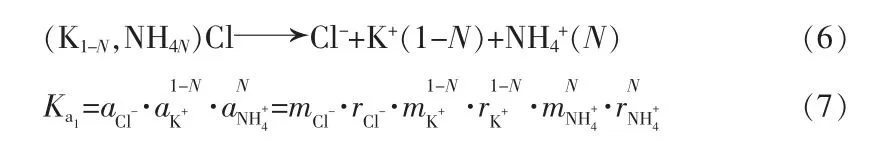
Ka1为固溶体(K,NH4) Cl 的活度积;N 为固溶体中NH4Cl 的摩尔分数;ai为离子的活度;ri为活度系数。
db 线上,假设达到平衡时固溶体的分子式为[NH4Q,K(1-Q)]Cl,其活度积可以表示为:
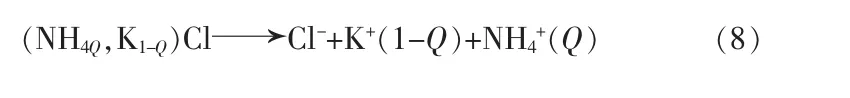

Ka2为(NH4,K)Cl 固溶体的活度积;Q 为其固溶体中NH4Cl 的摩尔分数。
结合(7)、(9)和Pitzer 模型,得出Ka1=f(N)、Ka2=f(Q)方程。同理KH2PO4-NH4H2PO4-H2O 体系的两种固溶体的活度积为Kb1、Kb2,固溶体中NH4H2PO4的摩尔分数为P、S。
回归方程如下:
(1)KCl-NH4Cl-H2O 体系:
①(K,NH4)Cl 固溶体

相关系数:R=0.929 1
②(NH4,K)Cl 固溶体
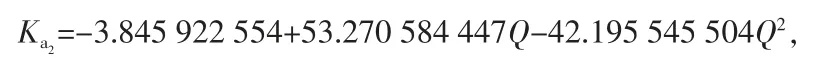
相关系数:R=0.939 2
(2)KH2PO4-NH4H2PO4-H2O 体系:
①(NH4,K)H2PO4固溶体
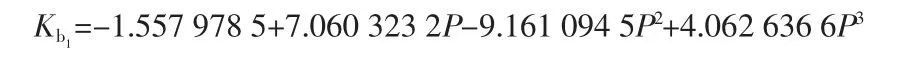
相关系数:R=0.997 9
②(K,NH4)H2PO4固溶体Kb2=0.238 211 3-0.586 761 9S+1.460 272 9S2-0.779 920 8S3
相关系数:R=0.999 9
由于有3 个组分,在组分含量及温度一定时,独立方程只有两个,所以必须先固定某一组分的含量,然后通过Pitzer 模型及回归方程求出另外两组分含量。本文中给出实验中NH4+的质量摩尔浓度值,结合(1)~(5)方程和相应的回归方程,采用非线性方程拟合和粒子群优化算法,求出未知离子的质量摩尔浓度,并求出相应活度积,列于表5、表6,对应组分质量分数数据列于表2、表3。
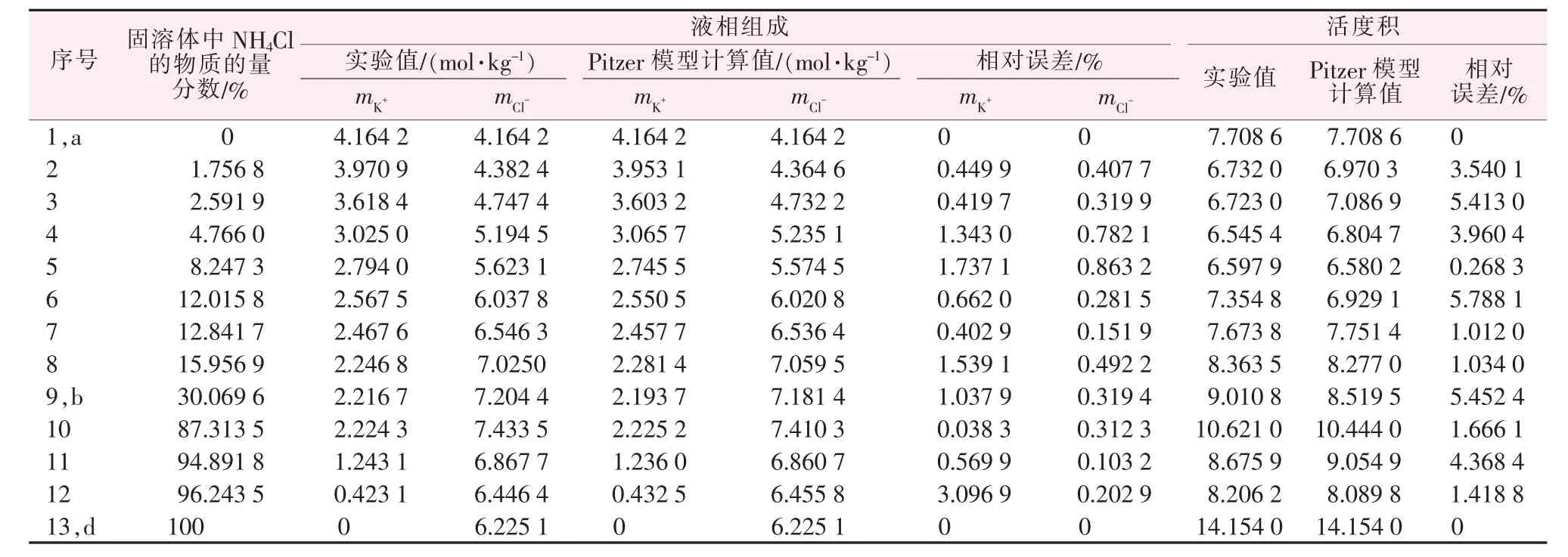
表5 在283.15 K 下三元体系KCl-NH4Cl-H2O 的固-液相平衡实验数据和Pitzer 模型计算值
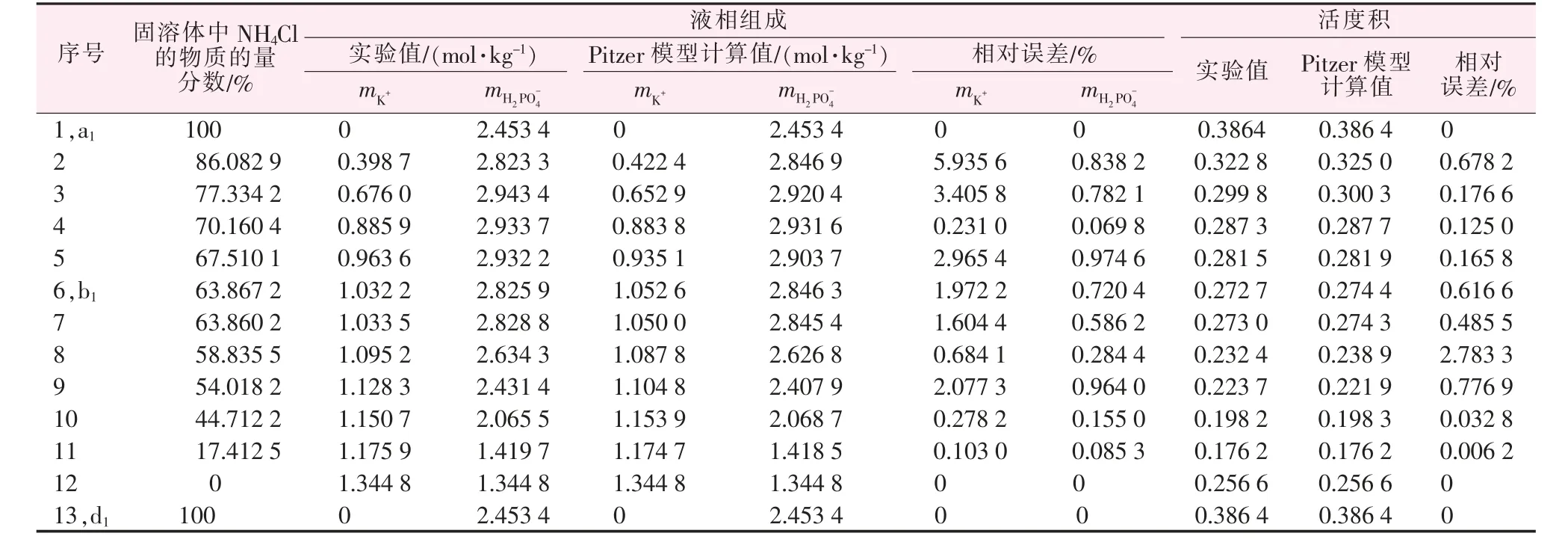
表6 在283.15 K 下三元体系KH2PO4-NH4H2PO4-H2O 的固-液相平衡实验数据和Pitzer 模型计算值
两体系共饱和点平衡固相为两种固溶体的混合物,在此点中两种固溶体处于饱和状态。例如三元KCl-NH4Cl-H2O 体系,共饱和点b 的值同时满足Ka1、Ka2两个方程,带入对应的N、Q 值,Ka1、Ka2为两个常数,再结合(1)~(4)方程可解出未知离子的质量摩尔浓度。
二元子体系共饱和点平衡固相为单物质,溶解平衡常数(K)为定值,溶解度数据理论值运用单组分电解质的Pitzer 模型计算。当溶液中KCl 达到饱和时,KKCl、ri、mi三者的关系为:
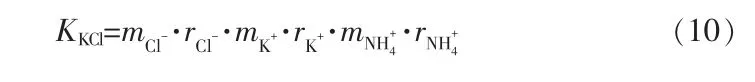
4 结论
运用等温溶解平衡法测定了在283.15 K 下两个三元体系KCl-NH4Cl-H2O 和KH2PO4-NH4H2PO4-H2O 的溶解度数据,两个体系都属于复杂体系,平衡固相都生成了两种部分互溶固溶体。运用Pitzer 模型模拟相平衡溶解度数据,KCl-NH4Cl-H2O 体系中mK+最大相对误差为3.096 9%,最小相对误差为0.038 3%,平均相对误差为1.027 0%;mCl-最大相对误差为0.863 2%,最小相对误差为0.103 2%,平均相对误差为0.385 1%。KH2PO4-NH4H2PO4-H2O 体系中,mK+最大相对误差为5.935 6%,最小相对误差为0.103 0%,平均相对误差为1.925 7%;mH2PO-4最大相对误差为0.974 6%,最小相对误差为0.069 8%,平均相对误差为0.546 0%,计算值与理论值基本符合。
