基于网络药理学的复方新天泰1 号防治阿尔茨海默病作用机制
2021-01-08梁少瑜曾永长姜倩倩吴俊洪吴正治
梁少瑜 曾永长 *姜倩倩吴俊洪吴正治
(1.深圳市老年医学研究所,广东 深圳 518020;2.深圳大学第一附属医院,广东 深圳 518035)
新天泰1 号是基于老年性痴呆 (阿尔茨海默病,Alzheimer disease,AD) “肝郁化火,痰浊阻窍” 中医病理假说,结合多年临床研究研制的医院制剂,全方以人参补五脏、安精神、开心益智,黄连泻火燥湿、镇肝去热毒、安心定躁,为君;辅以吴茱萸开郁化滞、温中下气、开腠理,姜黄理气散结、消瘀下气,肉苁蓉益髓延年、冰片通诸窍、散郁火,全方共凑清肝解郁、除痰化瘀、开窍益智之功。
现代药理研究显示新天泰1 号通过拮抗β-AP 神经毒性、抗氧化、抗凋亡、保护神经元、增强胆碱能活性和海马突触可塑性等多种途径干预阿尔茨海默病的病理进程[1-3],但其活性成分如何协同整合影响疾病网络尚未清楚。
网络药理学融合多向药理学和系统生物学的思想,将药物作用网络与生物学网络相整合,分析药物在网络中与节点或网络模块的关系,特别适宜于反映及阐释中药的多成分-多靶点作用关系。本研究拟采用网络药理学方法,系统性分析新天泰1 号抗阿尔茨海默病“成分-靶点-通路”的复杂关系,为医院制剂新天泰1 号的临床应用及进一步开发提供参考。
1 方法
1.1 新天泰1 号化学成分数据库的构建 以新天泰1 号中6 味中药(人参、黄连、吴茱萸、姜黄、肉苁蓉、冰片)为关键词,检索Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)、Traditional Chinese Medicine Database @ Taiwan (http://tcm.cmu.edu.tw/zh-tw/index.php)、Traditional Chinese Medicine Integrated Database (TCMID,http://www.megabionet.org/tcmid/)及 Chemistry Database (http://www.organchem.csdb.cn/),结合文献检索获取新天泰1 号化学成分信息。遵循药物活性成分筛选条件,优选口服生物利用度(Oral Bioavailability,OB) OB≥30%,类药性(Drug-Like,DL) DL≥0.18 的成分为候选活性成分。通过文献挖掘补充不在筛选范围内,但已有研究证明具有抗老年痴呆作用的活性成分。另根据糖苷酶水解规则,含糖基的化合物在体内可能被去掉糖基,为增加活性分子的准确度避免因糖基水解代谢而造成活性化合物的流失,去糖苷配基的化合物也将纳入新天泰1 号的分子数据库并命名为“化合物_ qt”。
1.2 新天泰1 号候选靶点及抗阿尔茨海默病潜在靶点预测 通过TCMSP、Search Tool for Interactions of Chemicals(STITCH,http://stitch3.embl.de/,筛选标准:score >0.8)、Comparative Toxicogenomics Database (CTD,http://ctdbase.org/) 检索,相互补充,获得候选活性成分对应的靶点。将候选靶蛋白输入Uniprot Database (https://www.uniprot.org/),筛选属于人源性靶点,通过TTD、TCMSP、CTD 获得与疾病 “Alzheimer disease、Cognitivedisorders、Dementia、Neurodegenerative disease、Nerve Degeneration”相对应的靶蛋白为抗阿尔茨海默病潜在靶点。
1.3 新天泰1 号抗阿尔茨海默病潜在活性靶点的器官定位分析 将新天泰1 号抗阿尔茨海默病潜在靶点输入BioGPS(http://biogps.org/) 进行组织器官特异性归属分析,以Z-score >5 为筛选条件,认为该靶点mRNA 高表达于此组织器官。
1.4 新天泰1 号候选成分-候选靶点(candidate Compoundscandidate Targets,cC-cT)、抗阿尔茨海默病潜在成分-潜在靶点(potential Compounds-potential Targets,pC-pT)、潜在靶点-器官定位(potential Targets-Organ Location,pT-O) 网络的构建 采用Cytoscape 3.7.1 软件,分别将新天泰1 号的候选活性成分和候选靶点,抗阿尔茨海默病潜在活性成分和潜在靶点,抗阿尔茨海默病潜在靶点和器官归属导入软件构建其cC-cT 网络,pC-pT 网络和pT-O 网络,通过插件Network analyzer 分析网络特征,通过网络拓扑参数(节点的度) 分析,系统阐释成分与靶点的相互关系。
1.5 抗阿尔茨海默病潜在靶点的KEGG 通路富集 采用DAVID 6.8 在线数据库(https://david.ncifcrf.gov/) 对潜在靶点进行KEGG 通路富集分析。以P<0.001 为条件进行筛选,获得新天泰1 号抗阿尔茨海默病的可能药理作用通路。
2 结果
2.1 新天泰1 号候选成分的筛选 通过相关数据库及文献检索,合并药味间共有成分,建立了包括549 个化合物在内的新天泰1 号化学成分数据库,其中人参199 个、黄连48 个、吴茱萸177 个、姜黄53 个、肉苁蓉79 个、冰片35个。满足“OB≥30% 且DL≥0.18” 条件的候选化学成分共81 个:黄连11 个,吴茱萸27 个,人参27 个,姜黄2个,肉苁蓉3 个,冰片3 个,吴茱萸/黄连2 个,人参/肉苁蓉2 个,人参/姜黄1 个,吴茱萸/黄连/肉苁蓉1 个,人参/吴茱萸/肉苁蓉1 个,结果见表1。
值得注意的是,人参中20 (S) -原人参三醇(OB=20.13,DL=0.78),20 (R) -原人参三醇 (OB=20.13,DL=0.78),人参皂苷Rf (OB=17.74,DL=0.24),人参皂苷Rg1 (OB=10.04,DL=0.28),人参皂苷Rb1 (OB=6.24,DL=0.04),人参皂苷Rd (OB=5.5,DL=0.09),人参皂苷Re (OB=4.27,DL=0.12);吴茱萸中柠檬苦素(OB=21.3,DL=0.57);黄连中药根碱 (OB=19.65,DL=0.59),非洲防己碱(OB=26.94,DL=0.59);姜黄中α-姜黄烯(OB=4.68,DL=0.06),去甲氧基姜黄素(OB=4.37,DL=0.33),二氢姜黄素(OB=5.91,DL=0.41),姜黄素(OB=4.37,DL=0.41),双去甲氧基姜黄素(OB=3.55,DL=0.26);肉苁蓉中松果菊苷 (OB=3.14,DL=0.38),松果菊苷_ 去糖苷配基(OB=2.94,DL=0.62),毛蕊花糖苷(OB=2.94,DL=0.62),毛蕊花糖苷去糖苷配基(OB=1.56,DL=0.68),京尼平苷酸(OB=19.59,DL=0.41),尽管它们的OB、DL 值较低,考虑到现有文献报道其抗阿尔茨海默病活性,课题组仍然保留上述20 个成分做进一步的靶点预测以确保试验的周全性和准确性。
2.2 新天泰1 号候选靶点及抗AD 潜在靶点的获得 新天泰1 号101 种候选成分中90 种成分在数据库中匹配到188个靶点,11 种候选成分 (GI058,GI038,GI066,GI068,GI071,CO021,BO003,GI001,EV096,EV051,CI064) 未匹配到相关靶点。188 个候选靶点中与疾病“Alzheimer disease、Cognitive disorders、Dementia、Neurodegenerative disease、Nerve Degeneration” 相对应的潜在靶点共68 个。
2.3 新天泰1 号cC-cT,pC-pT,pT-O 网络构建 将新天泰1 号的候选化合物和候选靶点的相互作用关系导入Cytoscape 进行网络构建,得新天泰1 号候选“cC-cT” 网络,见图1。网络中共278 个节点(包括90 个候选成分和188个候选靶点) 和1 436 条边。该网络的avg.Number of neighbors (平均相邻节点数) 为10.324,说明每个节点平均与10.324 个节点相互作用,即平均一个分子与十多个靶蛋白相互作用,同时也存在十多个不同分子共同作用于同一个蛋白的现象。充分体现了新天泰1 号多成分、多靶点的复杂网络特征。节点的 “度 (Degree) ” 的分析,Degree 越大,表示该节点与其他节点相互作用越广泛,在网络中起中心枢纽的作用。cC-cT 网络中Degree 最高的20个候选成分分为EV/CO/CI1 (槲皮素)、GI033 (山柰酚)、GI/EV/CI1 (β-谷甾醇)、CO009 ((R) -氢化小檗碱)、GI/CU3 (豆甾醇)、GI015 (原阿片碱)、EV008 (吴茱萸酰胺甲)、EV047 (异鼠李素)、CO027 (非洲防己碱)、EV007 (吴茱萸碱)、EV022 (吴茱萸酰胺乙)、CO018 (氧化小檗碱)、GI010 (山槐素)、EV053 (1-甲基-2-壬基喹啉-4 (1H) -酮)、EV016 (吴茱萸酰胺)、GI/CI1 (苏齐内酯)、CO005 (巴马亭)、CO031 (药根碱)、EV077 (吴茱萸次碱)、EV/CO2 (小檗碱)。Degree 最高的20 个候选靶点为雄激素受体(AR)、雌激素受体(ESR1)、前列腺素合成酶2 (PTGS2)、凝血酶(F2)、一氧化氮合成酶2(NOS2)、二肽基肽酶 IV (DPP4)、周期蛋 白 A2(CCNA2)、雌激素受体β 亚型(ESR2)、前列腺素合成酶1 (PTGS1)、乙酰胆碱酯酶(ACHE)、细胞分裂蛋白激酶2 (CDK2)、胰蛋白酶1 (PRSS1)、原癌基因丝氨酸/苏氨酸蛋白激酶-1 (PIM1)、有丝分裂原激活蛋白激酶(MAPK14)、糖原合成酶激酶(GSK3B)、过氧化物酶体增殖物激活受体γ (PPARG)、钠通道蛋白α5 亚单位(SCN5A)、碳酸酐酶2 (CA2)、丝氨酸/苏氨酸蛋白激酶(CHEK1)、一氧化氮合成酶3 (NOS3)。提示新天泰1 号除了与神经退行性疾病的治疗密切相关外,还可能具有抗肿瘤、抗炎、镇痛、降血糖等作用。

表1 新天泰1 号候选活性成分
图1 新天泰1 号cC-cT 网络
将新天泰1 号抗阿尔茨海默病潜在活性成分和潜在靶点的相互作用关系导入Cytoscape 进行网络构建,得新天泰1 号抗AD “pC-pT” 网络,见图2。网络中共155 个节点(包括87 个潜在成分和68 个潜在靶点) 和739 条边。该网络的avg.Number of neighbors (平均相邻节点数):9.535。其中,黄连生物碱类成分CO009 [(R) -氢化小檗碱,D=26]、CO027 (非洲防己碱,D=15)、CO018 (氧化小檗碱,D=15)、CO005 (巴马亭,D=14)、CO031 (药根碱,D=14)、EV/CO2 (小檗碱,D=13)、CO019 (小檗红碱,D=13)、CO022 (黄连碱,D=12)、CO013 (表小檗碱,D=10),吴茱萸生物碱类成分EV008 (吴茱萸酰胺甲,D=19)、EV007 (吴茱萸碱,D=18)、EV022 (吴茱萸酰胺乙,D=17)、EV016 (吴茱萸酰胺,D=15)、EV077 (吴茱萸次碱,D=14)、EV019 (羟基吴茱萸碱,D=14)、EV071 (二氢吴茱萸次碱,D=12)、EV050 (吴茱萸新碱,D=10),人参皂苷类成分GI175 (人参皂苷Rd,D=7)、GI048 (人参皂苷Rh2,D=5)、GI113 (人参皂苷Rf,D=4),姜黄素类成分CU047 (去甲氧基姜黄素,D=10)、CU046 (姜黄素,D=9)、CU045 (α-姜黄烯,D=6)、CU044 (二氢姜黄素,D=4),二苯乙烯苷类成分CI062(松果菊苷,D=9) 等为天泰1 号抗AD 的潜在活性成分。抗阿尔茨海默病潜在靶点主要包括雌激素受体(ESR1)、前列腺素合成酶2 (PTGS2)、凝血酶(F2)、一氧化氮合成酶2 (NOS2)、雌激素受体β 亚型(ESR2)、前列腺素合成酶1 (PTGS1)、乙酰胆碱酯酶(ACHE)、有丝分裂原激活蛋白激酶(MAPK14)、糖原合成酶激酶(GSK3B)、过氧化物酶体增殖激活受体(PPARG)、乙酰胆碱受体M1(CHRM1)、乙酰胆碱受体M3 (CHRM3)、γ-氨基丁酸受体-1 亚基(GABRA1)、磷脂酰肌醇-4,5-二磷酸-3 激酶催化亚基(PIK3CG)、肿瘤坏死因子(TNF) 等。

图2 新天泰1 号抗阿尔茨海默病pC-pT 网络
新天泰1 号潜在靶点的mRNA 表达微阵列分析显示,68 个潜在靶点广泛地映射到各个组织器官上,其中,27 个靶标的mRNA 在脑部高度表达,8 个靶点的mRNA 在肝脏高度表达,9 个靶点的mRNA 在大肠高度表达。新天泰1号“pT-O” 网络,见图3。
2.4 新天泰1 号抗阿尔茨海默病通路分析 新天泰1 号抗阿尔茨海默病潜在靶点的KEGG 通路富集分析,共获得101 条通路,具有显著差异的共44 条。提取P 值前20 个关键通路,如图4 所示,涉及神经营养因子信号通路(Neurotrophin signaling pathway),神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction),钙信号通路(Calcium signaling pathway),HIF-1 信号通路(HIF-1 signaling pathway),胆碱能突触(Cholinergic synapse),5-羟色胺能突触(Serotonergic synapse),TNF 信号通路(TNF signaling pathway),VEGF 信号通路 (VEGF signaling pathway),鞘脂信号通路(Sphingolipid signaling pathway),阿尔茨海默氏病(Alzheimer’s disease),TRP 通道炎症调控通路(Inflammatory mediator regulation of TRP channels),催乳素信号通路(Prolactin signaling pathway),癌症途径(Pathways in cancer),PI3K-Akt 信号通路(PI3K-Akt signaling pathway),朊病毒病(Prion diseases),细胞凋亡(Apoptosis),雌激素信号通路 (Estrogen signaling pathway),Toll 样受体信号通路(Toll-like receptor signaling pathway),2 型糖尿病(Type II diabetes mellitus),cAMP 信号通路(cAMP signaling pathway)。
3 讨论
阿尔茨海默病作为一种复杂性神经退行性疾病,其病因病机研究虽多,但目前仍不确定,存在多种假说,如胆碱能学说、Aβ 毒性学说、tau 蛋白学说、神经炎症假说、胰岛素假说等。目前FDA 批准的阿尔茨海默病临床治疗药物主要为单靶点药物,虽一定程度上改善阿尔茨海默病患者痴呆症状,但无法延缓阿尔茨海默病的病理进程,多靶点药物的研发给阿尔茨海默病治疗带来了希望。多组分药物通过多靶点-多通路的协同调控发挥增效作的用。由于中药大多数活性成分对靶点的低亲和力的特点,通过多组分同时作用增加细胞内弱键数量发挥缓冲作用来稳定复杂的疾病网络系统,这种不完全的多靶向作用具有适度阻断分子间相互作用的优点,局部作用于靶点而不完全抑制靶点承担的某些正常生理功能,从而减少药物的不良反应,增强疗效[4]。
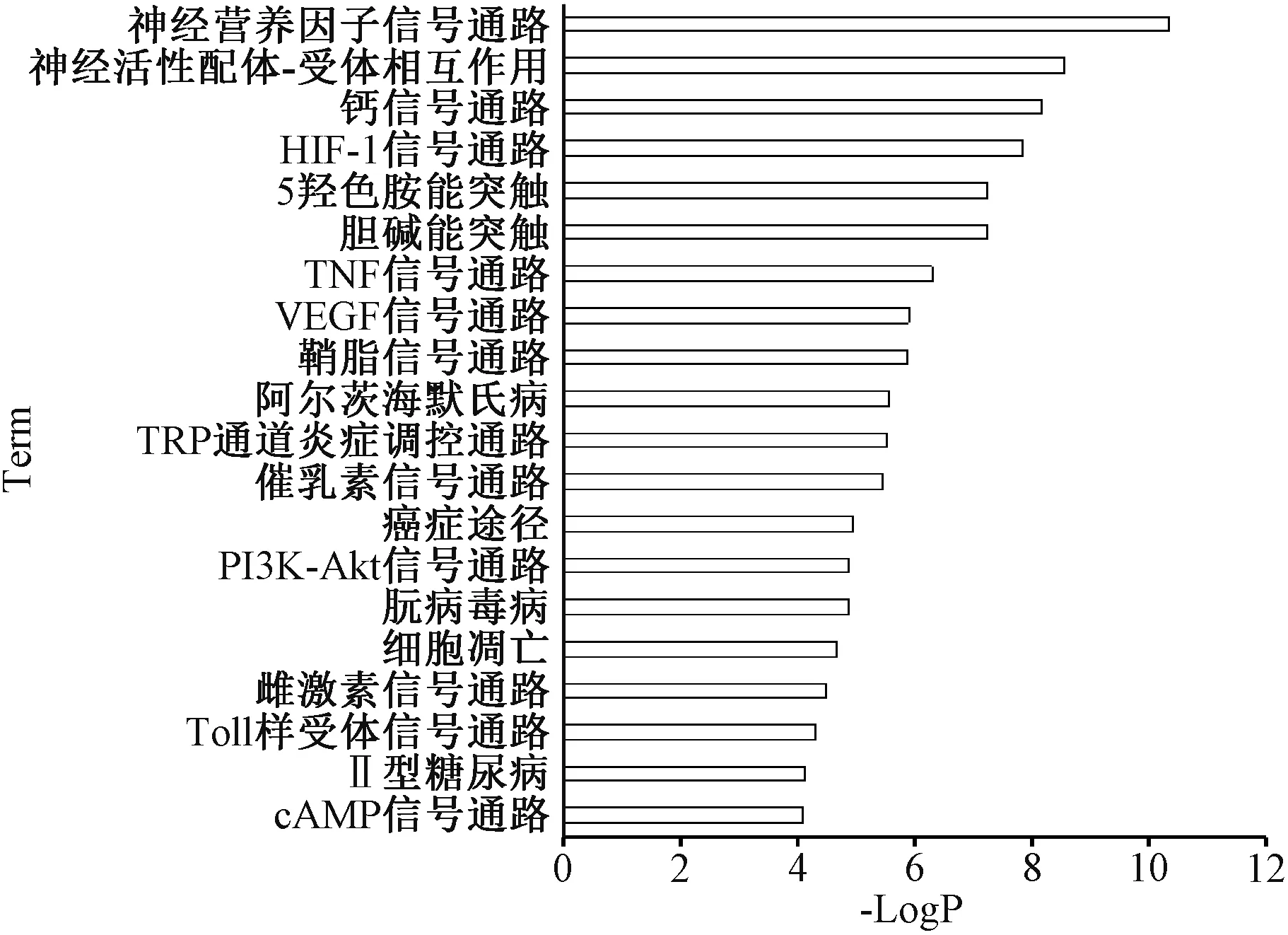
图4 新天泰1 号靶点KEGG 通路富集分析
本研究采用网络药理学的方法,整合多个化学成分数据库、蛋白数据库以及生物信息数据库,构建了中药复方新天泰1 号“成分-靶点-器官-通路” 网络,系统分析新天泰1 号多组分-多靶点-多途径调控阿尔茨海默病疾病网络的物质基础和作用机制。“pC-pT” 网络分析显示,黄连生物碱类成分如四氢小檗碱、非洲防己碱、氧化小檗碱、巴马亭、药根碱、小檗碱,吴茱萸生物碱类成分如吴茱萸碱、吴茱萸酰胺、吴茱萸次碱、羟基吴茱萸碱、二氢吴茱萸次碱、吴茱萸新碱,人参皂苷类成分如人参皂苷Rd、Rh2、Rf,姜黄素类成分如去甲氧基姜黄素、姜黄素、姜黄烯、二氢姜黄素,二苯乙烯苷类成分如松果菊苷等为新天泰1号抗阿尔茨海默病主要的潜在活性成分。本研究预测结果与现有药理研究报道相一致。已有药理研究表明,四氢小檗碱能使纹状体内ACh 含有量下降并阻滞脑内突触前和突触后DA 受体的功能[5];小檗碱、巴马亭能直接拮抗胆碱受体,抑制胆碱酯酶活性[6];小檗碱通过抑制Aβ 刺激引起的IL-6 和MCP-1 的上调,抑制COX-2 及iNOS 的表达,抑制Aβ25-35介导的小胶质细胞炎性反应[7];吴茱萸碱抑制COX-2 的表达[8];增加保护性受体PPAR -γ 的表达[9];去氢吴茱萸碱抑制GSK-3β 过度激活[10];人参皂苷Rd 抑制caspase-3、Bax 的表达,促进Bcl-2 的表达[11];Rh2 通过抑制caspase-8,caspase-9 和caspase-3 的表达,上调TNF-α 抑制细胞凋亡[12];姜黄素通过下调IL-1β、TNF-α[13]、Il-6、NO 含量[14]以及APP、caspase-3 蛋白活性,减轻神经细胞的炎症反应和损伤;松果菊苷抑制细胞内活性氧产生,恢复线粒体的高能量状态,降低caspaes-3 活性,抑制细胞凋亡[15]。可见,中药复方新天泰1 号中黄连吴茱萸生物碱、人参皂苷、姜黄素类、二苯乙烯苷类成分为其抗阿尔茨海默病主要活性成分。靶点预测方面,雌激素受体(ESR1)、前列腺素合成酶2 (PTGS2)、一氧化氮合成酶2 (NOS2)、雌激素受体β 亚型(ESR2)、前列腺素合成酶1 (PTGS1)、乙酰胆碱酯酶(ACHE)、糖原合成酶激酶(GSK3B)、过氧化物酶体增殖激活受体 (PPARG)、肿瘤坏死因子(TNF) 等为新天泰1 号抗阿尔茨海默病的主要作用靶点。雌激素受体α 和β 除在细胞核、内质网、线粒体等神经元核外区域分布,还定位在树突棘、轴突、神经末端和神经胶质细胞等区域,介导雌激素的快速信号。雌激素能增加SAPP 分泌,下调BACE 的表达减少Aβ 生成[16];上调锰超氧化物歧化酶和谷胱甘肽过氧化物酶的表达,增加还原性谷胱甘肽,减少线粒体DNA 氧化损伤,通过MAPK、G 蛋白、CREB、PKC 等调节细胞的氧化还原状态[17-18];减少海马CA1 区锥体神经元L 型钙离子通道电流,钙离子通道蛋白CAV1.2 的mRNA 水平,增加线粒体钙隔断及肌浆网钙回收;增加突触前区囊泡数目;增加胆碱能神经元CHAT 的表达和活性[19]。前列腺素(PGs) 作为多不饱和脂肪酸-花生四稀酸(AA) 的衍生物,是由环氧合酶2(也叫前列腺素合成酶,COX-2) 催化AA 产生。当COX-2在外界刺激下即刻表达,使机体产生炎症反应,促进组织细胞分泌炎症因子 (IL-1、TNF)、血管内皮生长因子(VEGF) 和基质金属蛋白酶(MMPs)[20],在调控阿尔茨海默病发病的过程中分别发挥重要的作用。糖原合成酶激酶GSK3B 作为糖原合成途径中最重要的调节激酶,其作用底物包括微管相关蛋白tau、肿瘤抑制基因p53、β-连环蛋白和环腺苷酸cAMP 等。GSK3B 作用于2 个重要的转录因子,即κ 基因结合核因子(NF-κB) 和原癌基因c-Myc 编码蛋白,NF-κB 和c-Myc 进一步调控下游多种与细胞存活和调亡相 关的基 因,如Bcl-2、Cycling D、DR4、Bim、TRALT 等,与神经元突触可塑性、神经炎症反应、神经网络稳态及神经细胞极性等密切相关[21]。已有文献报道和本研究结果相互印证了新天泰1 号通过多成分-多靶点相互作用发挥抗神经炎症、抗氧化应激、抗凋亡、调节神经递质、雌激素样等作用。
通路富集分析发现新天泰1 号的潜在靶点主要富集于神经营养因子信号通路、钙信号通路、低氧诱导因子信号通路、胆碱能突触、5-羟色胺能突触、肿瘤坏死因子信号通路上。其中,与阿尔茨海默病相关的14 个靶蛋白PIK3CG、MAPK1、BDNF、GSK3B、BAX、NTRK1、MAPK14、BCL2、NTRK2、MAPK3、MAPK8、NGFR、CALM1、NGF 富集在神经营养因子信号通路。神经营养因子/ Trk 信号通过连接多种细胞内信号级联来调节MAPK 途径,PI3K 途径和PLCr 途径,参与促进神经元细胞发育、分化、再生,对神经元的存活、突触形态可塑性及传递效能可塑性的改变至关重要[22-23]。钙信号系统高度参与阿尔茨海默病的病理过程,其稳态失调直接导致神经元结构和功能的失常和细胞坏死。在老年神经元中,ATP 的生产效率下降,Ca2+调节机制减弱,导致胞内Ca2+水平升高,钙离子依赖蛋白酶类活化,活性氧/氮自由基(ROS/RNS) 形成,线粒体功能障碍,释放细胞色素C 和活化因子-1 到细胞质中,激活半胱天冬酶(Caspase),诱导细胞凋亡[24],这与阿尔茨海默病的Ca2+失衡假说相一致。同时,炎症反应[25-26]、中枢胆碱能多巴胺神经系统紊乱[27-28]、神经元凋亡[29-30]、脑内胰岛抵抗葡萄糖代谢紊乱[31]已证实与阿尔茨海默病的发病相关。新天泰1 号通过调控多条信号通路中的蛋白,实现多成分-多靶点-多途径调控阿尔茨海默病疾病网络的目的。
中医临床对老年性痴呆多从肾论治。但正本清源,据中医学古籍载,“脑为髓海” (《内经》),而“髓之虚实,主于肝胆” (《删繁方》) 以及本病“始于肝郁” (《景岳全书》) 的中医学术源流,结合长期临床实践经验,认为“肝郁气滞、久郁化火;肝木克土,脾失健运,痰浊内生;气郁痰火上扰清窍、蒙蔽神明” 为阿尔茨海默病的重要病机,提出“清肝解郁、化痰开窍” 的治疗新法则。现代中医研究认为,肝的生理功能与神经内分泌免疫网络调节机制相关。如肝郁大鼠的下丘脑单胺类神经递质肾上腺素(E)、多巴胺(DA)、5-羟色胺(5-HT) 水平升高,去甲肾上腺素(NE) 水平降低[32];慢性束缚应激大鼠HPA 轴紊乱,免疫功能下降,中枢内源性阿片肽、脑啡肽、前强啡肽、β-内啡肽及前阿黑皮素(P0MC)、促肾腺皮质激素释放因子(CRF) 在海马、皮层、边缘系统出现异常变化,海马CA1 区神经元和突触超微结构损伤[33-34]。肝主疏泄与应激的调节位点下丘脑-垂体-肾上腺(HPA) 轴,以及海马、皮层等边缘系统密切相关。近期芝加哥大学的一项研究发现,广谱抗生素长期治疗能够促使小鼠大脑β-淀粉样斑块减少,同时激活脑内的炎症性小胶质细胞[35]。同时,肠道菌群的失衡也会引起肠道黏膜和血脑屏障的破坏,引发炎症反应损害神经元细胞。肠道微生物通过微生物-肠-脑轴调节宿主大脑功能和行为,进而给肠道微生物的组成和肠道的生理功能带来影响,影响宿主的认知行为,增加或降低宿主患阿尔茨海默病的风险[36]。以上的研究为进一步探索通过调节肝-脑-肠轴治疗阿尔兹海默病提供了依据。同时,也为本医院制剂超半数的靶点靶向脑、肝、肠提供了理论支持。
猜你喜欢
——以吴茱萸为例
