中药提取物对痤疮丙酸杆菌诱导THP-1 细胞炎症因子表达的抑制作用
2021-01-08孙培冬
魏 静 孙培冬 *
(1.江南大学化学与材料工程学院,江苏无锡 214122;2.江南大学合成与生物胶体教育部重点实验室,江苏无锡 214122)
痤疮是发生于皮脂腺内的一种慢性炎症性疾病,痤疮的产生与痤疮丙酸杆菌的活动密切相关[1]。最近的研究发现痤疮丙酸杆菌不仅可引起皮肤炎症,由它释放的外膜囊泡更可造成强烈炎症[2],因此,尽管抗菌药物抑制了细菌生长,但外膜囊泡的存在仍使炎症不能根除,目前尚未见抑制痤疮丙酸杆菌外膜囊泡释放的药物的报道。此外,由于痤疮常反复发作,长期使用抗菌药物或激素药物治疗痤疮,易出现细菌耐药、药物依赖等不良后果[3]。所以,在有效的抑菌的同时,减少外膜囊泡的释放,是缓解或治愈痤疮的正确途径。本研究以苦参、当归、金银花、荷叶、艾叶为原料,测定其乙醇提取物和水提取物的抗菌、抑制外膜囊泡释放的性能,寻找可以抑制细菌生长并同时抑制外膜囊泡释放的中药提取物组合,进而通过体外细胞实验,检测炎症因子,以抑制炎症反应的程度评价中药提取物防治痤疮的效果。
1 材料
1.1 药材 苦参、当归、金银花、荷叶、艾叶均购于无锡市市民大药房,其中苦参、当归、金银花、荷叶、艾叶分别产自山西、甘肃、河南、山东、江苏。由江南大学赵炳天、刘学副教授鉴定,苦参为豆科植物苦参Sophora flavescens Alt.的根;当归为伞形科植物当归Angelica sinensis (Oliv.)Diels 的根;金银花为忍冬科植物忍冬Lonicera japonica Thunb.的花蕾;荷叶为睡莲科植物莲Nelumbo nucifera Gaertn.的叶;艾叶为菊科植物艾Artemisia argyi Lévl.et Van.的叶。
1.2 仪器 Tecan Infinite 200 PRO 多功能酶标仪(上海帝肯国际贸易有限公司);UV-1800PC 紫外分光光度计(翱艺仪器有限公司);BIONOON-10A真空冷冻干燥机(上海般诺生物科技有限公司);AX224ZH/E 电子天平 (奥豪斯仪器有限公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);FS-2 电热培养箱(南通沪南科学仪器有限公司);Centrifuge 5804R 离心机(艾本德中国有限公司);CP70ME 超速离心机(日本株式会社日立制作所);S-4800 扫描电子显微镜(日本株式会社日立制作所)。
1.3 试剂 胰蛋白胨(国药集团化学试剂有限公司,批号20181218);酵母浸膏(国药集团化学试剂有限公司,批号20171205);牛肉浸膏(国药集团化学试剂有限公司,批号20180131);琼脂粉(国药集团化学试剂有限公司,批号20181122);D (+) -无水葡萄糖(国药集团化学试剂有限公司,批号20180926); L-半胱氨酸盐酸盐(国药集团化学试剂有限公司,批号20170928);可溶性淀粉 (国药集团化学试剂有限公司,批号20180528);氯化钠(国药集团化学试剂有限公司,批号20180509);无水乙酸钠(国药集团化学试剂有限公司,批号20180808);RPMI1640 培养基(美国Hyclone 公司,批号AE24464298);胎牛血 清 (澳大利 亚 Ausgenex 公 司,批号FBSSA00616-1);人肿瘤 坏死因 子-α (tumor necrosis factor-α,TNF-α,批号350751)、人白细胞介素-1β (interleukin-1β,IL-1β,批号296222)、人白细胞介素-8 (interleukin-8,IL-8,批号297753) ELISA 试剂盒购自美国Novus Biologicals公司;CCK-8 试剂盒(上海碧云天生物技术有限公司,批号091918190314);BCA 试剂盒(上海碧云天生物技术有限公司,批号010719190225)。
2 方法
2.1 中药提取物制备 5 种中药粉碎后各称取10 g,100 mL 乙醇或水回流提取2 次,1.5 h/次,得药材的乙醇或水提取液。将提取液旋蒸至干,冷冻干燥,得中药提取物。称定质量,计算得率。提取物存放于4 ℃冰箱中备用。
2.2 细菌培养和炎症刺激物制备 牛肉浸膏10.0 g,酵母浸膏3.0 g,胰蛋白胨10.0 g,无水葡萄糖5.0 g,氯化钠5.0 g,无水乙酸钠3.0 g,可溶性淀粉1.0 g,半胱氨酸盐酸盐0.5 g,琼脂粉18.0 g,去离子水1 000 mL,配制成溶液,用2%NaOH 调pH 至6.8,用高压灭菌锅121 ℃下灭菌20 min。将培养基倒入培养皿中,冷却凝固,制成固体培养基。液体培养基配制时不加琼脂粉,其余同固体培养基。
将痤疮丙酸杆菌接种于液体培养基,37 ℃无氧培养直至OD600nm为1.0,即对数生长期,得菌悬液。菌悬液在5 000 g、4 ℃下离心15 min,得培养物上清液和细菌沉淀。细菌沉淀用磷酸缓冲溶液(phosphate buffer saline,PBS) 洗涤3 次,然后悬浮在PBS 中,置于80 ℃水浴中30 min 以实现热灭活,制成痤疮丙酸杆菌灭活物,4 ℃保存备用[4]。将培养物上清液用100-KDa 纤维膜超滤浓缩30 倍,用0.22 μm 孔径的过滤器过滤,滤液在150 000 g、4 ℃下离心3 h,除去上清液,用PBS 洗涤3 次,最后悬浮于PBS 中,制成外膜囊泡液,-80 ℃保存备用[5]。将外膜囊泡液附载在硅片上用白炽灯烤干,喷金后用扫描电镜观察形貌;用纳米粒度仪测定外膜囊泡粒径。用BCA 试剂盒结合酶标仪,以吸光度法测定蛋白标准曲线及外膜囊泡蛋白质量浓度[6]。
2.3 中药提取物的抑菌活性
2.3.1 牛津杯法测抑菌圈 用比浊法调整菌悬液浓度,使细菌浓度约在1×107cfu/mL。向固体培养基上加1 mL 菌悬液并用无菌三角玻璃刮铲涂布均匀。用镊子夹取牛津杯置于涂布菌悬液的固体培养基,轻压牛津杯使之与培养基接触良好。在牛津杯中分别加入100 μL 100 mg/mL 的各提取物溶液,其中水提取物溶剂为水,乙醇提取物溶剂为0.5%DMSO 溶液,以各自溶剂为空白对照组[7]。将培养皿放入自封袋中,并在自封袋中放入厌氧产气包,置于恒温培养箱中37 ℃培养48 h,用游标卡尺量取抑菌透明圈的直径,按下式计算抑菌圈直径。抑菌圈直径=抑菌透明圈的直径(mm) -牛津杯的外径(mm)
2.3.2 最小抑菌浓度实验 取各提取物溶液100 μL加入96 孔板中,并在每孔中加入100 μL 菌悬液,使药物终质量浓度为100.00、50.00、25.00、12.50、6.25、3.13、1.56、0.78、0.39、0.20、0.10 mg/mL,细菌浓度约在1×107cfu/mL,37 ℃厌氧培养48 h。96 孔板每孔取150 μL 培养液涂布于固体培养基,取无细菌生长的质量浓度为最小抑菌浓度[8]。
2.3.3 中药提取物对痤疮丙酸杆菌生长曲线的影响 将中药提取物溶于含有0.5% DMSO 的液体培养基配制成溶液,加5 mL 于试管中,再向试管中加入5 mL 菌悬液,使中药提取物终质量浓度为10 μg/mL,细菌浓度为1×107cfu/mL。每隔6 h 用紫外分光光度计测1 次菌悬液在600 nm 处吸光度值,以吸光度值与培养时间的关系绘制细菌生长曲线[9]。不加中药提取物的含有0.5% DMSO 的液体培养基作为空白对照组。
2.4 中药提取物对外膜囊泡释放的抑制作用 用含有10 μg/mL 中药提取物的液体培养基,37 ℃、5% CO2条件下培养痤疮丙酸杆菌至对数生长期,水提取物溶剂为水,乙醇提取物溶剂为0.5%DMSO 溶液,以各自溶剂为空白对照组。用“2.2”项下方法分离各实验组和空白对照组外膜囊泡,用BCA 试剂盒测定外膜囊泡蛋白质浓度。
2.5 药物组合的抗炎作用
2.5.1 痤疮丙酸杆菌和外膜囊泡与炎症的关系用含10%胎牛血清的RPMI1640 培养基调整THP-1细胞浓度为1×106/mL,置于37 ℃、5% CO2培养箱中培养至对数生长期,接种于12 孔板,调整细胞浓度为1×106/mL,分别用10 μg/mL 的痤疮丙酸杆菌灭活物、外膜囊泡刺激细胞,以不加炎症刺激物为空白对照组,培养24 h,用ELISA 试剂盒检测细胞培养上清液中IL-1β、IL-8、TNF-α 水平。
2.5.2 药物组合对THP-1 细胞炎症因子的抑制作用 将THP-1 细胞接种于96 孔板中,用含10%胎牛血清的RPMI1640 培养基调整THP-1 细胞浓度为2.5×106/mL,分别加入100、50、25、12.5、6.3、3.1 μg/mL 的中药提取物溶液,置于37 ℃、5%CO2培养箱中培养24 h,用CCK-8 试剂盒测细胞活力。以不加中药提取物的空白组的细胞活力为100%。THP-1 细胞接种于6 孔板,调整细胞浓度为1×106/mL,加入痤疮丙酸杆菌、无细胞毒性的中药提取物培养24 h。用ELISA 试剂盒检测细胞培养上清液中TNF-α、IL-1β、IL-8 水平。以不加中药提取物及痤疮丙酸杆菌为空白对照组,以不加中药提取物但加入痤疮丙酸杆菌为模型组。
2.6 统计学分析 取3 次重复实验结果,通过Prism7.0 软件对数据进行处理,数据以() 表示,组间比较采用单因素方差分析,以P≤0.05为差异具有统计学意义。
3 结果
3.1 中药提取物得率 如表1 所示,各中药的水提取物得率均高于乙醇提取物,且乙醇提取物为粉末状态,水提取物为干浸膏状态,原因是水提取物中通常含有较多的蛋白质和多糖类成分。
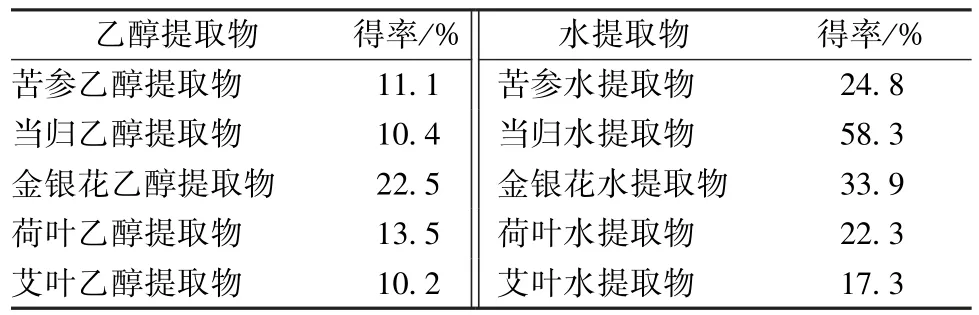
表1 中药提取物得率Tab.1 Several Chinese herbal medicine extracts yield
3.2 痤疮丙酸杆菌外膜囊泡的制备与检测
3.2.1 SEM 及纳米粒度仪测试 由图1A 可以看出外膜囊泡呈球体,直径约为150 nm 左右。如图1B 显示,由纳米粒度仪测得外膜囊泡粒径约为120~160 nm,平均粒径为149.6 nm,结果与SEM图像吻合。而痤疮丙酸杆菌的粒径为(1~10) μm×(0.5~1.5) μm,可以判断已成功将外膜囊泡与痤疮丙酸杆菌分离。

图1 外膜囊泡的粒径Fig.1 OMVs particle sizes
3.2.2 BCA 法测外膜囊泡蛋白浓度 测得蛋白质浓度在0~500 μg/mL 时与吸光值间的线性关系符合回归方程Y=9.39×10-4X+0.122 (R2=0.998),其中X 为蛋白浓度,Y 为吸光度值。将外膜囊泡液稀释4 倍后用BCA 试剂盒检测,取3 次平行实验的平均值,吸光度值为0.247±0.006,代入标准曲线计算得外膜囊泡液蛋白浓度为(532.01±24.19)μg/mL。
3.3 中药提取物的抑菌活性 由表2 可知空白对照组的抑菌圈为0 mm,证明溶剂无抑菌活性,对中药提取物的抑菌效果无干扰。提取物中除当归水提物对痤疮丙酸杆菌无抑菌活性外,其余提取物都有一定的抑菌活性,苦参的乙醇提取物抑菌效果最好,抑菌圈为(14.35±0.64) mm。除荷叶外,水提物的抑菌活性均低于乙醇提取物,因为水提物中常含有的蛋白质及多糖类成分,有助于细菌的生长,减弱了提取物的抑菌活性。
表2 中药提取物对痤疮丙酸杆菌的抑菌圈直径(,n=3)Tab.2 The diameter of the inhibition zone of several Chinese herbal medicine extracts against P.acnes (,n=3)

表2 中药提取物对痤疮丙酸杆菌的抑菌圈直径(,n=3)Tab.2 The diameter of the inhibition zone of several Chinese herbal medicine extracts against P.acnes (,n=3)
注:与空白对照组比较,**P<0.01。
由表3 可知苦参乙醇提取物的抑菌效果远远好于其它提取物,其最小抑菌浓度为0.2 mg/mL。10 μg/mL苦参乙醇提取物对痤疮丙酸杆菌生长曲线的影响如图2 所示,与未加提取物的空白对照组相比,苦参乙醇提取物在极低浓度时依然存在抑菌作用,24、48 h 抑菌率分别为60%、30%。
3.4 中药提取物对外膜囊泡释放的抑制作用 外膜囊泡液蛋白浓度为 (532.01±24.19) μg/mL,由图3A 可知金银花乙醇提取物、荷叶乙醇提取物对外膜囊泡的释放无抑制作用。苦参乙醇提取物、苦参水提取物、当归乙醇提取物、当归水提取物、金银花水提取物、荷叶水提取物具有弱抑制作用,抑制效果小于60%。艾叶乙醇提取物、艾叶水提取物有强抑制作用,艾叶乙醇提取物抑制效果最好。由图3B 可以看出艾叶乙醇提取物对外膜囊泡释放的抑制作用呈现剂量依赖性,10 μg/mL 艾叶乙醇提取物溶液对外膜囊泡的抑制率约为95%。因此,将具有抑制痤疮丙酸杆菌生长作用的苦参乙醇提取物和具有抑制外膜囊泡释放作用的艾叶乙醇提取物组合,作为抗炎作用提取物进行进一步研究。
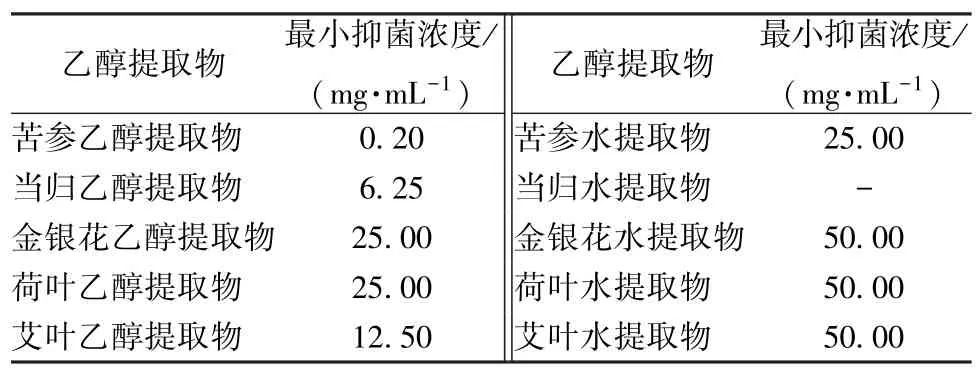
表3 中药提取物对痤疮丙酸杆菌的最小抑菌浓度Tab.3 Minimum inhibitory concentration of several Chinese herbal medicine extracts on P.acnes

图2 中药提取物对痤疮丙酸杆菌生长曲线的影响Fig.2 Effects of several Chinese herbal medicine extracts on P.acnes growth curve
3.5 药物组合的抗炎作用
3.5.1 痤疮丙酸杆菌和外膜囊泡与炎症的关系由图4 可知痤疮丙酸杆菌灭活物和外膜囊泡均可诱导THP-1 细胞炎症因子的表达,与相同蛋白质浓度的痤疮丙酸杆菌灭活物相比外膜囊泡引起THP-1细胞炎症因子表达的能力更强。可见,痤疮丙酸杆菌可通过本身毒素及释放外膜囊泡诱导THP-1 细胞的炎症因子表达。可用痤疮丙酸杆菌和THP-1细胞共培养的方式评价中药提取物的抗炎功效。

图3 中药提取物对痤疮丙酸杆菌释放外膜囊泡的抑制作用Fig.3 The inhibitory effects of several Chinese herbal medicine extracts on the release of P.acnes OMVs

图4 痤疮丙酸杆菌灭活物和外膜囊泡诱导THP-1 细胞IL-1β、IL-8、TNF-α 表达Fig.4 Expression of IL-1β,IL-8,TNF-α in THP-1 cells induced by inactivated P.acnes and its OMVs
3.5.2 提取物组合抑制痤疮炎症的作用 由图5可知,随着提取物质量浓度增大,细胞存活率随之降低,细胞毒性随之增大,取细胞活力≥90%的质量浓度为无细胞毒性浓度[10]。10 μg/mL 苦参乙醇提取物和10 μg/mL 艾叶乙醇提取物中细胞存活率分别为90%、93%,提取物达20 μg/mL 时细胞存活率仅有60%左右,因此当提取物质量浓度高于10 μg/mL 时具有潜在的毒性风险。苦参乙醇提取物+艾叶乙醇提取物组合的曲线表示了等质量浓度下苦参乙醇提取物与艾叶乙醇提取物的组合,10 μg/mL苦参乙醇提取物+10 μg/mL 艾叶乙醇提取物的组合虽然提取物总质量浓度为20 μg/mL,但细胞存活率与10 μg/mL 苦参乙醇提取物、10 μg/mL艾叶乙醇提取物相近,均为90% 左右,无细胞毒性。
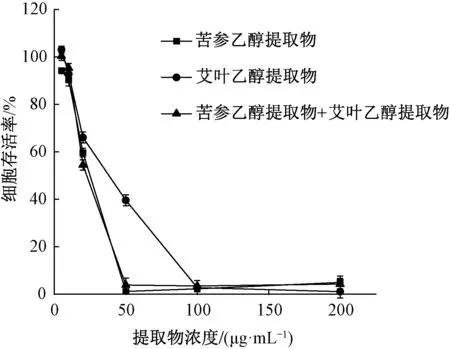
图5 苦参乙醇提取物、艾叶乙醇提取物及其组合对THP-1细胞存活率的影响Fig.5 Effects of ethanol extracts from Sophora flavescens,Artemisia argyi and their combinative use on the survival rate of THP-1 cells
用10 μg/mL 苦参乙醇提取物、10 μg/mL 艾叶乙醇提取物和10 μg/mL 苦参乙醇提取物+10 μg/mL艾叶乙醇提取物组合加入痤疮丙酸杆菌和THP-1细胞共培养体系中,测得苦参乙醇提取物、艾叶乙醇提取物、苦参乙醇提取物+艾叶乙醇提取物对THP-1 细胞炎症因子的抑制作用如图6 所示。相对于苦参乙醇提取物和艾叶乙醇提取物,苦参乙醇提取物+艾叶乙醇提取物组合增强了对于IL-1β、TNF-α 表达的抑制;且对IL-8 的表达抑制,增强效果更加明显。表明苦参乙醇提取物抑菌和艾叶乙醇提取物抑制外膜囊泡释放的共同作用发挥了更好的抗炎功效。

图6 苦参乙醇提取物、艾叶乙醇提取物及其组合的抗炎作用Fig.6 Anti-inflammatory effects of ethanol extract from Sophora flavescens,Artemisia argyi and their combinative use
4 讨论
痤疮丙酸杆菌是造成痤疮的重要原因,这一观点已被证实;但痤疮丙酸杆菌诱导痤疮产生的机理还不十分明确。在痤疮治疗方面,已经做了大量针对抑制痤疮丙酸杆菌生长和繁殖的工作,但效果并不理想[11]。根据文献报道[2],本实验验证了痤疮丙酸杆菌本身的毒素和它释放出的外膜囊泡均能导致炎症因子表达的升高,而且外膜囊泡的致炎效果更强。外膜囊泡是细菌的一种外泌体,对于革兰氏阴性菌外泌体的报道可以追溯到1963 年[12],而在2009 年才发现革兰氏阳性菌同样可以产生外泌体[13]。对革兰氏阳性菌外泌体的研究才刚刚起步,痤疮丙酸杆菌作为一种革兰氏阳性菌,抑制其外泌体的释放可能是痤疮治疗的新思路。
因此,为了抑制痤疮炎症在抑制痤疮丙酸杆菌的同时更应考虑抑制细菌外膜囊泡的释放,由此本文研究了苦参、当归、金银花、荷叶、艾叶乙醇和水提取物的抗菌作用及抑制细菌外膜囊泡释放的作用,以找到对2 个因素共同作用起到抗痤疮炎症效果的中药提取物组合。本实验发现苦参乙醇提取物和艾叶乙醇提取物的组合可以起到抑制痤疮丙酸杆菌和抑制细菌释放外膜囊泡的功效,同时在不增加细胞的毒性的情况下,起到相比于单个提取物更好的抑制痤疮炎症效果。组合中苦参乙醇提取物抑菌效果显著,对痤疮丙酸杆菌的抑菌圈为(14.35±0.64) mm,最小抑菌浓度为0.20 mg/mL,从细菌的生长曲线可以看出10 μg/mL 苦参乙醇提取物仍具有抑菌作用。艾叶乙醇提取物具有抑制外膜囊泡释放的作用,抑制作用呈现剂量依赖性,10 μg/mL时抑制效果达95%左右。10 μg/mL 苦参乙醇提取物、10 μg/mL 艾叶乙醇提取物、10 μg/mL 苦参乙醇提取物+10 μg/mL 艾叶乙醇提取物中细胞存活率分别约为90%、93%、90%,均无细胞毒性。因此苦参乙醇提取物和艾叶乙醇提取物的组合在痤疮预防和治疗方面有很好的应用前景。
