对照品替代法用于绿原酸含量测定的研究
2021-01-08罗华玲林海霞
罗华玲,林海霞
(乐山市食品药品检验检测中心,四川 乐山 614000)
绿原酸的药用历史悠久,有抗氧化、抗菌、抗病毒、降糖、降脂、降血压和免疫调节等多种药理作用[1-3]。绿原酸主要存在于石韦、金银花、菊花、杜仲叶等[4-6]药材中,也是某些中药复方制剂质量控制的重要指标,如小儿咽扁颗粒[7]等。绿原酸分子结构中含酯键、不饱和键及多元酚,使绿原酸水溶液易受热和光照而发生水解和氧化反应[8-12]。上述药品的含量测定项用高效液相色谱(HPLC)-外标法测定绿原酸,但单支绿原酸对照品为20 mg,价格昂贵,且其化学性质极不稳定,无法长期保存,测定时需临用新配。对照品替代法是现代分析技术中的一种新思路和新方法[13-16]。本文在参阅上述文献及对照品替代法测定药物含量报道的基础上,设计了以价格低廉、性质稳定的对乙酰氨基酚作为对照品替代,旨在解决对照物质获得困难、成本高和保管困难等问题。本文以两组分色谱峰相对保留时间为主、对乙酰氨基酚和绿原酸色谱峰紫外光谱为辅进行定性,利用测得的相对校正因子计算各供试品中绿原酸的含量,并将测定结果与《中国药典》2015年版一部收载外标法测定结果进行比较。
1 仪器与试药
1.1 仪器
Agilent 1260高效液相色谱仪(G4212B二极管阵列检测器、G1311C四元泵、G1316A柱温箱、G1329B自动进样器、OpenLAB CDS工作站,美国安捷伦公司);PE-A10高效液相色谱仪(二极管阵列检测器,珀金埃尔默公司);Agilent 1290高效液相色谱仪(G4212A二极管阵列检测器、G4204A四元泵、G1316C柱温箱、G4226A自动进样器、OpenLAB CDS工作站,美国安捷伦公司);XSE205 DualRange电子天平(瑞士梅特勒-托利多公司);CQ-100B超声波清洗机(上海跃进医用光学器械厂)。
1.2 试药
对乙酰氨基酚对照品(100018-201610,99.9 %),绿原酸对照品(110753-201817,96.8 %),阿魏酸对照品(110773-201614,99.0 %),甘氨酸对照品(140689-201605,100 %),精氨酸对照品(140685-201707,99.9 %)均购自中国食品药品检定研究院;石韦(市售饮片,四川某药业有限公司,批号180801,170901,180901,180201;四川某制药有限公司,批号1805303,1705005),小儿咽扁颗粒(市售,兰州某股份有限公司、黑龙江某制药有限公司,批号分别为20180922,181005),金银花(市售饮片,四川某中药有限公司,批号180301,180501;乐山某药业有限公司,批号180301),菊花(市售饮片,成都某药业有限公司,批号180501);乙腈为色谱纯,试验用水为纯化水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱仪:PE-A10高效液相色谱仪-二极管阵列检测器;色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.5 %磷酸溶液(B),梯度洗脱(0~8 min,8 % A;9~15 min,8 %→30 % A;16~24 min,30 % A;24~30 min,30 %→ 8 % A);检测波长240 nm;流速1.0 ml/min;柱温30 ℃;进样量10 μl。在上述色谱条件下理论板数分别以绿原酸和对乙酰氨基酚计,均不低于5000,相邻峰之间分离度均大于1.5。
2.2 溶液的配制
2.2.1 对照品溶液的配制 精密称取绿原酸对照品10.60 mg,置入10 ml量瓶,用50 %甲醇溶解并稀释至刻度,摇匀,作为绿原酸对照品贮备溶液;精密称取对乙酰氨基酚对照品10.73 mg,置入10 ml量瓶,用50 %甲醇溶解并稀释至刻度,摇匀,作为对乙酰氨基酚对照品贮备溶液。分别精密量取绿原酸及对乙酰氨基酚对照品贮备液各0.5,1,2,5,10 ml,置入100 ml量瓶,用50 %甲醇稀释至刻度,摇匀,制得线性系列混合对照品溶液。
2.2.2 供试品溶液的配制
(1)分别取石韦粉末(过二号筛)约0.2 g,精密称定,置入25 ml量瓶,再精密加入对乙酰氨基酚对照品贮备溶液0.5 ml,加入50 %甲醇适量,超声处理(功率300 W,频率25 kHz)45 min,放冷,用50 %甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
(2)分别取金银花粉末(过四号筛)约0.5 g,精密称定,置入50 ml量瓶,再精密加入对乙酰氨基酚对照品贮备溶液3 ml,加入50 %甲醇适量,超声处理(功率250 W,频率35 kHz)30 min,放冷,用50 %甲醇稀释至刻度,摇匀,滤过,即得。
(3)取菊花粉末(过一号筛)约0.25 g,精密称定,置入25 ml量瓶,再精密加入对乙酰氨基酚对照品贮备溶液 1 ml,加入70 %甲醇适量,超声处理(功率300 W,频率45 kHz)40 min,放冷,用70 %甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
(4)取小儿咽扁颗粒的内容物,混匀,取适量,研细,取约l g,精密称定,置入50 ml量瓶,再精密加入对乙酰氨基酚对照品贮备溶液0.5 ml,加入50 %甲醇适量,超声处理(功率 250 W,频率25 kHZ)30 min,放冷,用50 %甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.3 对照品替代法方法学考察
2.3.1 系统适用性试验 按2.1项色谱条件测定,对乙酰氨基酚和绿原酸的理论板数均大于5000,绿原酸色谱峰峰形良好,供试品溶液色谱中绿原酸与相邻峰的分离度均大于1.5。对乙酰氨基酚对照品、绿原酸对照品、阿魏酸对照品、甘氨酸对照品、精氨酸对照品液相色谱图见图1;混合对照品溶液及各供试品溶液(小儿咽扁颗粒、菊花、金银花、石韦)液相色谱图见图2。该条件下阿魏酸、甘氨酸、精氨酸保留时间为17.094,15.723,8.114 min,由图2可见,这几处时间点均有杂质峰干扰,无法测定,因此选择对乙酰氨基酚作为替代对照品。
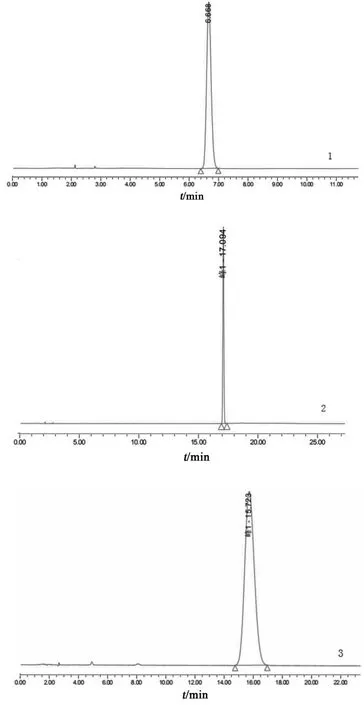
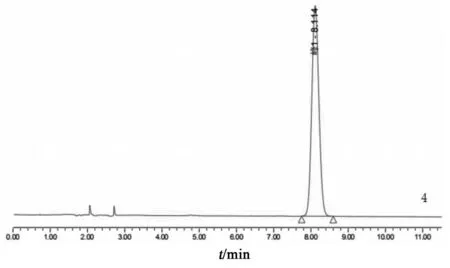
图1 对照品HPLC图谱
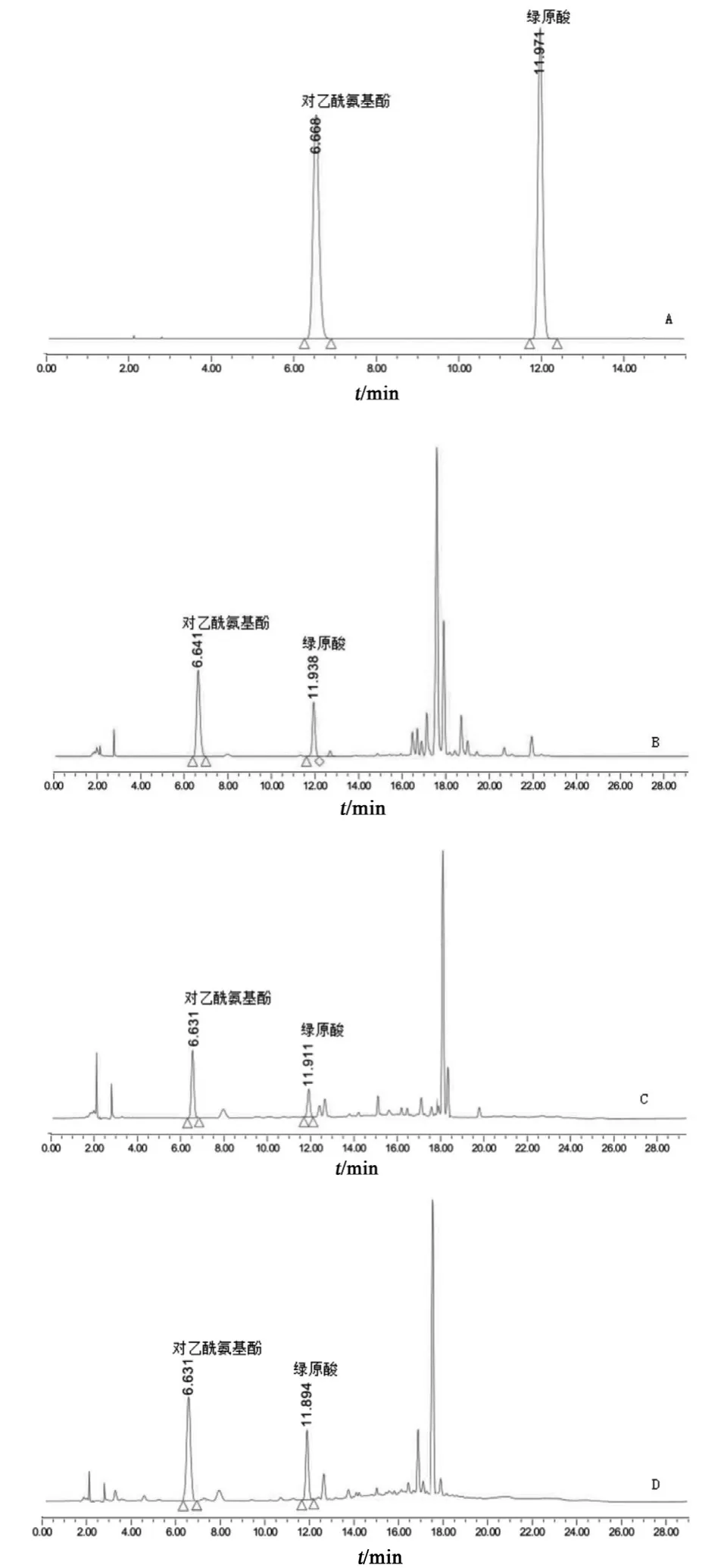
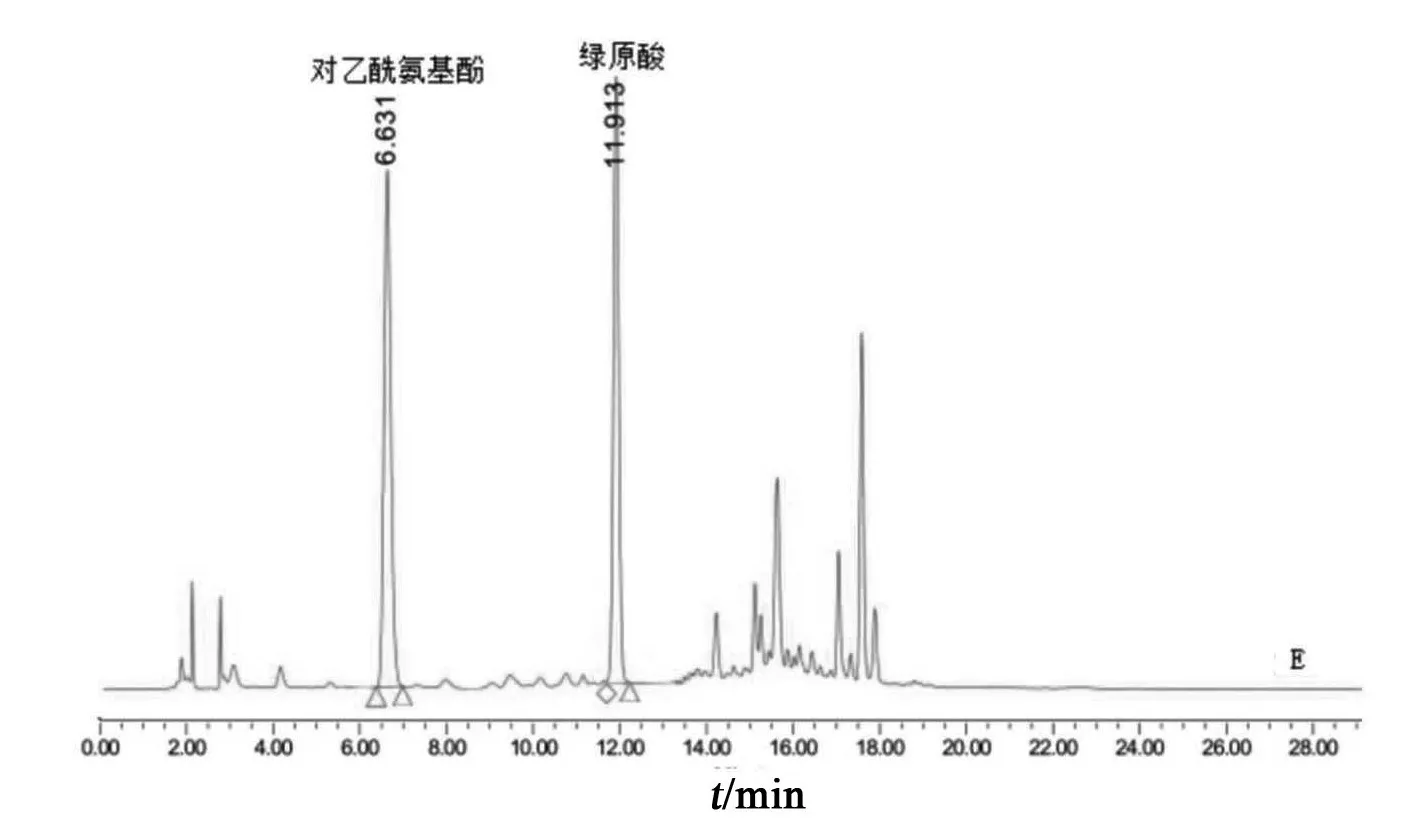
图2 混合对照品及供试品HPLC图谱
2.3.2 线性关系考察 精密量取2.2.1项下线性系列溶液,照2.1项下色谱条件进样分析,以峰面积Y为纵坐标,浓度X(μg/ml)为横坐标,进行线性回归。分别得绿原酸回归方程:Y=70 139X-29 383(r=1),线性范围5.13~102.60 μg/ml;对乙酰氨其酚回归方程:Y=35 654X-13 805(r=0.9999),线性范围5.36~107.19 μg/ml,表明两组分线性关系良好。
2.3.3 相对校正因子f的计算 采用斜率比值法,以2.3.2项峰面积(Y)与对照品浓度(X,μg/ml)进行线性回归,分别测定绿原酸和对乙酰氨基酚的标准曲线,将标准曲线的截距校正为0后(Y=66 071X,Y=33 825X),两条标准曲线斜率的比值的倒数即为相对校正因子f,计算结果为0.5119。由此,对照品替代法测定样品溶液中绿原酸浓度的计算公式为:Cm=f×Am×Cs/As。式中,Cm、Am分别为绿原酸浓度和面积,Cs、As分别为对乙酰氨基酚浓度和峰面积。
2.3.4 精密度试验 精密取2.2.1项下对照品溶液,照2.1项色谱条件进样分析,重复进样6次,记录色谱峰面积,计算RSD,结果绿原酸与对乙酰氨基酚色谱峰峰面积平均值(n=6)分别为6 776 310,3 727 016,RSD(n=6)分别为0.24 %和0.29 %。表明仪器精密度良好。
2.3.5 稳定性试验 取石韦粉末,照2.2.2项下供试品溶液的制备方法制备供试品溶液,分别于配制后放置入0,2,4,8,12,24 h,照2.1项色谱条件进样分析,记录色谱峰面积,计算得到24 h内绿原酸色谱峰峰面积分别为630 897,631 054,629 750,628 345,627 121,625 848,RSD(n=6)为0.33 %,表明供试品溶液在24 h内稳定性良好。
死不认账,是吧?你知道这张照片是谁给我的吗?是王鲶鱼。他已经把我给甩了,是老梅毁了我的幸福。王鲶鱼还知道你是老梅的鸭子。老梅每个月给你两千块钱,对不对?
2.3.6 重复性 取石韦粉末,照2.2.2项下供试品溶液的制备方法平行制备6份供试品溶液,照2.1项色谱条件进样分析,以对照品替代法计算6份供试品溶液中绿原酸的平均含量(n=6)为0.116 %,RSD(n=6)为0.7 %,表明该方法的重复性良好。
2.3.7 准确度 取石韦粉末(过二号筛)约0.2 g,精密称定,置入25 ml量瓶,分别精密加入对乙酰氨基酚对照品贮备液(107.19 μg/ml)2 ml和绿原酸对照品贮备溶液(102.60 μg/ml)2 ml,加入50 %甲醇适量,超声处理(功率300 W,频率25 kHz)45 min,放冷,用50 %甲醇稀释至刻度,摇匀,滤过,取续滤液,即得供试品溶液,平行制备6份,照2.1项色谱条件进样分析,记录色谱峰面积,分别按对照品外标法和对照品替代法计算回收率和RSD,结果平均回收率分别为98.33 %和98.65 %(n=6),RSD为1.34 %和1.30 %。结果见表1。
2.4 相对校正因子的耐用性考察
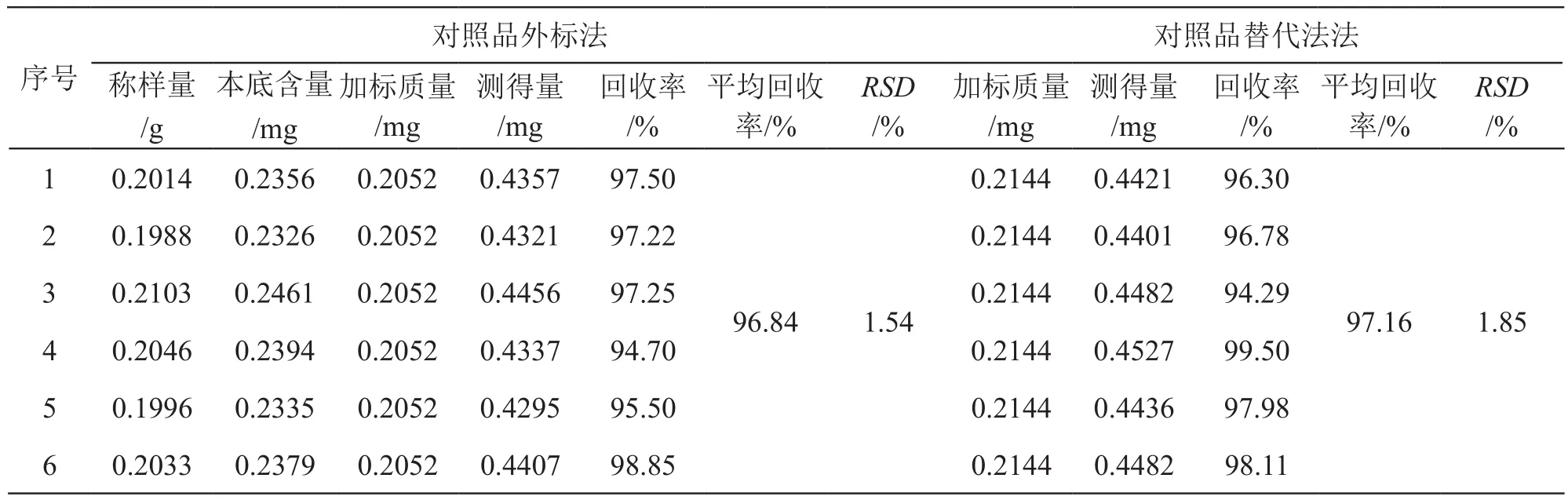
表1 绿原酸回收率测定结果(n=6)
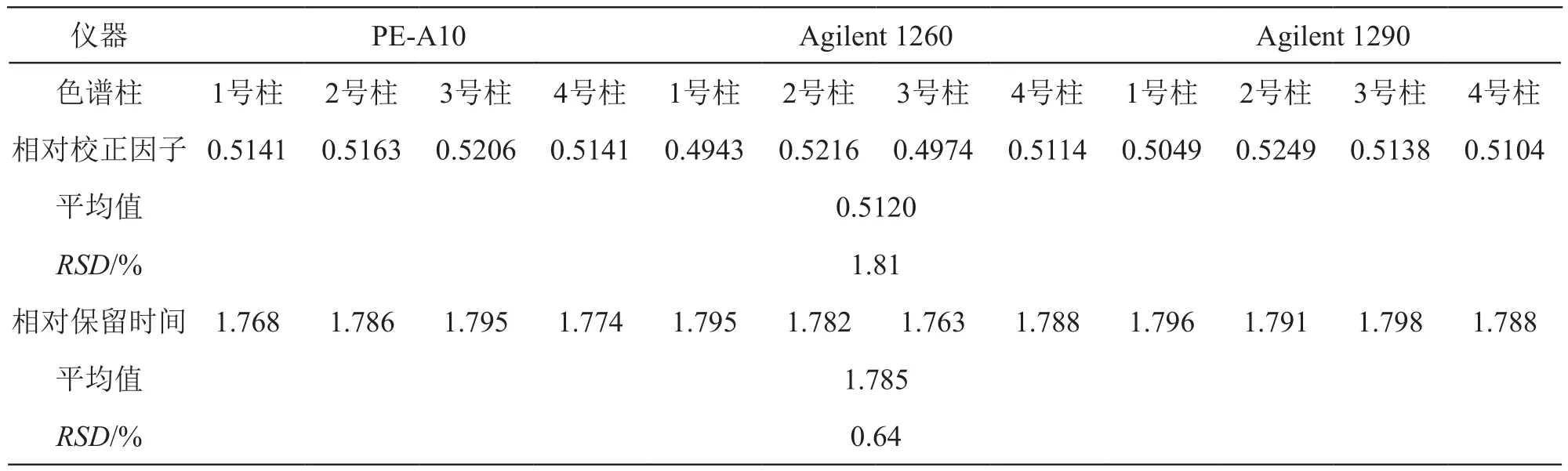
表2 不同仪器及不同品牌色谱柱测得的相对校正因子
2.4.1 不同仪器及不同品牌色谱柱的考察 实验分别考察采用PE-A10高效液相色谱仪、Agilent 1260高效液相色谱仪、Agilent 1290高效液相色谱仪,分别用Kromail 100-5-C18(250 mm×4.0 mm,5 μm,1号柱)、Agilent 5 TC-C18(2)(250 mm×4.6 mm,5 μm,2号柱)、Kromasil C18(250 mm×4.6 mm,5 μm,3号柱)、Diamonsil C18(250 mm×4.6 mm,5 μm,4号柱) 共4根色谱柱,测定对乙酰氨基酚对绿原酸的相对校正因子f,结果表明,不同仪器及不同色谱柱对相对校正因子的影响不显著,表明相对校正因子在不同仪器及不同品牌色谱柱下有好的耐用性。结果见表2。
2.4.2 不同流速对相对校正因子的影响 照2.1项色谱条件进样分析,考察流速为0.8,1.0,1.2 ml/min的相对校正因子,结果分别为0.5118,0.5241,0.5128,RSD(n=3)为1.32 %,表明相对校正因子在一定的流速范围内有良好的适用性。
2.4.3 不同柱温对相对校正因子的影响 照2.1项色谱条件进样分析,考察柱温为25,30,35 ℃的相对校正因子,结果分别为0.5128,0.5189,0.5035,RSD(n=3)为1.52 %,表明相对校正因子在适宜的柱温范围内有良好的适用性。
2.4.4 不同测定波长对相对校正因子的影响 照2.1项色谱条件进样分析,考察测定波长为236,240,244 nm的相对校正因子,结果分别为0.5087,0.5201,0.5104,RSD(n=3)为1.20 %,表明在同一台液相色谱仪上,测定波长变化4 nm,对f值影响不大。
2.5 对照品替代法法待测成分色谱峰的定位
2.6 对乙酰氨基酚对照品稳定性试验
将2.2.1项下对照品贮备溶液于室温下放置0,2,4,8,12,24 h后,按2.1项下色谱条件进样测定,记录色谱峰面积,色谱峰面积RSD为0.56 %,表明对照品溶液在24 h内稳定性良好。
2.7 含量测定
分别收集4个品种共12批次样品,按2.2.2项方法制备供试品溶液,照2.1项色谱条件下进样测定,分别用对照品外标法和对照品替代法计算12批样品绿原酸含量,并将两结果进行比较,验证替代对照法计算含量的准确性,结果见表4。由表4可见,2种方法测定的结果无显著性差异,表明以对乙酰氨基酚为对照品替代可用于石韦、金银花、菊花、小儿咽扁颗粒中绿原酸含量的测定。
3 讨论
3.1 对照品替代法的选择
本实验分别考察了对乙酰氨基酚、阿魏酸、甘氨酸、精氨酸与绿原酸的色谱保留时间及分离情况。各供试品在阿魏酸、甘氨酸、精氨酸保留时间点均出现干扰峰,所以选择对乙酰氨基酚作为绿原酸含量测定的对照品替代。
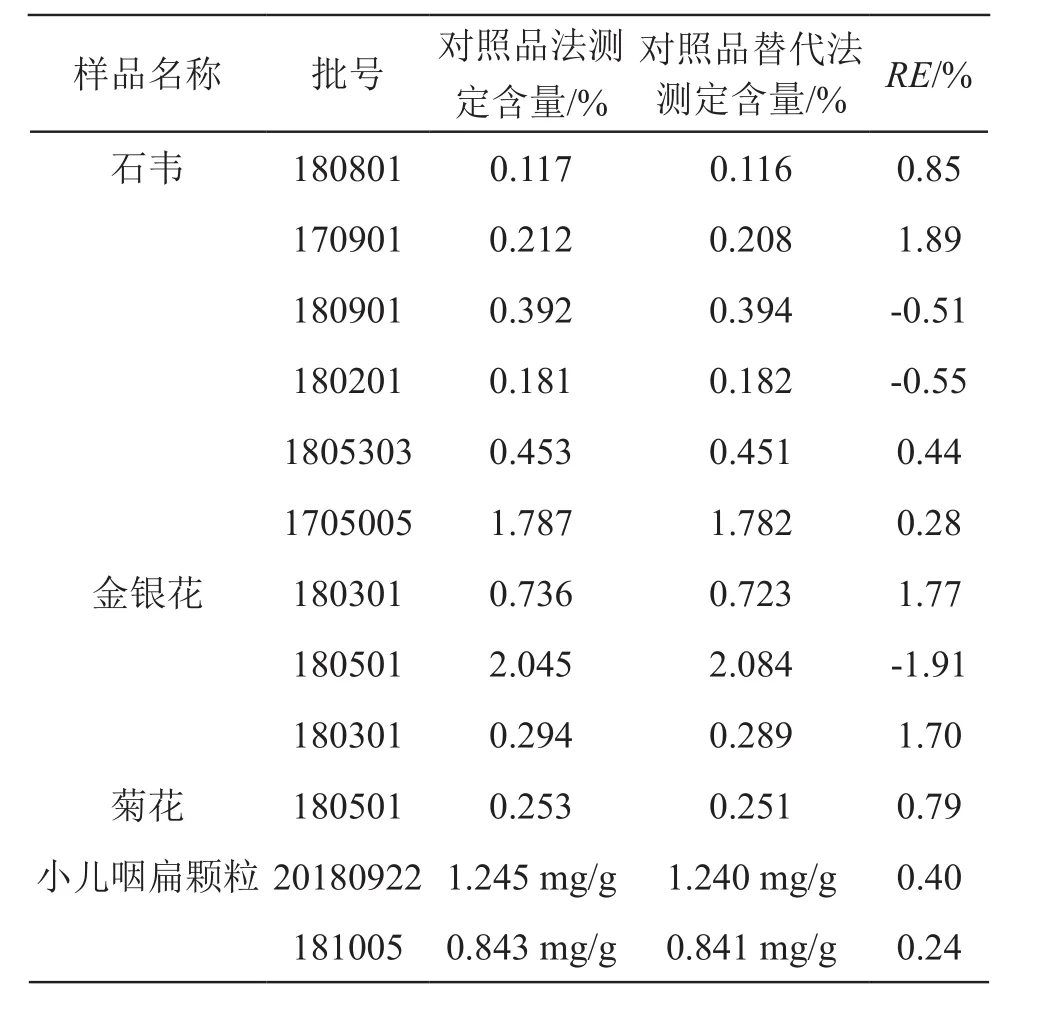
表4 样品含量测定结果(n=6)
3.2 测定波长的选择
根据绿原酸和对乙酰氨基酚对照品的紫外光谱图,见图3。可见绿原酸在240 nm、326 nm波长处有吸收峰;对乙酰氨基酚在244 nm波长处有吸收峰。在326 nm波长处测定的相对校正因子为0.1429;在240 nm波长处测定值为0.5119,根据中药标准物质替代测定法技术指导原则,相对校正因子应接近1,一般不超过0.2~5[13],因此本实验选定测定波长为240 nm。
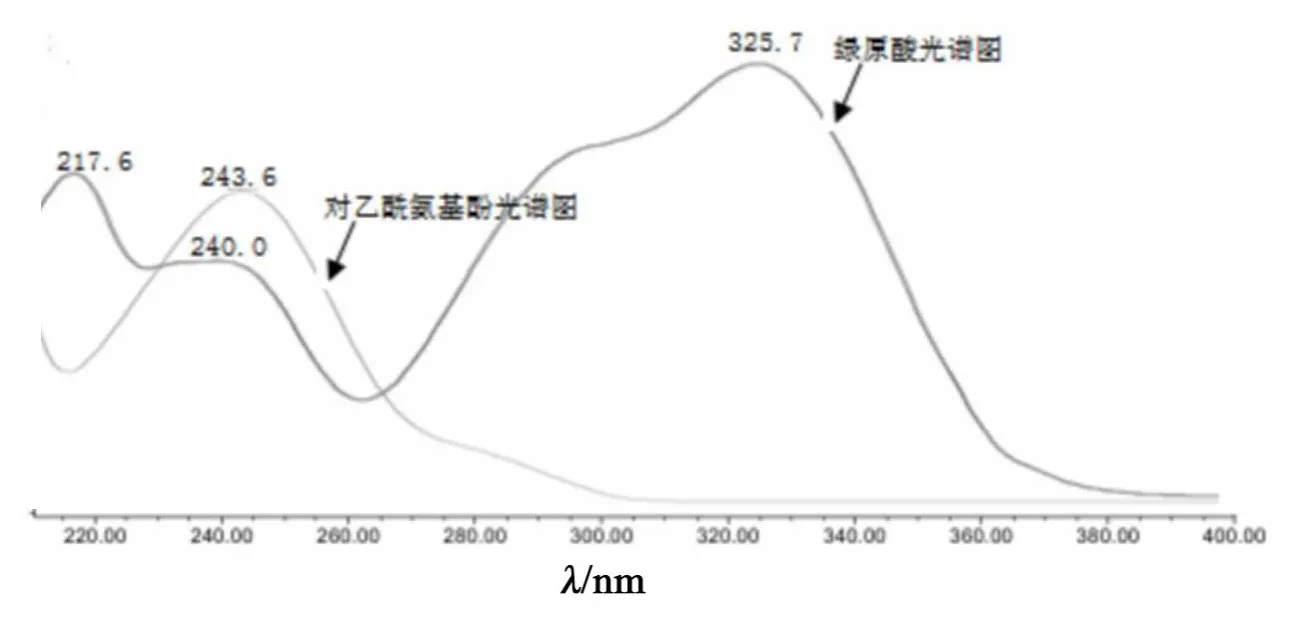
图3 绿原酸和对乙酰氨基酚紫外光谱图
3.3 色谱峰的定性
本文使用以两组分色谱峰相对保留时间为主、对乙酰氨基酚和绿原酸色谱峰紫外光谱为辅的定性方法,通过计算乙酰氨基酚和绿原酸的相对保留时间,预确定待测成分的位置;再通过比对待测成分与标准光谱图的一致性进行辅助定位,提高待测成分色谱峰定位的准确度。
3.4 绿原酸溶液的稳定性
绿原酸对照品大多以50 %甲醇配制,并置棕色量瓶中避光保存,即使如此,本实验仍发现,当绿原酸溶液存储一周后,其峰面积下降约1 %;存储一个月后,其峰面积下降约20 %,液相色谱图可见绿原酸峰旁有较大的降解杂质峰。文献报道,绿原酸溶液在中性或碱性环境下含量明显降低,而在酸性条件下含量变化不大,在pH 2~4较稳定[12];另外光线对绿原酸水溶液稳定性的影响也较大,贮存和测定时应注意避光[9]。
3.5 色谱峰的确认
现有文献中对照品替代法色谱峰的定位多采用相对保留时间法,但在实际操作中,使用不同品牌和规格色谱柱时,相对保留时间会有一定变化。根据本研究色谱峰的定性方法,需确认样品溶液色谱图中在对照品替代法色谱峰的位置是否有其他物质色谱峰干扰,应采用色谱峰纯度检查进行确认。
4 小结
本研究采用对乙酰氨基酚对照品替代法法,用于石韦、金银花、菊花、小儿咽扁颗粒中绿原酸含量的测定,确定了对乙酰氨基酚和绿原酸的相对校正因子,对其耐用性进行考察,将测定结果与对照品外标法进行比对,并进行了方法学验证。结果表明:不同仪器和不同色谱柱、不同流速、不同柱温对相对校正因子f值无显著影响。对照品外标法和对照品替代法结果无显著性差异。本研究认为,对于石韦、金银花、菊花、小儿咽扁颗粒中绿原酸含量的测定,已建立的对乙酰氨基酚与绿原酸之间的相对校正因子具有较高的可信度,可用对乙酰氨基酚替代价格贵、化学性质不稳定的绿原酸。以对乙酰氨基酚代替绿原酸作为对照品,采用HPLC法测定绿原酸的含量进行质量控制,是经济、可行、实用的,可用于含绿原酸成分的中药饮片及中成药的含量测定。
