水产品中六溴环十二烷检测技术及污染水平研究进展
2021-01-08钱卓真汤水粉位绍红
钱卓真,汤水粉,位绍红
(福建省水产研究所,福建 厦门 361013)
近四十年来,非芳香族溴化阻燃剂[1-2]六溴环十二烷(Hexabromocyclododecane,HBCD)一直被用于阻燃、发泡聚苯乙烯和挤塑聚苯乙烯绝缘板、建筑材料、装饰纺织品、电气家用设备、塑料和其他有机材料[3]。商品化HBCD主要由10%~13%α-HBCD、1%~12%β-HBCD和75%~89%γ-HBCD组成。全球HBCD的产量从2001年的16.7×104t增至2011年的31.0×104t[4-5],而2011年,中国的HBCD产能也高达1.8×104t。作为添加型阻燃剂,HBCD容易在生产、使用和废弃的过程中析出,对周围环境造成污染。研究表明,HBCD几乎存在于所有环境介质中,包括空气[6]、水[7]、沉积物[7-8]、人体母乳[9]和生物群[10]。HBCD 具有一定的亚慢性毒性,主要为甲状腺毒性效应[11-12]、肝毒性[13]、神经毒性效应[14]、生殖及生长发育毒性效应[15]等。因具有持久性有机物的持久性、生物累积毒性和远距离传输性的特点,HBCD对人类健康造成威胁,2013年《斯德哥尔摩公约》将六溴环己烷列为持久性有机污染物之一[16]。中国则在2017年禁止HBCD的生产、使用和进出口,并将其列入《中国严格限制进出口的有毒化学品目录》[17]。鉴于HBCD的低水溶性和高亲脂性(LogKow=5.625),HBCD更易在水生生物中积累[18],因此有关水产品中HBCD的监测和暴露风险评估研究已成为目前国内外研究的热点。
建立HBCD的准确、灵敏的分离分析方法,包括样品前处理方法、仪器分析方法,对于开展水产品中HBCD污染水平调查具有重要的意义。因此,本文依据现有文献,主要针对水产品中HBCD的检测技术和污染水平的状况进行综述。
1 检测技术
1.1 前处理技术
水产品样品基质较为复杂,不同品种、不同组织样对目标物的灵敏度影响也不同,例如:鳗鲡的脂肪含量较高,虾的色素含量较高,蟹黄的水溶性蛋白含量较高。而且,HBCD属于痕量污染物,对方法的灵敏度和选择性有很高的要求。因此,水产品中HBCD的痕量检测技术的开发具有一定的难度。
表1汇总了水产品中HBCD的提取和净化方法。表1可见,水产品中HBCD的常见提取方法有索氏提取[19-21]、加速溶剂萃取(ASE)[22-23]、超声波提取[24-25]等,常用的提取溶剂有丙酮、正己烷、二氯甲烷或其混合溶剂等。索氏提取耗时但提取效率高;加速溶剂萃取所需仪器昂贵但提取效率高;超声波萃取不仅提取效率高且操作简便,适合大批量样品前处理。提取过程中溶出的脂肪、色素等共流出物会对仪器设备等造成污染性破坏,需要进一步净化。现有常用的除脂方法有浓硫酸氧化、酸化硅胶处理、固相萃取法、凝胶渗透色谱法(GPC)等。其中,凝胶渗透色谱法是最为有效安全的净化方法,可在不破坏目标物的前提下有效除去脂肪和色素。Xia等[22]采用GPC对鱼类样品的提取液进行净化,方法回收率70%~110%。钱卓真等[25]采用浓硫酸结合硅胶固相萃取柱净化方法对贝类样品进行净化处理,也能有效去除脂肪和色素,适合大批量样品的前处理。此外,近年也有学者将QuEChERs应用于水产品中的HBCD残留量的快速测定。在1 μg/kg加标浓度下,Lankova等[26]分别比较了索氏提取结合GPC与QuEChERs对目标物HBCD回收率的影响,实验结果表明,QuEChERs(HBCD回收率>90%)优于传统的索氏提取结合GPC法(HBCD回收率<80%)。为了考察QuEChERs方法的有效性,Lankova等分别在不同脂肪含量的鲶鱼(脂肪含量1%)、鲑鱼(脂肪含量8%)进行不同浓度水平的加标回收实验,实验结果表明,在0.5 μg/kg加标浓度下,鲶鱼体内α-HBCD、β-HBCD、γ-HBCD的平均回收率分别为104%、115%、112%,相对标准偏差分别为12%、5%、8%;在10 μg/kg加标浓度下,鲑鱼体内α-HBCD、β-HBCD、γ-HBCD的平均回收率分别为98%、109%、103%,相对标准偏差分别为5%、5%、6%;定量限(LOQ)分别为0.25、0.1、0.1 μg/kg。国内于紫玲等[27]采用QuEChERs方法,建立了同时测定水产品中HBCD和四溴双酚A的超高效液相色谱-串联质谱方法,并且作者也对比了QuEChERs法和GPC法对样品中HBCD的净化效果,两种方法无显著差异(P>0.05),但QuEChERs法操作更为简便,适合大批量样品处理。
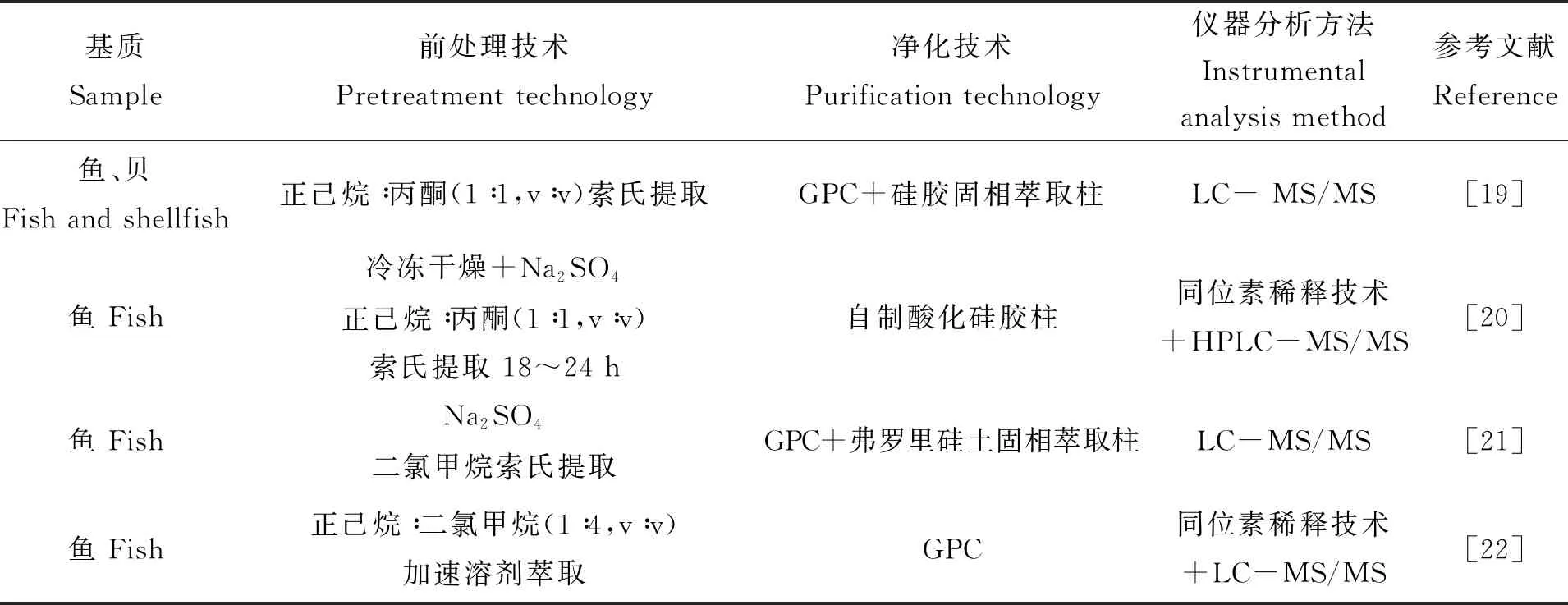
表1 HBCD的主要分析方法Tab.1 Analytical methodologies for HBCD

续表1
1.2 仪器分析方法
采用气相色谱-电子捕获负化学电离源-质谱(GC-ECNI-MS)检测HBCD,通过脱溴生产的溴离子测定HBCD,从而获得较高灵敏度[28]。但传统的非极性毛细管柱不能有效分离α-HBCD、β-HBCD、γ-HBCD,仅能测定HBCD总量。并且在温度达到160℃以上时,3种异构体会相互转化;而在240℃以上时,HBCD会发生脱溴现象,从而污染色谱柱和色谱仪[29]。
目前,液质联用法是最常被应用于水产品中HBCD残留量测定的方法。离子阱质谱和单四级杆质谱仅能测定HBCD的分子离子,其中离子阱质谱上γ-HBCD响应最高,单四级杆上α-HBCD响应最强[30]。液相色谱-串联质谱由于其高灵敏度和高选择性而成为测定水产品中HBCD残留量的首选仪器。与电喷雾离子源(ESI)联用时,共流出物容易产生离子抑制效应而降低检测的灵敏度,但可通过提高净化效率、基质标准曲线法、同位素稀释法等排除其他离子干扰。例如:范允卿等[20]采用稳定同位素稀释技术,在鱼肉样品中加入13C-α-HBCD、13C-β-HBCD、13C-γ-HBCD内标溶液,正己烷-丙酮混合溶液索氏提取18~24 h,酸化硅胶固相萃取柱净化,高效液相色谱-串联质谱测定,内标法定量;α-HBCD、β-HBCD、γ-HBCD的方法检测限分别低至30.6 pg/g、9.5 pg/g、17.4 pg/g,灵敏度高。同样,也可以通过与大气压化学电离源(APCI))联用来避免离子抑制效应[31]。此外,Zacs等[32]也将超高效液相色谱-飞行时间-高分辨率质谱(UPLC-TOF-HRMS)和超高效液相色谱-轨道离子阱-高分辨率质谱(UPLC-Orbitrap-HRMS)应用于鱼肉中HBCD的痕量定量分析。
2 污染水平
2.1 国内污染水平
自HBCD 被提名成为一类新的持久性有机污染物候选物质以来,国内外研究人员积极开展相关研究(表2)。Shi 等[33]采用总膳食研究方法检测了2007年采自中国12个省份的四类动物性食品,水产品中 α-HBCD 是主要的非对映异构体,含量范围ND~2.22 ng/g lw(None detected,ND:未检出;Lipid weight,lw:脂重;以下同此)。
2.1.1 东部沿海地区污染水平
Xia等[22]检测了2008年采自大连至厦门一带沿海地区的大黄鱼和白鲳鱼,所有样本均检出 HBCD,含量范围为0.57~10.1 ng/g lw,α-HBCD显示出显著的优势(87.5%~100%的总贡献),表明其较高的生物累积潜力;且研究表明不同地区HBCD污染水平存在差异,北方大连地区鱼类HBCD含量最高,温州最低。Zhu 等[34]检测了2009—2010年采自中国渤海地区的软体动物,HBCD含量范围为25.1~148.87 ng/g lw,平均值为58.76 ng/g lw。
2.1.2 南部沿海地区污染水平
流经广东省主要区域的东江,其鱼类中HBCD检出率为71%,α-HBCD、β-HBCD、γ-HBCD的平均值分别为143、5、9 ng/g lw,含量范围为ND~832 ng/g lw;表明工业集中区对周边环境影响较大,HBCD易在鱼体中富集残留[35]。Meng等[36]对我国南方12种食用鱼的HBCD含量进行了测定,HBCD检出率为70%,含量范围为ND~0.194 ng/g ww(Wet weight,ww:湿重,以下同此);食肉鱼类的HBCD含量高于草食性和碎屑性鱼类,表明HBCD可能通过营养链进行生物放大;此外淡水养殖鱼类和海水养殖鱼类的HBCD浓度均高于野生海鱼,这说明人类活动可能是水产养殖中HBCD的重要输入源。台湾地区的总膳食暴露风险研究表明[37],鱼类、其他海产品、猪肉中HBCD的检出率较高,含量范围分别为0.02~1.66、0.01~0.06、0.02~0.09 ng/g ww;鱼类中α-HBCD是最主要的异构体(86.6%),其次是γ-HBCD(8.9%)、β-HBCD(4.4%),其他海产品中α-HBCD与γ-HBCD占比相当,分别占42.4%、41.6%。Sun等[38]调查了珠江三角洲流域及电子垃圾回收场附近流域的鱼类中HBCD的污染水平,鲢鱼、罗非鱼、下口鲇体内HBCD含量分别为12.8~640、5.90~115、34.3~518 ng/g lw;且HBCD浓度与国内生产总值或人口数据无显著相关性,而电子废物回收活动、港口建设和货物可能是最主要的HBCD来源。
2.1.3 内陆地区污染水平
王翼飞等[39]则是采用对市售食品进行检测来评估食物中HBCD污染水平,其中水产品中HBCD的检出率为78%,含量范围为ND~40.51 ng/g lw,中值为5.53 ng/g lw;α-HBCD是最主要的异构体,然后依次是γ-HBCD、β-HBCD。Zhu等[40]首次开展了青藏高原水生生态系统中HBCD的污染情况研究,结果表明HBCD检出率高达65.8%,含量范围为ND~13.7 ng/g lw,α-HBCD是其主要异构体,占HBCD含量的78.2%;且研究发现HBCD的含量不仅与鱼脂肪含量显著相关,而且与年降雨量存在正相关关系,表明HBCD可能通过大气进行远距离传播。
2.2 国外污染水平
HBCD在日本沿海的鳗形目、鲈形目、鲱形目、养殖鲑形目中的含量范围分别为0.05~36.5、ND~26.2、0.09~77.3、1.09~1.34 ng/g ww,中位值分别为2.09、0.75、0.12、1.29 ng/g ww;而甲壳类动物、软体动物、鲽形目、鲉形目未检出或检出值极低;研究还发现对于含量20 ng/g ww以上的鱼类,γ-HBCD是其主要异构体,表明附近的工业排放对其有较大影响,而其他野生鱼类和养殖鱼类则是以α-HBCD为主,这表明HBCD可能通过食物链进行生物放大[41]。另一项日本研究者则是通过采集市售鱼开展HBCD污染研究,HBCD检出率高达90%,含量范围<0.02~21.9 ng/g ww,且来自日本海域和中国海域的鱼类中HBCD含量差异不大[42]。
由于欧洲、美洲较早广泛使用HBCD,因此相关研究较多。早在2006年,苏格兰[43]的4类贝类样品均检出HBCD,其含量为0.03~12.1 ng/g ww。2008—2012年,Munschy等连续5年对海洋贝类中HBCD污染水平开展研究,结果表明,2008—2010年期间[44]贝类中HBCD含量为0.01~0.55 ng/g ww,而2011—2012年[45]HBCD的污染水平则呈上升趋势。在捷克共和国[46]6大主要河流采集的48份鱼类中,HBCD的检出率、中位值和含量范围分别为80%、0.44 ng/g ww和0.02~11.6 ng/g ww。荷兰的van Leeuwen等[19]重点研究了鱼和贝类中HBCD的残留情况,研究发现人工饲养的鳝鱼或三文鱼体内几乎未检出HBCD,同样海鱼和贝类体内HBCD检出率不高,含量范围为ND~7.3 ng/g ww,但野生淡水鳗鲡体内HBCD检出率近似100%,且出现多个高浓度的HBCD值。Nøstbakken等[47]分析2006—2016年挪威地区9381份鱼类样本数据,分析结果表明,鱼肉中HBCD含量范围 表2 国内外水产品中 HBCD污染水平Tab.2 Pollution levels of HBCD in aquatic products collected from different countries 水产品中HBCD的前处理方式有很多种,提取方法有索氏提取、加速溶剂萃取、超声波萃取,净化方法有浓硫酸氧化、酸化硅胶处理、固相萃取法、凝胶渗透色谱法等,还有近年来一种新的快速样品前处理技术QuEChERs方法,这些方法将是水产品中HBCD前处理技术的主要开发方向。相较于其他仪器分析方法,LC-MS/MS则是HBCD及其代谢物分析测定的首选方法。水产品中普遍存在HBCD,且污染水平高于其他类食品,α-HBCD是水产品中HBCD的最主要异构体。各国水产品中HBCD的污染水平不同,但工业来源是HBCD排放到环境的主要途径。值得关注的是,水产品中HBCD的生物利用度常假设为100%,这可能会导致高估人类对HBCD的饮食暴露。水产品中的HBCD污染水平以及HBCD在人体中的生物利用率和代谢情况还需要进一步研究。影响HBCDs非对映异构体分布的因素有很多,这意味着目前导致HBCDs非对映异构体分布的机制研究还有待进一步开展。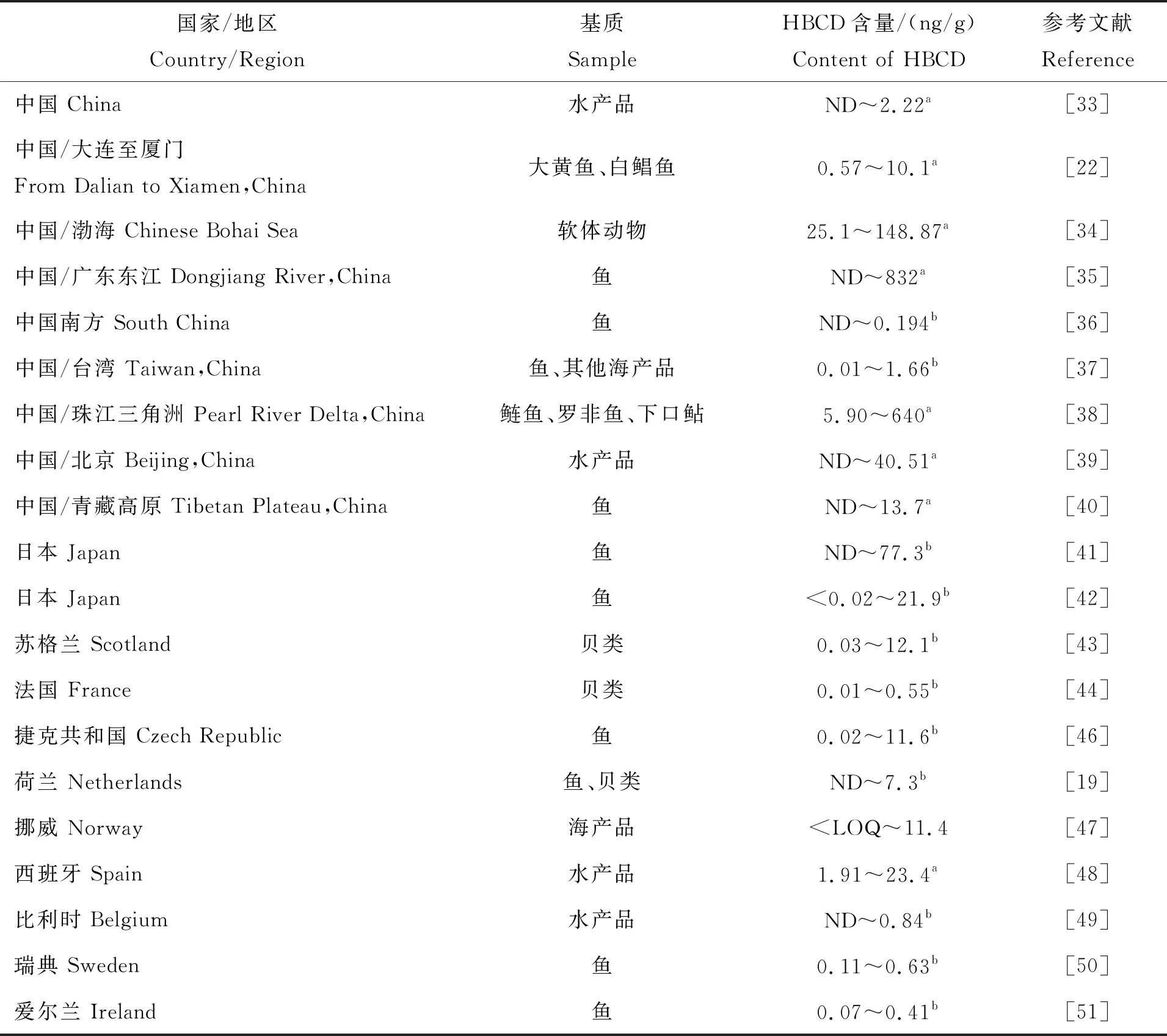
3 结论和展望
