胸腔镜下亚肺叶切除术治疗早期非小细胞肺癌患者的效果
2021-01-07李宏伟
李宏伟
新乡市第一人民医院,河南 新乡453000
非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)在肺癌总发生率中占80%~90%,具有较高发病率及病死率[1-2]。胸腔镜肺叶切除术为IA 期NSCLC 主要治疗方案,具有创伤小、术后恢复快等优势,但手术过程中易受组织血管粘连等影响,出血量较大,不利于术后康复。近年来,随着微创观念深入人心,临床开始尝试亚肺叶切除术,亚肺叶切除术操作简单,手术用时较短,肺段切除可更好保留患者肺组织,利于术后肺功能恢复[3]。本研究回顾性分析我院79 例早期NSCLC 患者临床资料,旨在从手术出血量、肺功能指标等方面探讨胸腔镜下亚肺叶切除术的临床应用价值,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析我院2014 年2 月至2017年1 月79 例NSCLC 患者的临床资料,依照手术方案不同分为观察组(n=41)、对照组(n=38)。对照组男性21 例,女性17 例,年龄35~77 岁,平均(56.31±8.30)岁;肿瘤直径1.1~3.7cm,平均(2.41±0.51)cm;病理类型:10 例鳞癌、28 例腺癌。观察组男性23 例,女性18例,年龄34~78 岁,平均(57.44±8.13)岁;肿瘤直径1.0~3.8cm,平均(2.50±0.48)cm;病理类型:11 例鳞癌、30 例腺癌。两组一般资料均衡可比(P>0.05)。
1.2 入选标准 (1)纳入标准:术后经病理结果显示为ⅠA 期NSCLC。(2)排除标准:胸腔粘连中转开胸手术者;合并严重感染者;肺结核者;严重心、肝等重要脏器功能不全者;小细胞肺癌者;合并其他恶性肿瘤者。
1.3 方法 两组均于术前进行常规生化指标检查。
1.3.1 对照组。采用胸腔镜下肺叶切除术治疗,健侧卧位,腋下垫软枕,利用托手架将上肢上举并固定,行双腔气管插管,全身麻醉,于第7 肋间腋中线位置做观察孔,切口长约1.5cm,于腋前线第3、4 肋间做主操作孔,切口长约3.0cm,于第8 肋间腋后线位置做副操作孔,切口长约1.5cm;经胸腔镜观察孔探明胸膜腔内肿瘤大小、部位及浸润情况;由主操作孔置入手术器械(分离钳、卵圆钳等),利用乳突拉钩撑开主操作孔,于腹腔镜直视下依照由上至下、由前至后顺序切除肺叶;切除肺组织放置于无菌标本袋内移出胸腔;根据患者情况,清扫纵隔淋巴结、肺门等,留置胸腔引流管。
1.3.2 观察组。采用胸腔镜下亚肺叶切除术治疗,手术体位摆放、麻醉方式、胸腔镜创建方法同对照组,根据病情选择肺段切除术或肺楔形切除术。(1)肺段切除术:经胸腔镜观察孔探明肺裂发育情况,针对肺裂发育良好者,由肺裂中分离肺段动脉,切除并结扎肺段动脉,分离出肺段支气管,切断并夹闭,解剖静脉,切断肺段静脉并结扎,切除预定肺段;针对肺裂发育不良者,首先探明肺叶静脉,后解剖出肺段静脉,结扎后沿其走向解剖肺实质,探明肺段动脉及支气管,并逐一分离后切除目标肺段;切除目标肺段过程中需注意,切缘应距肿瘤≥2cm,常规清扫淋巴结及肺门。(2)肺楔形切除术:经胸腔镜探明肿瘤部位,于肿瘤下方(距肿瘤约2cm)夹闭并触发切割吻合器,注意避免夹闭其他组织,进行楔形切除,对于未能完全切除者,可再次放置切割吻合器,彻底切除肿瘤,留置胸腔引流管。
1.4 观察指标 (1)比较两组手术相关指标(胸腔引流量、术中出血量、拔管、住院及手术时间)。(2)比较两组术前、术后6 个月肺功能指标[第一秒用力呼气容积(FEV1)、最大通气量(MVV)、第1s 用力呼气容积/用力肺活量(FEV1/FVC)],采用肺功能检测仪(型号:MSA99)检测,测前反复练习2~3 次,测定>3 次,取2 次最佳记录,记录间误差≤5%。(3)比较两组术后1年、3 年生存率(无瘤生存率、总生存率)。
1.5 统计学分析 采用SPSS22.0 对数据进行分析,手术相关指标、肺功能指标以±s)表示,采用t检验,术后1 年、3 年生存率以例(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较 观察组手术、拔管及住院时间较对照组短,术中出血量、胸腔引流量少于对照组(P<0.05)。见表1。
2.2 两组患者肺功能指标比较 术前两组MVV、FEV1/FVC、FEV1 水平比较无显著差异(P>0.05);术后6个月观察组MVV、FEV1/FVC、FEV1 水平高于对照组(P<0.05)。见表2。
2.3 两组患者术后1 年、3 年生存率比较 观察组术后1 年、3 年无瘤生存率、总生存率与对照组比较无显著差异(P>0.05)。见表3。
表1 两组患者手术相关指标比较(±s)

表1 两组患者手术相关指标比较(±s)
组别 n 手术时间(min) 术中出血量(mL) 胸腔引流量(mL) 拔管时间(d) 住院时间(d)观察组 41 113.56±10.08 148.36±13.08 124.36±13.51 3.16±0.64 7.22±1.24对照组 38 152.74±12.37 196.37±14.91 158.03±14.42 3.69±0.58 10.30±1.76 t 15.482 15.241 10.715 3.847 9.044 P<0.001 <0.001 <0.001 <0.001 <0.001
表2 两组患者肺功能指标比较(±s)
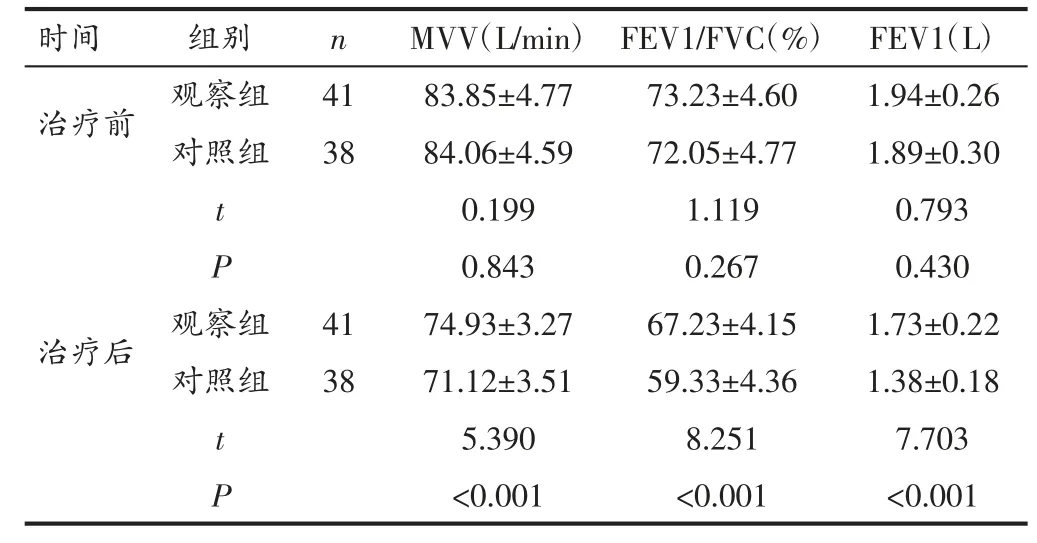
表2 两组患者肺功能指标比较(±s)
时间 组别 n MVV(L/min) FEV1/FVC(%) FEV1(L)治疗前 观察组 41 83.85±4.77 73.23±4.60 1.94±0.26对照组 38 84.06±4.59 72.05±4.77 1.89±0.30 t 0.199 1.119 0.793 P 0.843 0.267 0.430治疗后 观察组 41 74.93±3.27 67.23±4.15 1.73±0.22对照组 38 71.12±3.51 59.33±4.36 1.38±0.18 t 5.390 8.251 7.703 P<0.001 <0.001 <0.001
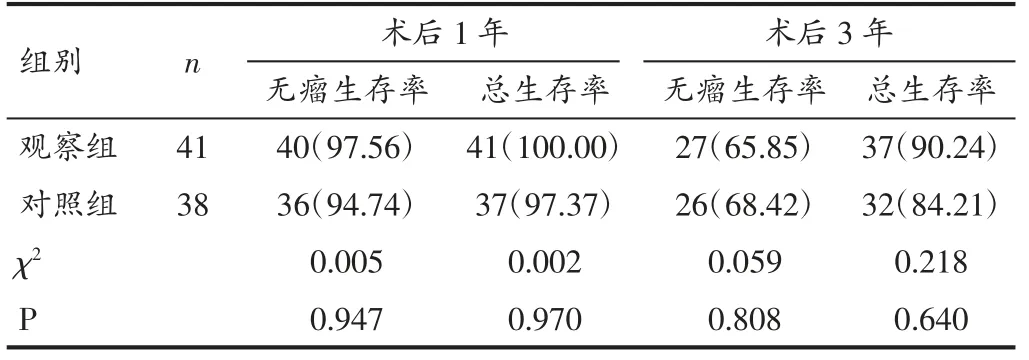
表3 两组患者术后1 年、3 年生存率比较[例(%)]
3 讨论
肺癌为临床常见恶性肿瘤之一,随着影像学技术不断发展及公众对健康体检重视度提高,早期NSCLC检出率不断提高。随着医学技术发展逐渐进入微创治疗时代,早期NSCLC 微创治疗主要包括两个方面,一方面利用电视辅助胸腔镜进行手术,另一方面尽可能减少原发病灶周围正常组织切除范围[4]。
胸腔镜下肺叶切除术通过对患侧全部肺组织进行最大限度切除,以达到治疗目的,术中利用胸腔镜可清除观察胸腔肿瘤情况,避免传统开胸手术造成肋间神经损伤,具有切口小、恢复快等优势[5]。目前临床提出治疗早期NSCLC 患者应在尽可能切除病变组织的同时,尽量保留正常肺组织。连爱民等[6]研究指出,胸腔镜下肺叶切除、亚肺叶切除治疗T1 期NSCLC 患者5年生存率比较无显著差异。本研究结果显示,观察组手术、拔管及住院时间短于对照组,胸腔引流量、术中出血量少于对照组,分析原因在于,胸腔镜下肺叶切除术需游离肺门静、动脉及支气管,出血风险较高,而亚肺叶切除术操作简单,手术用时较少,无需游离肺门动、静脉及支气管,可最大限度减少血管损伤。此外,亚肺叶切除术对正常肺组织切除面积小,手术创伤小,有助于减少组织渗液量,促进患者恢复健康。由本研究结果可知,术后6 个月观察组MVV、FEV1/FVC、FEV1 水平高于对照组,提示胸腔镜下亚肺叶切除术应用于早期NSCLC 患者,可保护患者肺功能。肺叶切除术术后,同侧残余肺叶膨胀造成支气管气道狭窄、角度改变,导致气道阻力增加、肺功能下井,而亚肺叶切除术正常肺组织得以最大限度保留,故可在一定程度保护患者肺功能[7-8]。此外,本研究还发现二者手术预后比较无显著差异,可见胸腔镜下亚肺叶切除术可在一定程度代替肺叶切除术。同时行亚肺叶切除术过程中应注意:(1)对于肺楔形切除术需确保切除边缘阴性,切除范围过小无法达到早期NSCLC 根治的目的[9]。(2)对于肺段切除术操作难点在于难以区分不同肺段,可于切除肺段支气管前,对肺段支气管进行临时夹闭,根据肺部膨胀情况区分需手术切除肺段区[10]。
综上所述,胸腔镜下亚肺叶切除术治疗早期NSCLC患者,可减少术中出血量,同时可保护患者肺功能,促进患者康复,预后良好,值得临床推广应用。
