AI联合rhGH对男性特发性矮小症患儿生长速率、骨密度及骨代谢的影响
2021-01-06宋靖荣董焱
宋靖荣,董焱
(上海交通大学医学院附属第九人民医院儿科,上海 200011)
特发性矮小症指不伴有生长激素水平异常儿童的身高低于正常同龄儿童的平均水平,但未合并机体潜在病理变化,具体发病机制尚不明确。有资料显示,发展中国家矮小症的发病率高达32.5%[1],其中特发性矮小症的发病率占所有矮小症的60%~80%,且呈逐年上升的趋势[2]。近年来有学者指出,特发性矮小症患儿可因身材矮小导致自卑心理而影响其社交能力[3],还可引起机体骨质减少、脂肪含量增加、肌肉含量下降,甚至增加心血管疾病的发生风险[4]。目前,临床上治疗特发性矮小症的药物主要有重组人生长激素(recombinant human growth hormone,rhGH)、促性腺激素释放激素类似物等,但rhGH的治疗受到骨骺闭合时间的限制,促性腺激素释放激素类似物在延缓骨龄进展的同时还可抑制患儿的性发育,治疗效果均不理想[5-6]。研究显示,芳香化酶抑制剂(aromatase inhibitor,AI)不仅可延缓骨龄进展,而且不会抑制性发育[7]。本研究主要探讨AI联合rhGH对男性特发性矮小症患儿生长发育、骨密度和骨代谢的影响,现报道如下。
1 资料与方法
1.1一般资料 选取2015年1月至2017年11月上海交通大学医学院附属第九人民医院儿科收治的48例男性特发性矮小症患儿作为研究对象,按照随机数字表法分为对照组和研究组,每组24例。研究组年龄8~14岁,平均(11.1±2.6)岁。对照组年龄8~14岁,平均(11.4±2.6)岁。两组患儿年龄比较差异无统计学意义(P>0.05)。本研究经上海交通大学医学院附属第九人民医院医学伦理委员会批准,所有患儿家属均签署了知情同意书。
1.2纳入与排除标准 纳入标准:①符合特发性矮小症的诊断标准[8];②骨龄正常或延迟;③生长速率低于每年4 cm;④生长激素峰值≥10 μg/L。排除标准:①合并有心、脑、肝、肾等重要器官功能障碍;②生长激素缺乏、垂体病变等导致的继发性矮小症;③合并内分泌代谢异常、先天性畸形、性早熟、染色体异常性疾病等;④入选前3个月有外源性维生素D、肾上腺皮质激素等影响本研究药物应用史;⑤处于青春发育期后。
1.3治疗方法 对照组每晚睡前皮下注射rhGH(长春金赛药业股份有限公司生产,批号:S20153003)0.15~0.20 U/(kg·d),连续治疗2年。研究组在对照组治疗基础上口服来曲唑(江苏恒瑞医药生产,批号:H16661001),每次1.5~2.5 mg,每日1次,连续治疗2年。
1.4观察指标 比较两组治疗前后身高、体质指数、生长速率、骨龄、骨密度以及骨代谢指标[骨钙素(osteocalcin,OC)、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)、骨碱性磷酸酶(bone alkaline phosphatase,BALP)、血清β-胶原降解产物(beta collagen degradation products,β-CTX)及Ⅰ型前胶原N端前肽(procollagen Ⅰ type N-terminal peptide,PINP)]水平。骨龄测定:拍摄左手腕骨平片,并由儿童保健科医师采用TW3评分法及2006版中国青少年儿童手腕骨成熟度评价软件评估患儿骨龄。骨密度测定:选取左胫骨中段,由儿童保健科医师采用定量超声骨密度仪[韩国Osteosys(奥斯托)公司生产]检测其传播速度及衰减程度,并计算骨质指数,即骨密度。骨代谢水平测定:采集外周静脉血5 mL,以离心半径15 cm,3 000 r/min离心5 min,留取上层血清,采用酶联免疫吸附法测定OC、IGF-1、BALP水平,采用电化学发光免疫分析法测定血清β-CTX、PINP水平。
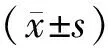
2 结 果
2.1两组治疗前后身高、体质指数、生长速率、骨龄、骨密度比较 治疗前后身高、体质指数、生长速率、骨龄、骨密度的主效应差异有统计学意义(P<0.05);不考虑测量时间,两组间身高、生长速率、骨龄的主效应差异有统计学意义(P<0.05),体质指数、骨密度的主效应差异无统计学意义(P>0.05);身高、生长速率、骨龄的时点间与组间存在交互作用(P<0.05),而体质指数、骨密度的时点间与组间不存在交互作用(P>0.05),两组治疗前后身高、生长速率、骨龄的变化幅度不同,观察组变化更明显。见表1。
2.2两组治疗前后骨代谢水平比较 治疗前后骨代谢(OC、IGF-1、BALP、β-CTX、PINP)水平的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组间OC、IGF-1、BALP、β-CTX、PINP的主效应差异无统计学意义(P>0.05);OC、IGF-1、BALP、β-CTX、PINP的时点间与组间不存在交互作用(P>0.05),见表2。
3 讨 论
特发性矮小症患儿的生长速率明显减慢,身高明显低于同龄儿童的平均水平,青春期生长延迟,但出生时身长在正常范围且无生长激素缺乏及遗传代谢性疾病等,发病机制尚不明确,多认为与生长激素敏感性较差、结合受体蛋白数量减少、基因突变等因素相关[9-10]。临床资料显示,由于家长对儿童身材矮小的重视不足,接受治疗的矮小症患儿仅为1%左右,且70%的患儿就诊时年龄已达11~16岁,严重影响患儿的成年身高[11]。相关研究证实,性激素可促进青春期后矮小症患儿的骨骺闭合,进而影响促生长药物的治疗效果[12],故矮小症患儿的早期诊断及治疗尤为重要。
相关研究显示,生长激素-IGF轴在调节儿童身高增长中具有重要作用,凡是影响该轴的因素均可影响儿童身高增长[13]。垂体前叶分泌的生长激素可通过自分泌或旁分泌形式作用于软骨细胞上的IGF受体,提高IGF基因的表达,促进位于骨骺生长板的前软骨细胞生长,加快骨骼生长[14]。部分学者指出,生长激素受体基因多态性引起的细胞内信号转录障碍可能是诱发特发性矮小症的主要原因[15]。rhGH由基因重组技术合成,近年来被广泛应用于特发性矮小症的治疗,可通过影响核酸代谢促使基因活化,调节生长激素分泌功能,提高生长激素的分泌,从而改善内源性生长激素分泌不足,起到促进软骨细胞增生及患儿生长发育的作用,且年龄越小骨骺软骨层增生分化程度越活跃,故特发性矮小症的治疗越早、持续治疗时间越长,治疗效果越好[16-17]。雌激素与雌激素受体结合可提高软骨细胞增殖、分化等活性,进而限制软骨的继续生长,促使骨骺闭合。芳香化酶可芳香化雄激素A环,促使雄烯二酮等雄激素转化为雌酮与雌二醇。而AI可竞争性结合P450酶亚单位血红素,阻断雄烯二酮和睾酮等雄激素向雌激素的转化,降低外周组织芳香化酶的活性,减少内源性雌激素的合成,抑制骨龄的增长,从而改善特发性矮小症患儿的成年身高[18-19]。林娟等[20]通过观察来曲唑对男童生殖及生长的影响发现,来曲唑作为一种AI,可抑制雌二醇对骨骼的作用效果,能够在延迟患儿骨龄增长的同时,促进患儿身高的线性生长,且治疗时间越长,促生长效果越明显。本研究结果显示,两组患儿治疗前后身高和生长的速率、骨龄的变化幅度不同,且观察组变化更明显。由此可见,AI联合rhGH的协同作用更有利于男性特发性矮小症患儿身高的生长,可明显改善患儿的骨龄提前。

表1 两组男性特发性矮小症患儿治疗前后身高、体质指数、生长速率、骨龄、骨密度比较

表2 两组男性特发性矮小症患儿治疗前后骨代谢水平比较
有研究证实,芳香化酶可通过提高护骨素水平,抑制破骨细胞活性,保护骨骼不被破坏,而服用AI可降低患者骨密度[21]。因此,可通过对比AI联合rhGH与单纯rhGH治疗对特发性矮小症患儿骨密度以及OC、IGF-1等骨代谢指标的影响,判断其疗效。骨密度可反映人体骨质中矿物质的含量,特别是青春期儿童,可反映儿童的生长状况;OC、BALP是骨形成的关键分子标志物,其水平能够特异性反映机体内成骨细胞的功能状态及骨骼的生长情况;IGF-1是生长激素刺激机体后产生的活性因子,为骨骼生长的原动力,能够促进生长激素的合成及分泌,并可与生长激素协同作用促进软骨细胞的增殖、分化,加快骨生长;β-CTX是Ⅰ型胶原降解过程中由C端肽α-天冬氨酸转变形成的异构体,与骨吸收程度呈正相关,可直接反映骨吸收程度;PINP为骨胶原蛋白合成产物,可直接反映成骨细胞的骨胶原合成活性,即骨形成状态。本研究中,两组治疗后OC、IGF-1、BALP、PINP、β-CTX水平比较差异无统计学意义,可见AI并未明显影响男性特发性矮小症患儿的骨代谢水平,且患儿的骨密度未明显降低。研究表明,OC作为骨依赖维生素K蛋白,能够有效促进骨矿化,且骨更新率越快,其血清水平越高;骨特异性碱性磷酸酶作为成骨细胞的细胞外酶,可通过增加骨骼中无机磷酸盐的水平参与骨矿化,促进成骨形成;IGF-1可促进骨细胞的分化、增殖,使成骨细胞维持于成熟状态。而补充外源性rhGH可通过直接刺激前软骨细胞向软骨细胞分化而表达IGF-1,也可刺激肝脏产生IGF-1,并通过血液循环将其转运至骨,进而发挥加快骨形成的作用,促使OC、BALP、PINP水平升高,且治疗期间骨形成明显大于骨吸收,有助于骨量累积,提高骨密度[22-23]。有报道指出,AI可抑制芳香化酶对骨的保护作用,提高破骨细胞活性[24],但本研究中,AI延迟骨骺闭合、抑制骨龄增长的作用更强,与rhGH协同作用后,对患儿骨密度与骨代谢的影响作用不明显。
综上所述,与单纯rhGH治疗相比,AI联合rhGH应用的协同作用更有利于男性特发性矮小症患儿的身高增长,可明显改善骨龄提前,且并未明显影响患儿的骨代谢水平及骨密度。
