骨组织工程在颅骨修补中的研究进展
2021-01-06侯晓峰周佳林李丹霞赵志军张春阳
侯晓峰,周佳林,李丹霞,赵志军,张春阳
(1.内蒙古科技大学包头医学院第一附属医院神经外科,内蒙古 包头 014040; 2.内蒙古科技大学包头医学院,内蒙古 包头 014010)
去骨瓣减压术可以有效缓解患者的高颅压,拯救了很多重型颅脑损伤患者的生命。然而,术后由于颅骨的缺失,颅脑易发生二次伤害,并可能出现脑组织缺血、缺氧、脑脊液循环紊乱等问题[1]。在术后稳定期,积极进行颅骨修补对于患者脑神经功能的恢复具有重要意义[2-4]。目前普遍认为,自体骨是临床颅骨修补的最佳材料[5-6]。但近年来自体骨的问题也逐渐显现,包括可用材料的有限性、骨吸收和建模困难等,因此急需寻找新的材料来替代自体骨。其他用于颅骨修补材料主要包括金属钛、骨水泥、聚乙烯以及聚醚醚酮等,虽然这些材料均已得到不同程度的应用,但也存在感染、免疫排斥、生物相容性差等一系列并发症,严重者甚至需要二次手术[7]。理想的颅骨修补方式应使缺损区恢复到近乎正常的生理状态和结构,而骨组织工程(bone tissue engineering,BTE)的出现使这一理想变成可能。BTE通过体外培养的方式将种子细胞移植到用于组织再生的支架材料上,并添加生长因子共同用于缺损区的修补。BTE不仅促进缺损区边缘新生骨的不断生长,同时复合材料也逐渐降解消失,最终缺损区完全再生,达到理想状态下的修复。而且用于BTE的材料是可制作、无限的,可以很好地解决自体骨保存困难、取材有限的问题,是一种优于自体骨的修补方式。现就BTE在颅骨修补中的研究进展予以综述。
1 支架材料
支架材料是BTE的主体成分,在BTE中起关键作用。目前支架材料大致可分为以下几类:①天然高分子材料,生物相容性好、免疫反应低,但是机械强度差,主要包括胶原蛋白、壳聚糖、纤维蛋白、透明质酸等;②人工合成高分子聚合物,主要优点为骨诱导能力强,但是这种材料亲水性差、细胞吸附能力低,且易诱发无菌性炎症,包括聚乳酸、聚乙醇酸和聚乳酸-乙醇酸[poly(lactic-co-glycolic acid),PLGA]聚合物等;③人工合成无机材料,具有生物相容性好和骨传导性能好的优点,但其骨诱导能力差,包括羟基磷灰石(hydroxyapatite,HA)和β-磷酸三钙[8-9]。
理想的支架材料应具备以下特点:①良好的生物相容性和生物活性;②可降解性且降解速率稳定,降解产物对人体无毒无害;③一定的力学强度;④易加工制备;⑤大小合适的孔隙结构以及分布均匀的高孔隙率,便于细胞附着和增殖。
目前在BTE应用于颅骨修补的研究中,由于单一的支架材料难以满足BTE的要求,常将其中两种或两种以上的支架材料进行复合后使用,以期提高效能,具体表现为以下几点。①提高成骨效能,Tebyanian等[10]分别将胶原蛋白/β-磷酸三钙与单纯胶原蛋白支架用以修补兔颅骨缺损,结果发现,胶原蛋白/β-磷酸三钙组颅骨缺损处再生更显著;②增加生物相容性,Ge等[11]将60只SD大鼠作为研究对象,随机分为硅灰石组、硅灰石-HA复合物组和HA组,结果显示,硅灰石组几乎无新骨形成,而相较于HA组的新骨形成,硅灰石-HA复合物组的新骨周围有更多的血管生成,且该组支架材料吸收降解部分与缺损边缘显示出良好的生物相容性;③降低炎症发生率,感染是支架材料降解过程中的常见问题,特别是使用天然高分子聚合物时降解产物的积累会引起宿主的炎症反应,进而影响其组织再生能力,这种炎症反应通常由先天性免疫系统细胞触发,包括树突状细胞、肥大细胞、粒细胞和巨噬细胞[12]。为了尽可能地减少炎症反应的发生,Li等[13]研究发现,PLGA的酸性降解产物堆积可诱导大量炎症细胞浸润,与单纯PLGA相比,将PLGA与明胶/纳米HA复合后,复合材料发生炎症反应的概率更低,原因可能为纳米HA呈碱性可缓冲PLGA降解产生的酸环境。另外,相同种类的复合支架也会表现出不同的骨诱导能力,Zhou等[14]将HA与白磷钙石分别制成HA/壳聚糖支架和白磷钙石/壳聚糖支架并植入大鼠的颅骨缺陷模型中,结果发现,白磷钙石/壳聚糖支架具有更好的生物相容性,间充质干细胞增殖更显著,成骨细胞分化能力更强。复合支架的制备很好地改善了单一支架骨诱导能力不足的问题,但与理想的支架材料相比仍有差距,为了进一步增加复合支架在颅骨修补中的骨诱导能力,加入某些微量元素可能缩小这种差距。
锌是人类成长过程中必不可少的微量元素,有助于骨骼系统的发育和生长。Wang等[15]将碳纳米管/壳聚糖作为支架修补大鼠颅骨缺损,共分为4组,其中3组分别添加0.2%、1%和2%的锌,另一组为未添加任何微量元素的空白组,X线及组织学分析显示,锌的添加显著促进了新骨的形成,且添加1%锌的碳纳米管/壳聚糖支架的成骨性能最佳,但由于锌离子的浓度设置梯度不均,对于促进骨再生的最佳锌离子浓度仍需探究。
2 种子细胞
种子细胞是BTE的重要组成部分,目前用于颅骨修补的种子细胞主要包括骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)、脂肪源性干细胞(adipose-derived stem cells,ADSCs)、肌源性干细胞(muscle-derived stem cells,MDSCs)、胚胎干细胞(embryonic stem cells,ESCs)以及诱导多能干细胞(induced pluripotent stem cells,iPSCs),各类种子细胞优缺点见表1[16-20]。理想的种子细胞应具备以下特点:①易于取材且来源丰富,对机体损伤小且免疫排斥反应少;②易于体外扩增,且具有定向分化为成骨细胞的能力;③易于成活,植入后在体内可以保持良好的成骨活性。
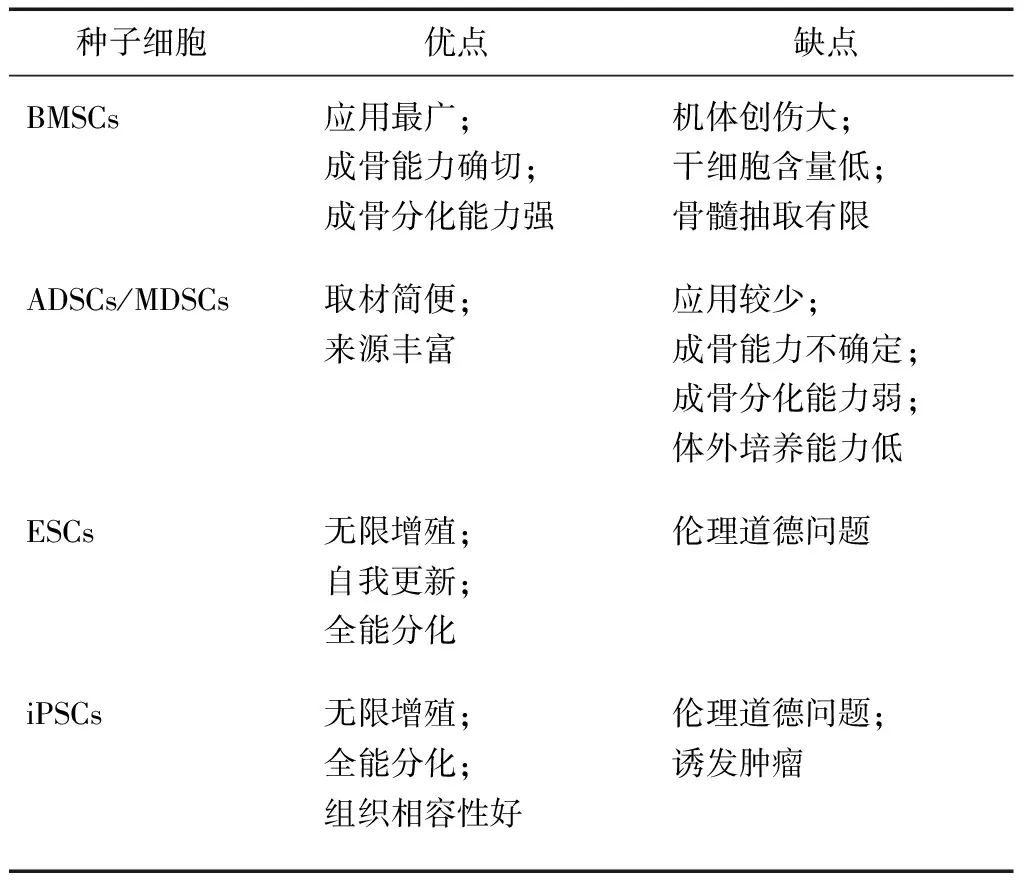
表1 各类种子细胞优缺点比较
2.1BMSCs BMSCs又称为骨髓基质细胞,是从少量的骨髓组织中分离所得,具有良好的骨诱导能力和多分化的潜能。BMSCs作为种子细胞已广泛用于BTE,且通过与支架材料复合,在成骨诱导方面具有良好的协同作用。Khadka等[21]将BMSCs植入纳米HA/聚酰胺6支架上,为临界大小的大鼠颅骨缺损进行修补,电子显微镜下观察发现,随着时间的推移,BMSCs从支架表面逐渐侵入到材料的孔隙,最后在支架内面大量增殖,促进了干细胞在毛孔内的分布,使支架具有了内外同时成骨的特性,加快了新骨形成,而且这种内外同时成骨的特性也改善了支架的生物力学性能。此外,干细胞培养方式的不同也会影响成骨性能,有研究发现,常规组织培养技术将间充质干细胞培养成二维单层,会破坏干细胞原有的体内微环境,而球状培养出的间充质干细胞具有更高的成骨潜能,具体表现为上调成骨基因和相关蛋白质水平,同时增加钙沉积,增强大鼠颅骨再生[22]。
近年来,对BMSCs进行修饰可进一步增强其成骨分化能力。Yu等[16]将降钙素基因相关肽转染后的人BMSCs作为种子细胞,与胶原蛋白支架结合用于大鼠颅骨修补,通过免疫组织化学法和免疫蛋白印迹实验检测相关成骨因子的表达,结果发现,与未转染降钙素基因相关肽组的人BMSCs相比,转染降钙素基因相关肽组的成骨标志物骨钙蛋白和骨形态发生蛋白(bone morphogenetic protein,BMP)-2水平均显著增高,这可能与一种神经纤维的标志物——蛋白基因产物9.5阳性有关。Moncal等[23]在miRNA与3D打印支架相结合治疗颅面重建的研究中发现,3D打印的胶原蛋白支架与miR-148b转染的人BMSCs结合,可以促进人BMSCs的早期分化,显著改善骨再生,使临界大小的大鼠颅骨缺损几乎得到了完全修复,表明用于转染的miRNA祖细胞在颅骨修补中具有潜在价值。
2.2ADSCs ADSCs作为种子细胞最大的优点在于取材简便,产出量大,可以解决BMSCs对机体创伤大、干细胞含量低、骨髓抽取有限的问题。Yoon等[24]将ADSCs与PLGA共聚物构建为复合体,12周后显示颅骨形成面积显著增加,说明ADSCs作为种子细胞对颅骨生长起重要作用。有学者对ADSCs的骨诱导能力进行了比较,认为在颅骨缺损修补方面BMSCs与ADSCs作为种子细胞差异无统计学意义[25]。然而,与BMSCs不同的是,ADSCs的成骨潜力主要依赖于外源性生长因子的存在[17],而且不同部位的ADSCs成骨能力也具有较大差异[26]。尽管人们对ADSCs的了解越来越多,但在临床上真正评估ADSCs的可用性还需要进行长期的研究。
2.3MDSCs MDSCs是近年来新发现的一种多能成体干细胞,与脂肪组织相似,是多能间充质细胞的另一来源,具有自我更新和多向分化的潜能,可被诱导分化为神经细胞、成骨细胞以及内皮细胞[18]。MDSCs作为种子细胞,已被证实可在临界大小的大鼠颅骨缺损模型中促进骨再生,特别是在植入外源性生长因子的情况下[27]。有研究将MDSCs与BMSCs分别置于同样临界大小的骨缺损中,6周后两组新生骨的体积和骨缺损覆盖率比较差异均无统计学意义,表明MDSCs与BMSC具有相近或相同的骨再生能力,是一种有发展前景的种子细胞[28]。Lough等[29]通过对BMSCs、ADSCs和MDSCs在小鼠颅骨缺损愈合中的比较分析,发现3种干细胞具有相似的成骨性能,且与BMSCs和ADSCs相比,MDSCs促进血管化的能力更强。除生长因子对MDSCs的促进作用外,性别也可能是影响成骨性能的因素。Scibetta等[30]在证实不同性别大鼠的MDSCs之间存在差异后,为了探究人MDSCs是否也存在性别差异,用BMP-2重组慢病毒载体/绿色荧光蛋白分别转染不同性别的人MDSCs,并将这些细胞移植到临界大小的小鼠颅骨缺损中,结果显示,男性人MDSCs组新生骨多于女性,且新生骨的密度显著高于女性。因此,在未来的BTE中,细胞的性别差异也是需要考虑的因素。尽管MDSCs已应用于颅骨修补,但与ADSCs和MDSCs相比,MDSCs的研究仍较少。
2.4ESCs ESCs是理想状态下最佳的种子细胞,具有无限增殖、自我更新和多向分化的特点,并且能够被诱导分化为人体的任何细胞。在动物颅骨缺损模型中已证实,人ESCs具有巨大的成骨潜力[19,31]。然而,由于ESCs取材涉及伦理道德的问题,对于ESCs的研究仍存在争议。单性生殖ESCs的出现能够避免ESCs的伦理问题,且在未来可能成为替代ESCs的干细胞来源[32]。
2.5iPSCs iPSCs是利用病毒载体转录因子转导进入分化的体细胞中,使其重编程而得到类似于ESCs的一类细胞,通过采用导入外源基因的方法使体细胞去分化为多能干细胞,具有潜在的无限增殖及多向分化的特征[20]。康明等[33]通过将iPSCs植入不同支架,比较iPSCs在大鼠颅骨缺损中的骨再生潜力并研究iPSCs在植入支架后的生物学活性和成骨作用,结果表明,iPSCs可以在新型增强复合材料支架上附着和增殖,且骨组织的修复效果较好。iPSCs可以很好地满足骨缺损修复过程中植入材料的生物学和成骨活性要求。同时,与其他种子细胞的成骨能力相比,iPSCs具有与人BMSCs相同的成骨潜能[34]。此外,iPSCs同样存在伦理问题,但最主要的问题为iPSCs具有形成畸胎瘤的风险,可导致动物模型发生极高的致残率,甚至死亡。Levi等[35]研究发现,添加生长因子后所营造的高成骨性微环境可有效降低畸胎瘤的发生风险。因此,将iPSCs应用于临床前需充分了解iPSCs存在的安全隐患,未来需通过更多的研究来解决这些问题。
3 生长因子
生长因子在BTE中主要起辅助作用,通过基因工程利用病毒或非病毒作为载体将生长因子转移到种子细胞上,以维持种子细胞的活性,促进成骨,并加快颅骨骨缺损区的血管化。目前用于颅骨修补的生长因子主要包括BMP、成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)以及血管内皮生长因子(vascular endothelial growth factor,VEGF)等,其中BMP诱导成骨能力强,但易发生炎症反应、 异位骨形成,甚至诱发肿瘤;FGF-2促进小动脉形成的能力较强,但其诱导成骨能力不确切,在体内半衰期也较短;VEGF主要促进毛细血管的形成,但VEGF剂量较高时会抑制成骨[36-39]。
3.1BMP BMP是转化生长因子-β蛋白家族的一员,具有较强的骨诱导活性,其中BMP-2在BTE中的应用最广,且BMP-2在颅骨缺损修复中的有效性也已得到深入研究[36,40-41]。但BMP-2在应用过程中也出现了很多不良反应,如炎症反应、异位骨形成甚至诱发恶性肿瘤形成。有研究发现,这些不良反应的发生与高剂量的BMP-2(>40 mg)有关[42-43]。高剂量的BMP-2常用于老年人的骨缺损,老年人随着年龄的增长以及机体对生长因子反应的降低,普通剂量的BMP-2难以达到原有的促进骨再生的能力。为了促进老年人骨缺损区生长,同时又避免发生高剂量BMP-2可能引发的不良反应,可将BMP-2与其他生长因子联合应用。有学者发现,低剂量FGF-2联合低剂量BMP-2的骨愈合能力优于BMP-2单独使用,同时降低了不良反应发生率,提高了生长因子利用的安全性[44-45]。同时,Reyes等[46]研究发现,基质金属蛋白酶10可以通过增强BMP-2促进骨愈合并提高矿化速率加速骨修复,认为基质金属蛋白酶10与BMP-2联用可能成为治疗颅骨缺损修复和促进再生的有效方法。另外,在BTE用于颅骨修补的过程中,作为同属于BMP家族的BMP-4[47-48]、BMP-6[49]、BMP-7[50-51]以及BMP-9[52-54]在动物颅骨缺损模型中也均表现出了良好的骨诱导能力,但关于各种BMP骨诱导能力的比较仍有待研究。
3.2FGF-2 FGF-2在BTE中的作用主要为促进种子细胞的增殖和分化,其也有诱导新生血管生成的能力,且主要倾向于小动脉的形成。Poudel等[37]研究发现,FGF-2可促进小鼠胚胎成骨细胞的增殖、矿化,在缺损区,与单纯可吸收胶原海绵组相比,装载FGF-2的胶原海绵可显著增强小鼠颅骨缺损区的骨愈合。Kwan等[55]研究发现,通过化学控制FGF-2的释放可以显著增加ADSCs在体内的增殖,从而促进颅骨缺损的愈合,这也为BTE的研究提供了一种新方法。另外,FGF-2在不同生物活性支架上诱导成骨细胞增殖分化的能力也不同。有学者将硅掺入HA支架后,FGF-2仍能保持对成骨细胞的生物活性,更重要的是,成骨细胞在混合支架上的黏附及增殖能力显著增强[56]。
3.3VEGF 颅骨缺损后骨愈合需要新生血管的滋养,多种生长因子可促进BTE的血管化,其中以VEGF重建血管的能力最强。血管既充当骨骼形成的结构模板,又提供骨骼中细胞外基质合成和矿化以及周转所需的必须细胞、生长因子和矿物质,是骨发育和修复的重要前提。VEGF通过调节血管生成,有助于骨与血管的偶合,并直接控制成骨细胞和破骨细胞的分化和功能[38,57]。Behr等[58]研究发现,VEGF分化为血管内皮细胞后,一方面可以诱导新生血管生成,另一方面可以通过间隙连接增加碱性磷酸酶活性和骨髓基质细胞的胶原合成,直接刺激骨祖细胞分化,促进成骨。同时,Behr等[59]对VEGF的促成骨能力进行了比较分析发现,在颅骨缺损模型中,VEGF与BMP-2在促进骨愈合方面具有相似的能力。且VEGF还能与其他生长因子协同,加快骨愈合的进程。Peng等[60]研究发现,BMP-4与VEGF在改善骨形成和骨愈合方面具有协同作用,其作用机制主要包括增强血管的生成、提高骨再生部位细胞的存活率以及增加间充质干细胞向骨骼形成和再生部位的聚集。另外,对于VEGF剂量的选择,需要注意的是,VEGF含量过高不仅会增加破骨细胞向骨再生位点的聚集,而且可导致间充质干细胞向内皮细胞谱系分化推进,减少可用于骨形成和成骨分化的细胞数量,进而导致骨骼形成受损[39]。因此,选择合适剂量的VEGF对于确保其促成骨作用并防止骨骼愈合中的有害反应至关重要。
4 问题与展望
BTE具有广阔的应用前景。对于支架的选择,复合支架具有成骨能力更强、生物相容性更好、炎症发生率更低的特点,弥补了单一支架的不足。在种子细胞方面,应首选成骨效果确切的BMSCs,且通过使用异体源性的干细胞可以解决BMSCs来源不足的问题,既避免了取材部位的损伤,又能获取大量的种子细胞,但需要注意异体细胞免疫排斥的问题。而ESCs随着生物技术的提高以及伦理学的突破,有望成为最理想的种子细胞。针对生长因子,BMP-2是目前公认的最强的骨诱导因子,但对于其释放方式的选择以及剂量的控制是未来需进一步改进。尽管BTE在颅骨修补方面取得了很大进步,大量的支架、种子细胞、生长因子已被用于动物颅骨缺损模型的研究,但BTE真正应用于临床还需要更多的实验与评估。同时,关于复合材料的降解、材料-骨组织界面结合相容性分析等颅骨修复过程中的问题也是急需考虑并解决的问题。相信随着研究的深入,未来BTE可普遍用于临床,为更多颅骨缺损患者提供帮助。
