丁香酚对维氏气单胞菌抑菌作用的研究
2021-01-06刘忠卓单晓枫靳胜男田佳鑫康元环钱爱东
刘忠卓, 单晓枫, 靳胜男, 田佳鑫, 张 伟, 康元环, 钱爱东
(1. 吉林农业大学动物科学技术学院, 吉林长春130118 ; 2. 吉林省图们市动物疾病预防控制中心, 吉林图们133100)
维氏气单胞菌(Aeromonasveronii)隶属气单胞菌科,气单胞菌属,是一种重要的人-兽-水生动物共患病原菌。该菌广泛存在于自然界水域及土壤当中,其中部分菌株致病能力较强,可引起鱼类等水生动物皮肤溃烂、脏器出血及腹腔积液等,严重时可造成大量死亡 ; 同时该菌还可感染人类,导致人类胃肠炎和菌血症等疾病[1]。近年来,有关维氏气单胞菌感染所引起的水产动物疾病频繁暴发,给水产养殖业造成了经济损失,但因养殖业者对抗生素药物的不合理应用,促使该致病菌产生了多重耐药性[2]; 此外,由于抗生素在养殖环境中不易消除,其不仅给水产品的质量安全带来隐患,而且还严重破坏生态环境。因此,寻求一种能替代抗生素且有效、安全的渔用药物对于水产养殖业至关重要。在替代抗生素的备选渔药中,中草药及其提取物显示出独特的优势,其具有抗病菌、抗病毒及改善水产品质量等作用,并具不易产生耐药性、环保及能提高水产动物免疫力等优点[3],越来越受到人们的关注,而从中草药中研制与开发新型的渔用药物也成为了水产防治疾病的一个新方向。
丁香酚(Eugenol)是丁香、月桂、樟脑等许多药用植物挥发油的主要成分,其是一种有机酚,常温下为微黄色的油状液体,在空气中易挥发且伴有强烈丁香气味,微溶于水,易溶于乙醇、二甲基亚砜(DMSO)等有机溶剂[4]。研究表明,丁香酚不但具有广谱的抑菌活性和杀菌活性,而且还具有一定的镇静麻醉、抗炎及抗氧化等功效[5]; 同时,由于其毒副作用小、不易残留等特点,有学者认为其有望成为一种新型的天然抑菌剂。通过体外试验发现,丁香酚对多种致病菌株均有一定抑制作用,如鳗弧菌(Vibrioanguillarum)[6]、嗜水气单胞菌(Aeromonashydrophila)[7]、金黄色葡萄球(Staphylococcusaureus)[8]等,但目前关于丁香酚对维氏气单胞菌抑菌作用的研究鲜有报道。本试验以维氏气单胞菌为供试菌,通过研究丁香酚对维氏气单胞菌的抑菌作用,以及丁香酚在低浓度下对该菌株生物被膜形成能力、运动性、脂肪酶活性及蛋白酶活性的影响来探讨丁香酚的抑菌机理,以期为丁香酚用于防治水产养殖细菌疾病提供研究依据。
1 材料与方法
1.1 试验菌株 维氏气单胞菌TH0426株(分离于患病的黄颡鱼体内),由吉林农业大学预防兽医学研究室保存。
1.2 主要试剂与仪器 丁香酚(纯度≥99%),购自上海麦克林生化科技有限公司;偶氮酪蛋白,购自美国Sigma-Aldrich公司;三氯乙酸、氢氧化钠,购自上海阿拉丁生化科技股份有限公司;DMSO、Tris-HCl缓冲液(pH 7.5)、PBS、吐温80、氯霉素溶液、结晶紫,均购自北京索莱宝科技有限公司;低温高速离心机,购自德国Sigma公司;全波长酶标仪,购自美国Thermo Scientific公司。
1.3 试验方法
1.3.1 菌液制备 将本实验室冻干保存的维氏气单胞菌接种至LB液体培养基中进行活化,采用无菌接种环蘸取活化后的菌液划线于RS固体平板中,28 ℃温箱中过夜培养;挑取板上生长的单菌落接种至含液体LB的10 mL试管中,28 ℃,180 r/min摇床中培养12 h后,采用平板菌落计数法计算菌液浓度,并将其梯度稀释至1×106~1×109CFU/mL,于4 ℃中保存备用。
1.3.2 抑菌活性的测定 抑菌活性的测定参考文献[6]所述方法并略作改进。称取6.4 mg丁香酚溶于DMSO中,并用LB液体培养基配置成质量浓度为6 400 μg/mL的母液以备用,后续试验所需系列浓度均以此母液稀释配置所得。吸取200 μL浓度为1×108CFU/mL的菌液均匀涂布于固体LB平板中,用无菌的牛津杯在平板上打3个孔再对其封底。待底部凝固后,向1号孔中加入150 μL丁香酚母溶液,2号孔中加入150 μL的1% DMSO溶液为溶剂对照,为比较分析丁香酚与维氏气单胞菌敏感性抗生素的抑菌差异性[9],向3号孔中加入150 μL质量浓度为200 μg/mL的氯霉素溶液为对比试验,随后将平板置于28 ℃温箱中培养24 h。待培养结束后,利用游标卡尺测量抑菌圈直径并记录数据。每次试验设置3组重复,试验重复3次。抑菌效果参照文献[10]中的标准判定,即抑菌圈直径>20 mm为极度敏感;15~20 mm为高度敏感;10~15 mm为中度敏感;<10 mm为低度敏感。
1.3.3 最低抑菌浓度(MIC)的测定 根据微量二倍稀释法[11]检测丁香酚对维氏气单胞菌的最低抑菌浓度。预先于96孔培养板中加入100 μL浓度为1×106CFU/mL的菌液,试验组加入100 μL丁香酚使其每孔的终浓度依次为3 200、1 600、800、400、200、100、50 μg/mL和25 μg/mL,空白对照组加入100 μL不含丁香酚的LB液体培养基,溶剂组则加入100 μL 的1% DMSO,每组均设3个重复孔,充分混匀,置于28 ℃温箱中培养24 h,利用全波长酶标仪测定OD600值从而确定丁香酚的MIC值。试验重复3次。
1.3.4 最小杀菌浓度(MBC)的测定 采用琼脂扩散法测定丁香酚对维氏气单胞菌的最小杀菌浓度。从上述96孔板培养的菌悬液中各取100 μL培养物,接种至无菌的LB平板上,28 ℃温箱培养24 h,待培养结束后根据各平板中细菌的生长情况以判定 MBC值。
1.3.5 生长曲线的测定 吸取浓度为1×108CFU/mL的菌液,将其按1%比例接种至含丁香酚(终浓度分别为800、400、200、100、50 μg/mL和25 μg/mL)的LB培养基中;同时设置培养基内不添加丁香酚的空白对照组与添加等量1% DMSO的溶剂组,28 ℃、180 r/min摇床中震荡培养24 h,期间每隔2 h取样1次,利用酶标仪测定其在OD600值并记录,以细菌培养的时间为横坐标,OD600值为纵坐标,绘制生长曲线图。试验重复3次。
1.3.6 生物被膜形成能力的测定 参照Tan等[12]所用的96孔板法检测菌株生物被膜形成能力并适当改进,具体操作如下:将浓度为1×109CFU/mL的菌液按1%比例接种至含丁香酚(终浓度依次为200、100、50、25、12.5 μg/mL)的LB液体培养基中,同时设置空白对照组及1% DMSO的溶剂组,充分混匀并吸取200 μL的混合液于无菌的96孔培养板中,每组均设3个重复孔,置于28 ℃温箱中培养24 h。待培养结束后,吸净孔中的液体,用无菌的PBS缓慢清洗3次后,置于温箱中晾干;待晾干后,每孔加入200 μL的甲醇溶液固定20 min,吸弃甲醇,室温晾干15 min;待干燥后,每孔加入1%结晶紫染液200 μL,染色30 min,弃去染液,用无菌双蒸水清洗3次,每孔200 μL,吸弃双蒸水后,轻甩培养板至其干燥。待完全干燥后,向各孔中加入200 μL的33%冰醋酸溶液并充分混匀,静置10 min后用酶标仪测定其OD575值,以判定菌株的生物被膜形成能力。试验重复3次。
1.3.7 运动性的测定 参考文献[13]所述方法并略微调整,高压灭菌含0.3%琼脂的LB培养基,待培养基冷却至50 ℃后,试验组加入丁香酚使其终浓度分别为200、100、50、25、12.5 μg/mL和6.25 μg/mL,溶剂组加入等量的1% DMSO,空白对照组则为不含丁香酚的LB培养基,轻轻摇匀并倒入相同规格的平板,试验中为排除培养基体积所产生的误差,需将培养基在试管中配置(20 mL/管)。待培养基凝固以后,分别吸取2 μL浓度为1×107CFU/mL的菌液接种至培养基表面,28 ℃温箱培养24 h,培养期间平板勿晃动,待培养结束后测量各菌落直径,菌落直径大小与细菌运动能力呈正相关。试验中每个浓度设3个重复,试验重复3次。
1.3.8 脂肪酶活性的测定 根据Yang等[14]所述方法,检测丁香酚对维氏气单胞菌脂肪酶活性的影响。高压灭菌含1.5%琼脂和含1%吐温80的LB培养基,待其冷却至50 ℃后,试验组加入丁香酚(药物浓度同1.3.7),溶剂组加入等量的1% DMSO,同时设置空白对照组,轻轻混匀后并倒入平板。待凝固后,吸取2 μL浓度为1×107CFU/mL的菌液接种至平板正中央,28 ℃温箱静置培养48 h,待培养结束后分别测量各组中菌落直径和其外圈沉淀环直径,外圈沉淀环直径与菌落直径的比值即为脂肪酶活性的大小。试验中每个浓度设3个重复,试验重复3次。
1.3.9 蛋白酶活性的测定 蛋白酶活性的检测结合文献[15]的方法并稍作改进。吸取浓度为1×107CFU/mL的菌液按1%比例接种至含丁香酚(终浓度依次为200、100、50、25、12.5 μg/mL和6.25 μg/mL) 的LB液体培养基中;同时设置空白对照组及1% DMSO的溶剂组,28 ℃,180 r/min摇床中培养36 h后收集培养物。将培养物于4 ℃,12 000 r/min 离心30 min,吸取上清液,并经0.22 μm 微孔滤膜过滤除菌以获得胞外产物。分别吸取150 μL上述不同组的产物于2 mL的无菌EP管中,向管中加入1 mL的0.3%偶氮酪蛋白溶液,而后用旋涡振荡器混匀再置于37 ℃水浴锅中培养30 min,待培养结束后立即向管中加入10%的三氯乙酸溶液500 μL以终止反应,室温下静置10 min 后,于4 ℃下离心10 min,吸取上清液100 μL转接到96孔板中(每组均设3个重复孔),最后向各孔中加入1 mol/L的氢氧化钠溶液100 μL,于酶标仪中震荡10 s后读取其OD400值。试验重复3次。
1.4 数据统计 本试验所得数据利用软件SPSS Statistics 20进行统计分析,最终结果以“平均值±标准差”方式表示,并使用单因素方差分析和Duncan新复极差法在P=0.05水平上进行显著性检验。
2 结果
2.1 丁香酚对维氏气单胞菌的抑菌活性 抑菌活性的试验结果如中插彩版图1所示,当丁香酚质量浓度为6.4 mg/mL时,其抑菌圈的直径为(20.32±0.8) mm(1号孔,极度敏感);1% DMSO溶液无抑菌圈产生(2号孔,不敏感),这也表明以DMSO溶液作为丁香酚的助溶剂对其抑菌效果无影响;对照组氯霉素溶液的抑菌圈直径为(30.85±0.78)mm(3号孔,极度敏感)。
2.2 丁香酚对维氏气单胞菌的最低抑菌浓度(MIC) 由酶标仪检测溶剂组(DMSO)和空白对照组(Contol)的OD值无显著差异(P>0.05)可知,溶剂组的菌体生长状态和空白对照组基本无差别,因此,可忽略丁香酚的助溶剂(1% DMSO)对维氏气单胞菌生长的影响。当丁香酚浓度大于400 μg/mL时,28 ℃下培养24 h后,孔中培养液仍澄清透明,即维氏气单胞菌没有生长,因此,丁香酚对维氏气单胞菌的MIC为400 μg/mL(图2)。

图2 丁香酚对维氏气单胞菌的最低抑菌浓度Fig.2 Minimum inhibitory concentration of eugenol against Aeromonas veronii注:不同小写字母表示组间差异显著,P<0.05;下图同Note:Different lowercase letters mean significant difference among groups,P<0.05. The same as below
2.3 丁香酚对维氏气单胞菌的最小杀菌浓度(MBC) 通过最小杀菌浓度试验发现,当丁香酚浓度为800 μg/mL时,维氏气单胞菌在平板中不生长,而丁香酚浓度为400 μg/mL时,其在板中生长状态良好。根据《食品中抗菌药物残留的化学分析》[16],以无菌落生长的最低药物浓度为最小杀菌浓度(MBC),因此丁香酚对维氏气单胞菌的MBC为800 μg/mL。
2.4 不同浓度的丁香酚对维氏气单胞菌生长曲线的影响 生长曲线的测定结果显示,溶剂组(DMSO)与空白对照组(Contol)生长曲线基本重合,二者在生长能力上无显著差异(P>0.05)。当丁香酚浓度小于50 μg/mL,其对维氏气单胞菌的生长无显著影响(P>0.05),此时菌株的生长趋势同空白对照组,它们具有相似的迟缓期、对数期及稳定期;丁香酚浓度大于100 μg/mL时,其显著抑制了维氏气单胞菌的生长(P<0.05),此时菌株的生长速率较空白组而言相对减缓,且在稳定期时的OD值明显下降;丁香酚浓度大于800 μg/mL时,维氏气单胞菌不生长(见中插彩版图3)。
2.5 丁香酚对维氏气单胞菌生物被膜形成能力的影响 结合酶标仪所测OD575值,对菌株生物被膜形成量比较分析发现,当丁香酚浓度大于100 μg/mL时,其显著抑制了维氏气单胞菌生物被膜的形成(P<0.05);丁香酚浓度小于50 μg/mL时,其显著促进了维氏气单胞菌生物被膜形成(P<0.05),且丁香酚浓度越低,促进作用越明显(图4)。
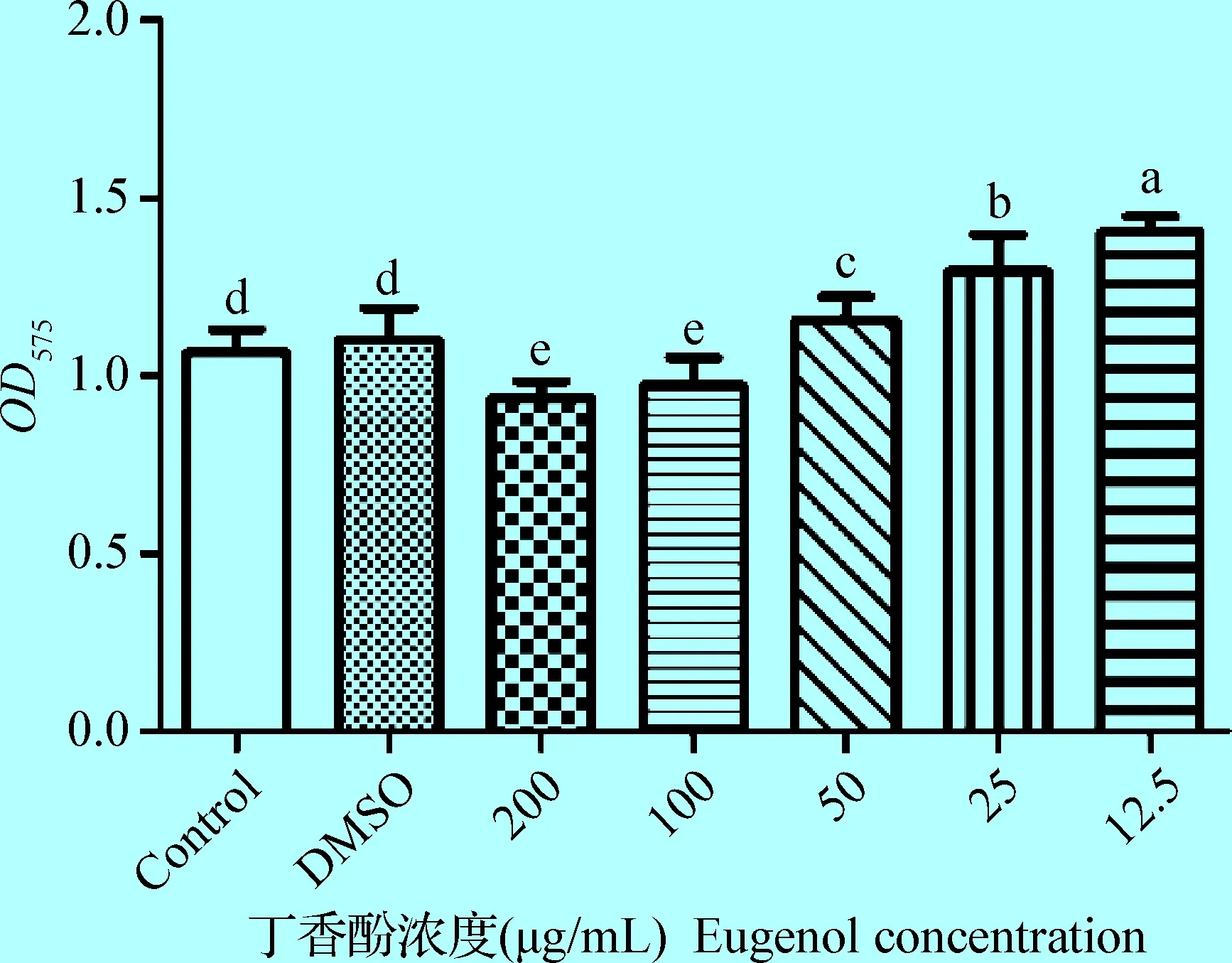
图4 丁香酚对维氏气单胞菌生物被膜形成的影响Fig.4 Effects of eugenol on biofilm formation of Aeromonas veronii
2.6 丁香酚对维氏气单胞菌运动性的影响 在运动性试验中,通过测量菌落直径可得知,当丁香酚浓度大于25 μg/mL时,其显著抑制了维氏气单胞菌的运动性(P<0.05),且丁香酚浓度越高,抑制作用越显著;丁香酚浓度小于12.5 μg/mL时,其对维氏气单胞菌的运动性无显著影响(P>0.05,图5)。
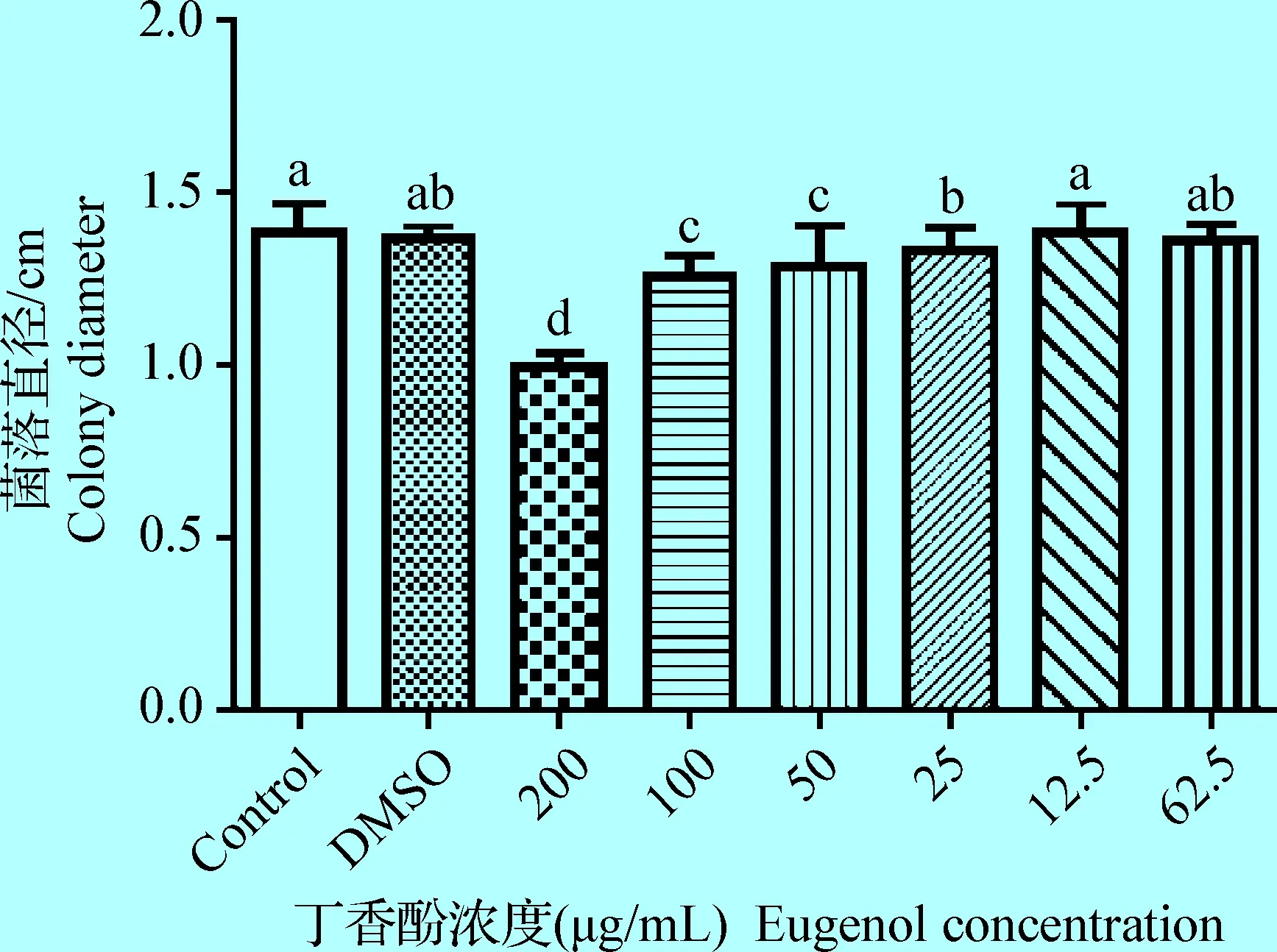
图5 丁香酚对维氏气单胞菌运动性的影响Fig.5 Effects of eugenol on the motility of Aeromonas veronii
2.7 丁香酚对维氏气单胞菌脂肪酶活性的影响 利用含1%吐温80的LB板对脂肪酶活性进行检测时发现,当丁香酚浓度为200 μg/mL时,其显著抑制了维氏气单胞菌的脂肪酶活性(P<0.05);丁香酚浓度小于100 μg/mL时,其对维氏气单胞菌的脂肪酶活性无显著影响(P>0.05,图6)。
2.8 丁香酚对维氏气单胞菌蛋白酶活性的影响 蛋白酶活性的检测结果显示,不同浓度的丁香酚均可显著性地抑制维氏气单胞菌的蛋白酶活性(P<0.05),当丁香酚浓度为200 μg/mL时,其对维氏气单胞菌蛋白酶活性的抑制作用最明显(图7)。

图6 丁香酚对维氏气单胞菌脂肪酶活性的影响Fig.6 Effects of eugenol on the lipase activity of Aeromonas veronii
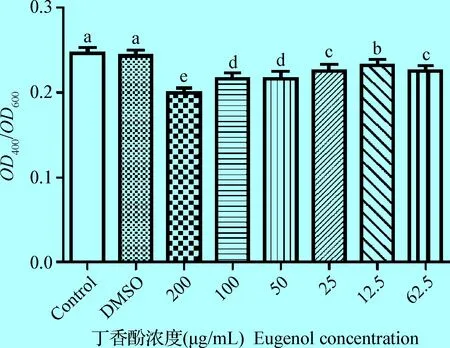
图7 丁香酚对维氏气单胞菌蛋白酶活性的影响Fig.7 Effects of eugenol on the protease activity of Aeromonas veronii
3 讨论
随着水产养殖环境的不断恶化,水产养殖病害愈发严重,因此大量的抗生素类药物被广泛用于防治水产致病菌。然而,抗生素类药物在初次使用时效果极佳,但随着普遍地用药以及药量的加大会致使病原菌产生耐药性;此外由于抗生素在环境中可持久残留,其还给水产品及水体质量造成影响,因此,寻找一种安全无毒且不易产生耐药的抗菌药物以治疗水产病原菌具有重要意义。近年来,中草药及其提取物被用于水产动物病害防治的报道不断出现,并且作为后抗生素的使用逐渐得以替代,因此颇受研究学者的重视。丁香酚作为一种天然无污染的植物提取物,因其抑菌效果好、安全性高、绿色环保等优势而备受关注。
本试验通过丁香酚对维氏气单胞菌的抑菌试验发现,当丁香酚质量浓度为6.4 mg/mL时,维氏气单胞菌对丁香酚表现为极度敏感,即该浓度的丁香酚对该致病菌具有良好的抑菌作用。MIC及MBC试验结果表明,丁香酚对维氏气单胞菌TH0426株的MIC值为400 μg/mL、MBC值为800 μg/mL,而Bandeira等[11]研究发现,丁香酚对银鱼源维氏气单菌的MIC和MBC分别为800 μg/mL和1 600 μg/mL,其与本试验结果不相同,因此我们认为丁香酚对于不同来源菌株的抑菌效果也会有所不同。生长曲线的测定结果显示,丁香酚对维氏气单胞菌的生长有抑制作用,而且其对菌株的抑制作用呈现出浓度依赖性,当丁香酚浓度大于100 μg/mL时,菌株生长相对缓慢,并且其迟缓期的时间相对延长,这说明丁香酚有效地抑制了维氏气单胞菌的生长。现有研究表明,丁香酚通过作用于细菌细胞内的酶活性或功能蛋白,影响细胞代谢,从而抑制细菌生长[8];还有研究认为丁香酚通过破坏细菌的细胞膜而达到抑菌效果[17],鉴于目前有关丁香酚抑菌机理的说法尚未统一,所以其作用机理还有待进一步探究。
研究表明,维氏气单胞菌的致病性强弱与其分泌、表达的多种毒力因子密切相关,如外毒素、粘附因子(菌毛、鞭毛)、胞外产物(脂肪酶、蛋白酶)等[18],而细菌在侵袭、感染宿主的过程中往往需要多种毒力因子相互协同发挥致病作用。鉴于高浓度的抑菌药物对细菌耐药的选择压力大[19],因此,本试验开展了低浓度的丁香酚对维氏气单胞菌生物被膜形成能力、运动性、脂肪酶活性及蛋白酶活性等毒力作用的试验,拟通过丁香酚干扰维氏气单胞菌致病能力,从而起到防控该致病菌感染的目的。生物被膜是细菌在繁殖过程中,免受抗菌药物及宿主免疫应答反应的一种保护形式。通过测定菌株的生物被膜时发现,当丁香酚浓度大于100 μg/mL 时,其能有效地抑制维氏气单胞菌生物被膜的形成,而丁香酚浓度小于50 μg/mL时,其能有效促进菌株生物被膜的形成,而我们认为丁香酚是通过抑制菌株的生长,进而抑制其生物被膜的形成;前期通过测定生长曲线时发现,当丁香酚浓度小于50 μg/mL时,其对菌株的生长无影响,所以该浓度范围内,丁香酚对其生物被膜并不产生抑制作用,但其是如何刺激菌株生物被膜的形成,具体机制尚未清楚,仍需进一步研究。运动性试验结果表明,丁香酚浓度大于25 μg/mL时,其能有效地降低维氏气单胞菌的运动能力,通过文献得知[18]鞭毛可介导气单胞菌的运动能力,所以猜测丁香酚可能是破坏了菌株的鞭毛结构从而导致其运动能力大幅降低。胞外产物是病原菌的重要致病因子,其通过降解宿主的蛋白质、多糖、脂质等引起宿主组织损伤,从而利于病原菌入侵宿主体内发挥致病作用。通过丁香酚作用于维氏气单胞菌的脂肪酶和蛋白酶的试验,结果发现其脂肪酶和蛋白酶的活性均有降低,与空白对照组相比,尤其是蛋白酶活性有显著差异。综上所述,我们初步预判丁香酚作用机理是其通过影响细菌中的粘附因子、胞外产物等一些毒力因子,从而起到抑菌作用。
综合本试验结果可知,丁香酚对维氏气单胞菌具有一定的抑菌和杀菌效果,而且低浓度的丁香酚对该菌株的部分毒力因子具有抑制作用,但其抑制作用有限;然而考虑到药物在发挥抑菌作用时,不是单纯地作用于病原菌,其对水产动物本身也具有一定影响,所以恰当的药物浓度对于防控细菌的感染至关重要,而低浓度的丁香酚能否用于防治水产维氏气单胞菌,仍需应用于实际生产中以验证效果。本试验所得结果,可供丁香酚在渔业生产上的应用提供参考,并为丁香酚在渔业生产中制定给药方案、合理用药提供一定理论依据。
