149株布鲁氏菌病原快速诊断方法的评价
2021-01-06台锦阁汪定成邵海连郭鹏娟陈静文
台锦阁,汪定成,杨 铭,邵海连,苏 博,郭鹏娟,陈静文,董 轲
近年来,我国人兽共患病不断增多,尤其以布鲁氏菌病最为显著。该病患者临床表现复杂多样,无临床特征性,容易造成漏诊和误诊,给临床诊断带来棘手问题。目前,布鲁氏菌病的诊断方法主要分为病原学检测和血清学诊断,前者其准确率高,不易漏诊,是布鲁氏菌检测的“金标准”;后者因为存在交叉抗原及采集标本不合格等原因会造成假阳性诊断结果[1]。此外,布鲁氏菌对人体的致病力极强,易导致实验室获得性感染[2]。因此,确保实验室安全的情况下,快速准确鉴定布鲁氏菌显得尤为重要。本文就布鲁氏菌实验室快速鉴定的方法进行探讨,现报道如下。
1 材料与方法
1.1仪器 法国梅里埃BACT/ALERT3D240全自动细菌培养系统及配套的培养瓶、荷兰Mart Anoxomat Mark Ⅱ厌氧培养系统、含溶血素厌氧培养瓶、美国Forma Class Ⅱ台式生物安全柜、美国BD BECTEC FX全自动血培养仪、泰斯特SPX-150B Ⅲ生化培养箱、奥林巴斯CX21显微镜。
1.2试剂 哥伦比亚血琼脂培养基、麦康凯培养基及巧克力培养基(购自郑州安图生物技术有限公司)、美国BD BECTEC FX全自动血培养仪配套的树脂需氧培养基。
1.3菌株采集 149株布鲁氏菌(剔除同一病号)分离自本院2014年1月至2019年9月临床的血液、骨髓、关节腔液、引流液、脑脊液等标本。经无菌操作将3~10 mL标本接种于血培养仪配套的培养瓶中,经全自动血培养仪扫描识别后直接放进培养仪进行检测。
1.4实验室快速鉴定方法 首先将所采集标本进行血培养,根据阳性瓶报警时间和观察细菌生长曲线对细菌进行初步判断,如果阳性报警时间较长且生长曲线有明显的“布鲁氏菌”曲线特征,则高度怀疑为布鲁氏菌;再用注射器抽取所怀疑血培养瓶中的样本,一部分用于涂片并进行革兰染色,瑞氏染色和石碳酸复红单染,然后观察显微镜镜下形态,与此同时,另一部分转种血平板、巧克力平板及麦康凯平板,并于35 ℃恒温箱中培养18~24 h,观察细菌生长情况,并进行触酶,氧化酶,尿素水解试验,根据镜检的“布鲁氏菌”特征形态及生化反应结果为2 h内尿素水解阳性,氧化酶、触酶均为阳性则可确诊为布鲁氏菌。
2 结 果
2.1布鲁氏菌病患者的统计情况 临床分离的149株布鲁氏菌,其中男性占110株,女性占39株,年龄分布在1~81岁,儿童占3株。该病患者最常见的临床表现是发热,典型病例表现为波状热,常伴有寒战等症状;其次是多汗,布鲁氏菌病急性患者出汗尤重,可湿透衣裤、被褥等;还有一些患者表现为全身肌肉和多发性、游走性大关节疼痛;少数患者会出现脊柱(腰椎为主)骨关节疼痛、畸形和功能障碍等。本文所涉及到的149例患者中,143株患者有明确的牛羊接触史,4株有吃牛羊肉或者喝生牛羊奶的情况,2株有犬类接触史。
2.2布鲁氏菌阳性报警时间 布鲁氏菌的阳性报警时间远远大于其他细菌,因此可以通过阳性报警时间对细菌类型做出初步判断[3]。本文中149株布鲁氏菌在血培养仪上阳性报警时间为58.9~124.3 h,均值为73.8 h。具体分布时间见表1。
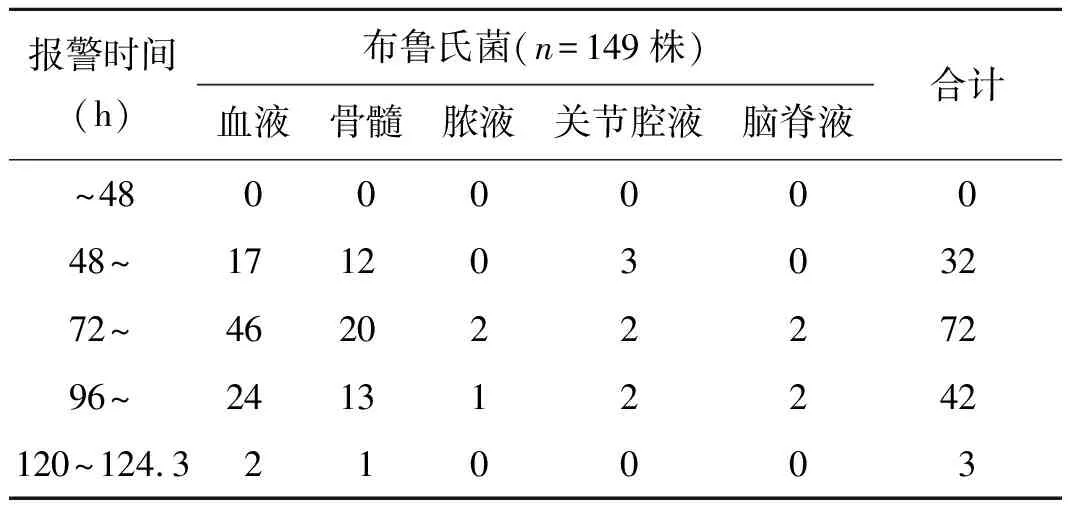
表1 来源于不同标本的布鲁氏菌在全自动血培养仪中阳性报警时间(株)
2.3布鲁氏菌生长曲线 细菌在血培养瓶中的生长繁殖过程可划分为迟缓期、生长期和稳定期3个过程,布鲁氏菌是专性需氧菌,生长缓慢。布鲁氏菌血培养生长曲线如图1所示,其特征为迟缓期曲线较平坦,生长期曲线短且幅度小,稳定期曲线平坦。图2和图3分别为大肠埃希菌生长曲线和金黄色葡萄球菌生长曲线,其与布鲁氏菌血培养生长曲线有明显的区别。
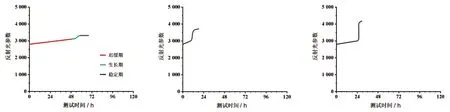
图1 布鲁氏菌生长曲线 图2 大肠埃希菌生长曲线 图3 金黄色葡萄球菌生长曲线
2.4细菌学和生化功能鉴定 镜检:革兰染色镜下发现呈片状的革兰阴性小球杆菌,染色很弱,不易观察;瑞氏染色镜下可见紫色的小球杆菌单个或成堆或像细沙样;石碳酸复红单染镜下可见红色的小球菌成泥沙样,其镜下染色图片分别为图4、图5、图6(放大倍数均为10×100),不同染色方法所观察到的布鲁氏菌分别如图中箭头所示。接种的平板在35 ℃恒温箱中培养18~24 h,血平板及巧克力培养平板上生长出针尖大小的菌落类似一层血膜,延长培养到72 h,生长出较小、灰色、圆形、突起、边缘整齐且不溶血的大小相同的菌落,麦康凯平板上无菌落生长,其生化反应结果为2 h内尿素水解阳性,氧化酶、触酶均为阳性。
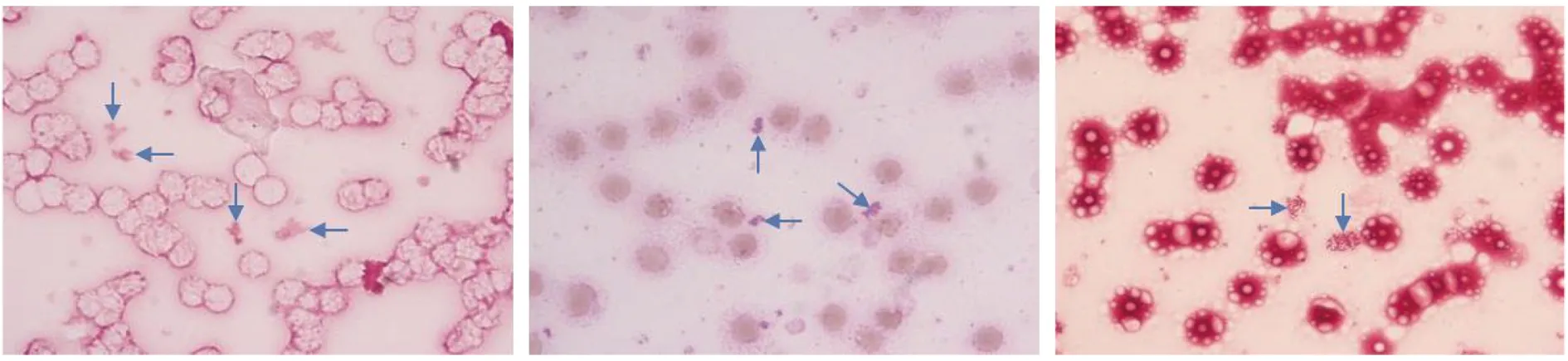
图4 布鲁氏菌革兰染色 图5 布鲁氏菌瑞氏染色 图6 布鲁氏菌石碳酸复红单染
3 讨 论
布鲁氏菌病,是由布鲁氏菌属细菌引起的人兽共患病,是全世界范围的动物源性传染病[4]。布鲁氏菌病的发生、发展和转归比较复杂,其临床表现多种多样,很难以某一种症状来确诊,临床医生多因发热考虑菌血症,送检血液培养和骨髓培养,部分实验室因经验不足,未能培养鉴定出细菌,造成漏诊。目前,布鲁氏菌病确诊实验方法主要有布鲁氏菌培养鉴定、试管凝集试验(SAT)、补体结合试验(CFT)、抗人免疫球蛋白试验(Coomb′s)和聚合酶联反应等[5],但是布鲁氏菌培养鉴定和试管凝集试验(SAT)是最常见的诊断方法。其中,试管凝集试验(SAT)不属于临床实验室常规开展的方法,而是由疾病控制中心开展的项目,常用于流行病调查研究。临床科室一般通过细菌培养鉴定为布鲁氏菌后,运送标本至疾病控制中心进行试管凝集试验(SAT)复检。
因此,实验室目前诊断布鲁氏菌最可靠的方法还是以细菌培养为主,该法通常在血培养瓶报阳后进行接种,常规培养72 h左右,待有灰白色菌落生成后进行生化鉴定[6]。而本文所采用的是对细菌培养方法进行优化后的方法,其主要特点在于血培养瓶报阳后,直接取一部分样品进行革兰染色和石碳酸复红单染,由于布鲁氏菌属于革兰阴性小型球杆菌,经革兰染色该菌呈细沙样且细胞壁不易被碱性复红复染,着色较淡不易被发现,分离的149例布鲁氏菌中85例镜下革兰染色阴性,未能明显看见细菌,经验不足的人员不易分辨。但经石碳酸复红单染,镜下明显可见樱红色的小球菌成泥沙样排列,提示有细菌存在,结合革兰染色和石碳酸复红单染的染色结果,高度怀疑为布鲁氏菌;与此同时,取另一部分样品接种培养18~24 h,随后通过生化反应进行鉴定,缩短了报告时间。因而本文所述方法较常规细菌培养方法相比更加快速。值得注意的是,本文无法参考标准菌株进行鉴定,因为根据《中华人民共和国动物防疫法》规定,布鲁氏菌病为乙类传染病,其标准菌株在国内没有购买途径。本文所涉及到的布鲁氏菌都是通过凝集实验和基质辅助激光解吸电离飞行时间质谱来进行验证的。
本文中的149株布鲁氏菌以血液和骨髓标本来源为主,分别为89株和46株,有少量标本来源于关节腔液,极少量存在于脓液和脑脊液中。在149株布鲁氏菌中,有两株临床反馈的结果为阴性,该两名患者否认牛羊接触史和食用未熟的肉制品、奶制品,但有饲养犬类,临床科室按照布鲁氏菌病治疗方案对患者进行治疗,病情明显好转,则可判断为犬布鲁氏菌感染。造成SAT凝集结果为阴性的最主要原因可能是由于犬布鲁氏菌属于粗糙型菌,不适合用光滑型菌SAT抗原检测,即由于抗原表位的不同,布鲁氏杆菌可以表现为SAT阴性[7-9]。此外,也不排除可能受采样及血清中抗体浓度的影响等[6]。SAT凝集方法对产生症状的急性感染患者更加敏感,但对于慢性患者很容易造成漏诊,比如Sanodze等人研究发现该方法在布鲁氏菌病的早期诊断中其灵敏度很低[10-11]。同时,对于流行区患者,由于高背景抗体效价等原因,会出现假阴性,因此,可能存在多种因素导致该方法对布鲁氏菌病诊断的准确率并没有本文所述的方法高。
综上所述,本文所采用的实验室布鲁氏菌诊断方法的准确率高,快速且具有较高的生物安全性,说明了病原学诊断在一定程度上优于血清学诊断。
利益冲突:无
