云南省埃及伊蚊对拟除虫菊酯类抗性群体的击倒抗性基因突变分析
2021-01-06兰学梅杨明东姜进勇
兰学梅,杨明东,杨 锐,姜进勇
埃及伊蚊(AedesAegypti)是新入侵云南的蚊虫,2002年首先在瑞丽市姐告口岸被发现[1],其入侵、定殖和扩散能力强,目前已成为云南省景洪市、勐腊县、瑞丽市和耿马县孟定镇的优势蚊种[2],云南省2013年来多次登革热疫情暴发地均有埃及伊蚊分布,是云南省登革热的重要传播媒介[3-5]。媒介控制是登革热疫情处置的主要措施之一,瑞丽、景洪、勐腊和耿马等地主要使用各种卫生化学杀虫剂进行空间喷洒(超低容量喷雾和热烟雾)结合滞留喷洒,来迅速杀灭成蚊从而控制登革热疫情。各地疫情处置过程中,长期、大量使用拟除虫菊酯类杀虫剂进行灭蚊控制,埃及伊蚊可能对菊酯类杀虫剂产生了不同程度的抗药性[6]。因此,2016年以来,本课题组先后测定了云南省瑞丽市、景洪市、勐腊县、勐海县和耿马县等登革热重点地区的埃及伊蚊成蚊对几种拟除虫菊酯类杀虫剂的敏感性,结果证实均存在不同程度抗药性[7]。为进一步研究其产生抗性的机制,本研究在以往研究的基础上,收集上述5个种群的埃及伊蚊野生种群成蚊,在生物测定拟除虫菊酯类杀虫剂(氯菊酯和高效氯氟氰菊酯)敏感性的基础上,检测其对应kdr基因突变情况,用于丰富我省埃及伊蚊群体kdr基因突变数据,为探讨分子检测结果与生物测定结果之间的关联性提供科学依据。
1 材料与方法
1.1供试蚊虫来源 2016-2018年,在云南省景洪市、勐腊县、勐海县、瑞丽市和耿马县(东、南、西、北和中)5个片区,采集埃及伊蚊的幼虫和蛹(均采自疫点及其周围室内外花瓶、水桶、泡菜坛、饮水机水槽、轮胎及其他废弃容器等)。羽化和鉴定[8]后,饲喂鼠血(豚鼠,产地:普洱),分类饲养繁殖至子一代(F1),进行对杀虫剂的生物学测定。随即进行埃及伊蚊成蚊对3.20%氯菊酯和0.08%高效氯氟氰菊酯的抗药性测定(药膜由中国疾病预防控制中心传染病预防控制所提供),实验结果均为抗性。24 h后死亡和存活样本单管单只分别收集,并置于75%乙醇中保存。
1.2kdr基因扩增及电泳 收集的埃及伊蚊按照试剂盒(购自天根生化科技(北京)有限公司)说明书,提取单蚊基因组DNA。参照文献[9]合成引物,扩增1 016和1 534两个位点的突变情况。各引物的PCR反应体系相同:包含2×Taq预混液12.5 μL,10 μmol/L,非特异性正反引物各1.0 μL,特异性内引物1.0 μL,DNA模板2.0 μL,加双蒸灭菌水至 25.0 μL。反应条件为:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72℃ 1 min,35个循环;72 ℃延伸7min。扩增产物经1.5%琼脂糖凝胶电泳检测后,观察电泳条带大小。V1016G等位基因检测中,M2-For和M2-Rev为非特异性外引物,用于大片段扩增(592 bp);特异性内引物M2-V和M2-G扩增片段长度为348 bp(仅有V,敏感纯合子;仅有G,抗性纯合子;VG并存,抗性杂合子)。F1534C等位基因检测中,M3-For和M3-Rev为非特异性外引物,用于大片段扩增(517 bp);特异性内引物M3-F和M3-C扩增片段长度为284 bp(仅有F,敏感纯合子;仅有C,抗性纯合子;FC并存,抗性杂合子)。见图1。

图1 埃及伊蚊钠离子通道击倒抗性基因AS-PCR检测示意图
1.3数据分析 运用SPSS20.0统计软件进行统计分析,采用χ2检验分析kdr各基因突变型间的相关性,检验水准为α=0.05。
2 结 果
采集自景洪市、勐腊县、勐海县、瑞丽市和耿马县5个地区,共计580份雌性埃及伊蚊样本被用于V1016G和F1534C击倒抗性突变的检测。5个重点地区埃及伊蚊均发现有V1016G和F1534C突变存在,其中,V1016G的突变率为99.83%(579/580),5个地区V1016G的突变率都较高,除了瑞丽市为99.26%外,其余突变率均为100%。F1534C的突变率为46.38%(269/580),5个地区F1534C的突变率分别为84.16%(85/101)、67.80%(80/118)、49.17%(59/120)、28.89%(39/135)和5.66%(6/106)。V1016G和F1534C突变率差异存在统计学意义(χ2=421.338,P=0.000),V1016G的突变率高于F1534C(表1)。
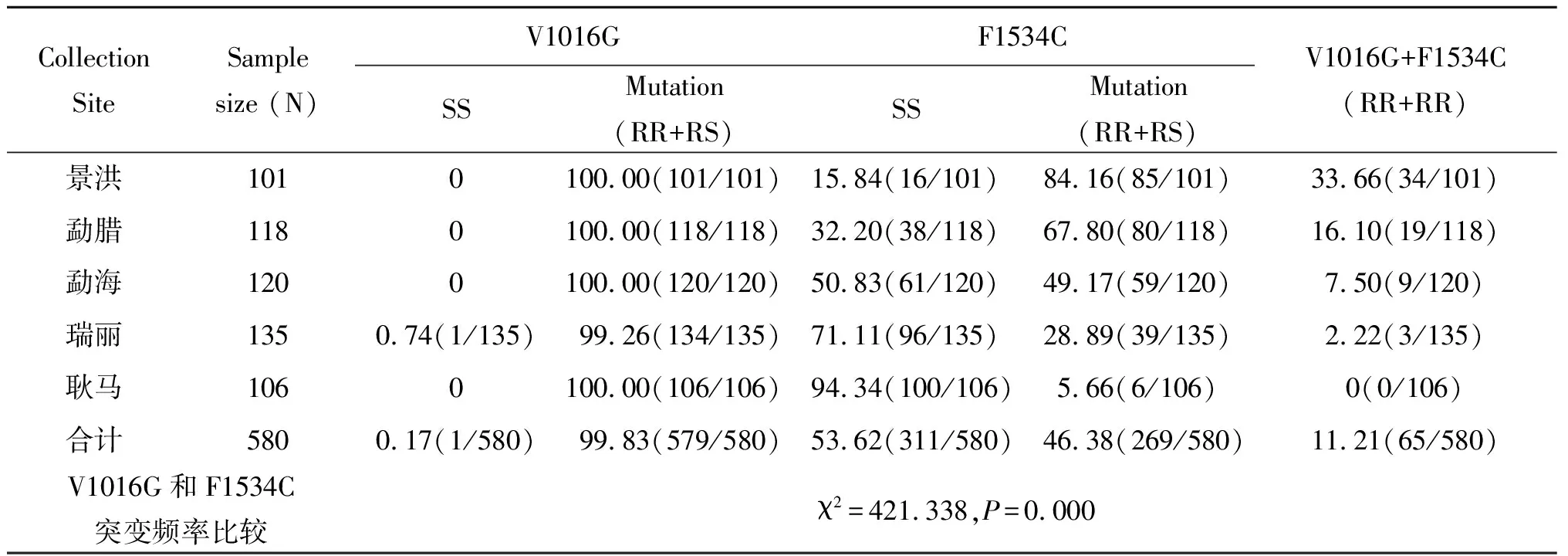
表1 云南省埃及伊蚊对菊酯类杀虫剂基因突变率(%)测定
2.1不同杀虫剂V1016G和F1534C突变的比较 埃及伊蚊对氯菊酯抗性的样本检测了273份,V1016G和F1534C突变率分别为100.00%(273/273)和50.92%(139/273)。对氯菊酯的V1016G和F1534C突变率进行比较,差异存在统计学意义(χ2=177.583,P=0.000);埃及伊蚊对高效氯氟氰菊酯抗性的样本检测了307份,V1016G和F1534C突变率分别为99.67%(306/307)和47.62%(130/273)。对高效氯氟氰菊酯V1016G和F1534C突变率差异存在统计学意义(χ2=209.802,P=0.000)(见表2、3)。
对氯菊酯和高效氯氟氰菊酯的V1016G突变率进行比较,差异无统计学意义(χ2=0.891,P=0.345);对氯菊酯和高效氯氟氰菊酯的F1534C突变率进行比较,差异有统计学意义(χ2=4.268,P=0.039)(表2、3)。

表2 云南省埃及伊蚊击倒抗性基因突变频率测定
2.2不同地区V1016G和F1534C突变的比较 采用χ2检验,5个地区1 016位点的基因突变率进行比较,差异无统计学意义(χ2=3.302,P=0.509);5个地区1 534位点的基因突变率进行比较,差异有统计学意义(χ2=167.383,P=0.000)。进一步进行景洪市与其他4个地区1 534位点的基因突变率进行两两比较,其中景洪和勐腊、勐海、瑞丽、耿马比较的统计结果分别为:χ2=7.842,P=0.005;χ2=29.578,P=0.000;χ2=70.778,P=0.000;χ2=129.365,P=0.000。

表3 不同杀虫剂V1016G和F1534C突变率比较
2.3抗性表型与敏感表型V1016G和F1534C突变的比较 5个地区埃及伊蚊野生群体对氯菊酯和高效氯氟氰菊酯进行抗药性测定后,实验存活个体定义为抗性表型,实验死亡个体定义为敏感表型。抗性表型样本检测510份,V1016G和F1534C突变频率分别为100.00%(510/510)和49.02%(250/510);敏感表型样本检测70份,V1016G和F1534C突变频率分别为98.57%(69/70)和72.86%(51/70)。抗性表型与敏感表型的V1016G突变率进行比较,差异有统计学意义(χ2=7.298,P=0.007);抗性表型与敏感表型的F1534C突变率进行比较,差异有统计学意义(χ2=14.010,P=0.000)。
2.4V1016G和F1534C位点同时纯合子突变 580份样本中,有65份样本同时存在V1016G和F1534C位点纯合子突变,突变率为11.21%;不同地区同时突变率范围为0%~33.66%,景洪同时突变率最高为33.66%,瑞丽最低,本次实验耿马未发现同时存在纯合子突变(表1)。
3 讨 论
击倒抗性(knockdown resistance,kdr)是引起蚊虫对拟除虫菊酯类杀虫剂产生抗性的机制之一,埃及伊蚊电压门控钠离子通道(voltage-gated sodium channel, VGSC)上很多位点已被研究检测出来,但仅有少数位点突变被证实与抗性相关[10-11],如埃及伊蚊不同抗性群体,VGSC基因突变的密码子有3个(I1011M/V、V1016G/I和F1534C)与DDT和菊酯类杀虫剂抗性相关。
本次研究景洪、勐腊、勐海、瑞丽和耿马的埃及伊蚊存在V1016G和F1534C突变,V1016G的突变以抗性纯合子(RR)突变为主,与师灿南[12]2015年对景洪市城区埃及伊蚊的检测结果一致,缅甸[13]和泰国[14]也发现相似的突变。然而,Sebastien Marcombe等2014年在老挝埃及伊蚊中发现存在V1016G和F1534C突变,以F1534C突变占主导地位,突变率高达96%,而V1016G存在低水平的突变,突变率仅为36%[15],Hitoshi Kawada等报告越南V1016G突变率更低,仅为0.26%[16]。存在不同的原因可能是入侵云南埃及伊蚊与老挝和越南不是同一来源,或是各国使用的杀虫剂种类、时间和数量不一致,尚需进一步分析和研究。通过两种杀虫剂V1016G突变率和5个不同抗性种群V1016G突变率的比较看出,差异均无统计学意义,进一步证实V1016G突变广泛存在于对拟除虫菊酯类杀虫剂产生抗药性的埃及伊蚊中。Han-Hsuan Chung等研究发现台湾地区的埃及伊蚊S989P和D1763Y突变均与V1016G并发。S989P和V1016G并存[17-18],以及D1763Y和V1016G同时并存[19]。至于云南的埃及伊蚊中是否存在上述现象,尚需进一步研究。
5个地区埃及伊蚊的1 534位点均发生了基因突变,且不同地区埃及伊蚊的突变率存在明显的差异,以景洪最高为84.16%,耿马最低为5.66%。原因可能是每个地区杀虫剂的种类、数量和使用年限不同所致,也可能与不同地区埃及伊蚊对拟除虫菊酯类杀虫剂的抗性程度不同有关,需检测不同地区埃及伊蚊对杀虫剂的抗性程度类进行证实。本研究中,抗性表型与敏感表型V1016G和F1534C突变率均存在差异,两种位点的突变均以抗性表型的突变率较高,与其他研究者的结论一致[20-21]。证实V1016G和F1534C突变与埃及伊蚊对拟除虫菊酯类杀虫剂产生抗性具有相关性,是引起杀虫剂抗性的机制之一。
多个位点突变同时存在的情况下会导致埃及伊蚊对拟除虫菊酯类杀虫剂产生更高水平的抗性[13],泰国埃及伊蚊中G1016和C1534 同时突变对溴氰菊酯抗性有相加作用。台湾地区的埃及伊蚊中发现同时存在S989P/V1016G/F1534C或V1016G/F1534C/D1763Y的3个杂合突变的显现[22],结果对杀虫剂具有较高的抗性。云南埃及伊蚊1 016和1 534位点突变同时为抗性纯合子(RR)的频率为11.21%(65/580)远远高于老挝埃及伊蚊(4/1 076,0.37%)[17]。景洪市同时突变为抗性杂合子的频率最高为33.66%。可能与不同地区埃及伊蚊对杀虫剂产生的抗性程度不同有关。至于不同位点三重杂合突变的现象是否具有协同效应,有待研究。
我省登革热重点地区埃及伊蚊野外群体存在V1016G和F1534C突变,V1016G突变广泛存在,F1534C突变以景洪埃及伊蚊种群为最高,且两种突变同时存在也是景洪的埃及伊蚊种群最高,从分子生物学的角度证实了景洪市广泛使用和不受控制地频繁使用光稳定的拟除虫菊酯可能是该突变的强大选择压力,埃及伊蚊对拟除虫菊酯类杀虫剂已经产生了高度抗性,应注意杀虫剂的合理选用。我省登革热高发地区,应定期进行蚊虫生物学测定、代谢酶活性和击倒抗性基因突变检测,从而能够根据分子检测结果预测蚊虫的抗性水平,时时掌握抗性发生发展动态,最终实现对蚊虫种群抗性的“分子监测”。
利益冲突:无
