成釉细胞瘤细胞抑制骨髓间充质干细胞成骨分化的研究
2021-01-06武和明
雷 港,武和明,江 飞
成釉细胞瘤(ameloblastoma,AM)是一种临床常见的牙源性良性肿瘤,虽归属于良性肿瘤,但呈现浸润性生长、易复发、易恶变,具有恶性肿瘤的性质[1]。约占颌骨肿瘤的14%[2],在发展中国家发病率相对更高[3]。目前临床上对于成釉细胞瘤的治疗主要采用手术切除病变颌骨[1]。由于该病起病症状不明显,进展缓慢,往往发现临床症状时已造成大范围颌骨缺损。切除大块病变颌骨后的重建修复则成为临床难题[4]。
对解决临床上大块骨缺损再生的难题,目前已有多种策略,包括自体骨移植、异体骨移植[5],以及基于组织工程原理的骨再生手段[4]。已有研究表明,血管化骨再生的过程与缺损区域中干细胞的自噬(autophagy)水平密切相关[6]。自噬是指细胞内有“自己吃自己”的现象,通过溶酶体降解长半衰期蛋白及受损细胞器,将降解产物循环再利用[7],从而保持细胞内的能量平衡,抵御缺氧、饥饿、衰老等压力及降解有害胞质成分和入侵的细菌病毒等[8-11]。自噬作为细胞内物质循环再利用过程的组成部分,在清除干细胞自我更新、增殖和分化过程产生的废弃蛋白及细胞器中起到重要作用[12-14]。成釉细胞瘤是否会影响成骨相关干细胞的自噬水平,如果影响成骨相关干细胞的自噬水平,可能直接关系到切除病变组织后的骨再生效果。本研究通过收集成釉细胞瘤患者切除的肿瘤组织,分离成釉细胞瘤细胞(human ameloblastoma-derived cells, hAMCs)[15],收集hAMCs条件培养液与正常人骨髓间充质干细胞(human bone-marrow mesenchymal stromal cells, hBMSCs)共培养,观察hBMSCs自噬水平和成骨相关表型,进而间接分析成釉细胞瘤影响骨再生的相关机制,为成釉细胞瘤患者切除病灶术后的骨再生提供优化策略。
1 材料与方法
1.1 主要试剂
α-MEM培养液、胎牛血清、胰蛋白酶、Ⅰ型胶原酶、双抗(青霉素/链霉素)(均购自Gibco,美国) ,CCK-8试剂盒(Dojindo,日本),二甲基亚砜(dimethyl sulfoxide,DMSO)(分析纯,Ameresco,美国),碱性磷酸酶染色试剂盒(建成,中国) ,碱性磷酸酶活力检测试剂盒(中生,中国),茜素红染色液(Sigma,美国),RIPA蛋白裂解液(碧云天,中国广州),SDS-PAGE凝胶试剂盒(凯基,中国),蛋白Marker(Fermentas,美国),SuperSignal®West Pico化学发光底物(Thermo,美国),细胞角蛋白18(Cytokeratin,CK-18)、波形蛋白(Vimentin)、E钙黏蛋白(E-Cadherin)抗体(Bioworld,美国),核心结合蛋白因子2 (Runt-related transcription factor 2, RUNX2)、碱性磷酸酶(Alkaline phosphatase,ALP)、 成骨转录因子(Osterix,OSX)、骨涎蛋白(Bone sialoprotein, BSP)、骨钙素(Osteocalcin,OCN)、骨桥蛋白(Osteopontin,OPN)、Ⅰ型胶原(Type Ⅰ collagen,Collagen Ⅰ)、微管相关蛋白1轻链(Microtuble-associated protein light chain 3,LC3b)、自噬相关蛋白6同源物(Autophagy related 6 homolog, Beclin1)、自噬相关蛋白5同源物(Autophagy related 5 homolog,ATG5)抗体(Abcam,英国),甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(Bioworld,美国),山羊抗兔IgG二抗(中杉金桥,中国)等。
1.2 实验方法
1.2.1 hBMSCs的培养 hBMSCs购自广州赛业生物科技有限公司,细胞增殖至80%~90%,使用0.25%胰蛋白酶消化传代,扩增培养至P3代用于后续实验。
1.2.2 hAMCs的分离和培养 取成釉细胞瘤组织,置于4 ℃无血清α-MEM 培养液(含200 U/mL青霉素及200 μg/mL链霉素)中移入超净台。用含有200 U/mL青霉素及200 μg/mL链霉素的PBS漂洗3次,每次3 min。将组织剪成1~2 mm3大小后移入含1 g/L Ⅰ型胶原酶的α-MEM 培养液中,37 ℃孵箱内消化4 h,每半小时震荡15 s。当组织块呈絮状时停止消化,1 200 r/min离心5 min,去上清液,加入PBS重悬漂洗3次,细胞计数,以1×106个细胞接种于细胞培养瓶内,加入含10% FBS的α-MEM完全培养基,置于37 ℃,5% CO2饱和湿度的培养箱内,每2~3 d换液。细胞增殖至80%~90%消化传代,P1及P2代细胞用于后续实验。
1.2.3 成釉细胞瘤条件培养液(hAMC-CM)制备 待细胞生长融合至70%后,每天换液置换出来的培养液以3 000 r/min离心15 min,收集上清,用孔径为0.22 μm的小滤器过滤,加入等量的含10% FBS的α-MEM完全培养基制成条件培养液(hAMC-CM)备用。
1.2.4 CCK-8检测 制备hBMSCs单细胞悬液以1 000个/孔接种于96孔板中,细胞贴壁后用无血清α-MEM培养液饥饿处理24 h后换用α-MEM完全培养基及hAMC-CM条件培养基培养(每组设5个复孔),隔天换液,连续培养1、3、5、7、9 d。在每个时间点,根据CCK-8试剂盒操作步骤检测各组样品的吸光度值(450 nm波长)。3次重复实验后,统计分析。
1.2.5 碱性磷酸酶活性检测和染色 将hBMSCs制备成单细胞悬液以1×104个/孔接种24孔板中,待细胞贴壁后更换无血清α-MEM培养液饥饿处理24 h,换α-MEM完全培养基及hAMC-CM条件培养基培养(每组设3个复孔),隔天换液,3、5 d后依据试剂盒操作说明进行碱性磷酸酶活性检测及染色。
1.2.6 茜素红染色 将hBMSCs制备成单细胞悬液以5×104个/孔的细胞密度加在12孔板中待细胞贴壁后换无血清培养基,饥饿处理24 h后分别加入α-MEM完全培养基和hAMC-CM条件培养基配置的成骨诱导液(每组设3个复孔),隔天换液,连续培养2周后按照染色试剂盒操作说明进行染色。扫描仪记录染色结果后用10%氯化十六烷基吡啶(CPC)溶液溶解染色结节,检测各组吸光度值(560 nm波长),记录并作统计分析。
1.2.7 Western blot检测 用RIPA蛋白裂解液及细胞刮棒收集培养7 d的P0和P2代hAMCs细胞蛋白,利用Western blot方法检测上皮组织或间充质来源的细胞特异性标志蛋白CK-18、Vimentin以及E-Cadherin的表达量,用以鉴定不同代数培养的hAMCs的细胞来源。收集在成骨诱导过程中用α-MEM完全培养基和hAMC-CM条件培养基培养7 d的hBMSCs细胞蛋白,用Western blot方法检测成骨分化相关蛋白ALP、RUNX2、OSX、BSP、OPN、OCN以及Collagen Ⅰ的表达情况,用以检测条件培养液对成骨作用的影响。类似的,收集不同培养基培养7 d的hBMSCs细胞蛋白,用Western blot方法检测自噬相关蛋白ATG5、Beclin1以及LC3b的表达,用以分析条件培养液对hBMSCs成骨分化过程中自噬行为的影响。实验重复3 次。Image J分析各组条带的灰度值。
1.3 统计学方法
采用SPSS 20.0软件进行独立样本t检验、单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 hAMCs的培养鉴定及扩增
通过组织块结合Ⅰ型胶原酶消化法获得混合生长的hAMCs,其中可以观察到能相互共存的呈上皮样生长的细胞群体以及呈成纤维细胞样生长的细胞群体,细胞生长状态良好,且随着培养时间的持续,这些细胞群体可以持续增殖并融合(图1A)。原代培养的hAMCs中上皮样细胞(epithelial cell-like hAMCs, E-hAMCs)占据较多的生长空间而通过传代培养后细胞的上皮样群体逐渐萎缩,成纤维细胞样群体(mesenchymal cell-like hAMCs, M-hAMCs)逐渐占据生长优势,但均可发现两种细胞的存在。通过Western blot实验我们发现P0代和P2代细胞均可表达上皮和间质细胞的标志蛋白,但在P0代hAMCs中上皮细胞来源的标志蛋白CK-18和E-Cadherin表达强度强于P2代hAMCs,而间充质细胞来源的标志蛋白Vimentin的表达却弱于P2代hAMCs(图1B),这与我们细胞培养过程中观察到的现象一致。

A:原代培养的成釉细胞瘤细胞包括上皮样及成纤维样细胞群落;B:P0和P2代成釉细胞瘤细胞的来源鉴定;C:hAMC-CM培养hBMSCs后的细胞形态照片;D:CCK-8检测hBMSCs增殖曲线
2.2 hAMC-CM对hBMSCs形态及增殖的影响
加入hAMC-CM的hBMSCs细胞形态与常规α-MEM完全培养基培养的hBMSCs细胞形体没有区别,均呈梭形漩涡状生长且生长状态良好(图1C)。通过CCK-8试剂盒检测发现hAMC-CM及α-MEM培养的hAMCs在前2 d均增殖稍慢,第3天进入快速生长期,第7 天左右增殖放缓进入平台期,整体生长曲线近“S”型,各时间点增殖指标无统计学差异(P>0.05),说明hAMC-CM对hBMSCs的增殖状态没有影响(图1D)。
2.3 hAMCs-CM对hBMSCs早期成骨能力的影响
hAMCs-CM及α-MEM培养基配制的成骨诱导液培养hBMSCs 5 d后,固定细胞ALP染色发现加入hAMC-CM后hBMSCs的ALP染色强度较α-MEM单纯培养组弱(图2A)。而分别培养3、5 d后,ALP活性检测结果显示单纯培养组明显高于条件培养液组,且培养5 d的ALP活性高于3 d组,各组间均有统计学差异(P<0.05)(图2B)。通过Western blot实验发现成骨早期的转录因子蛋白RUNX2、OSX以及成骨蛋白ALP在加入hAMC-CM后表达均有不同程度的下调,灰度值分析具有统计学差异(P<0.01)(图2)。
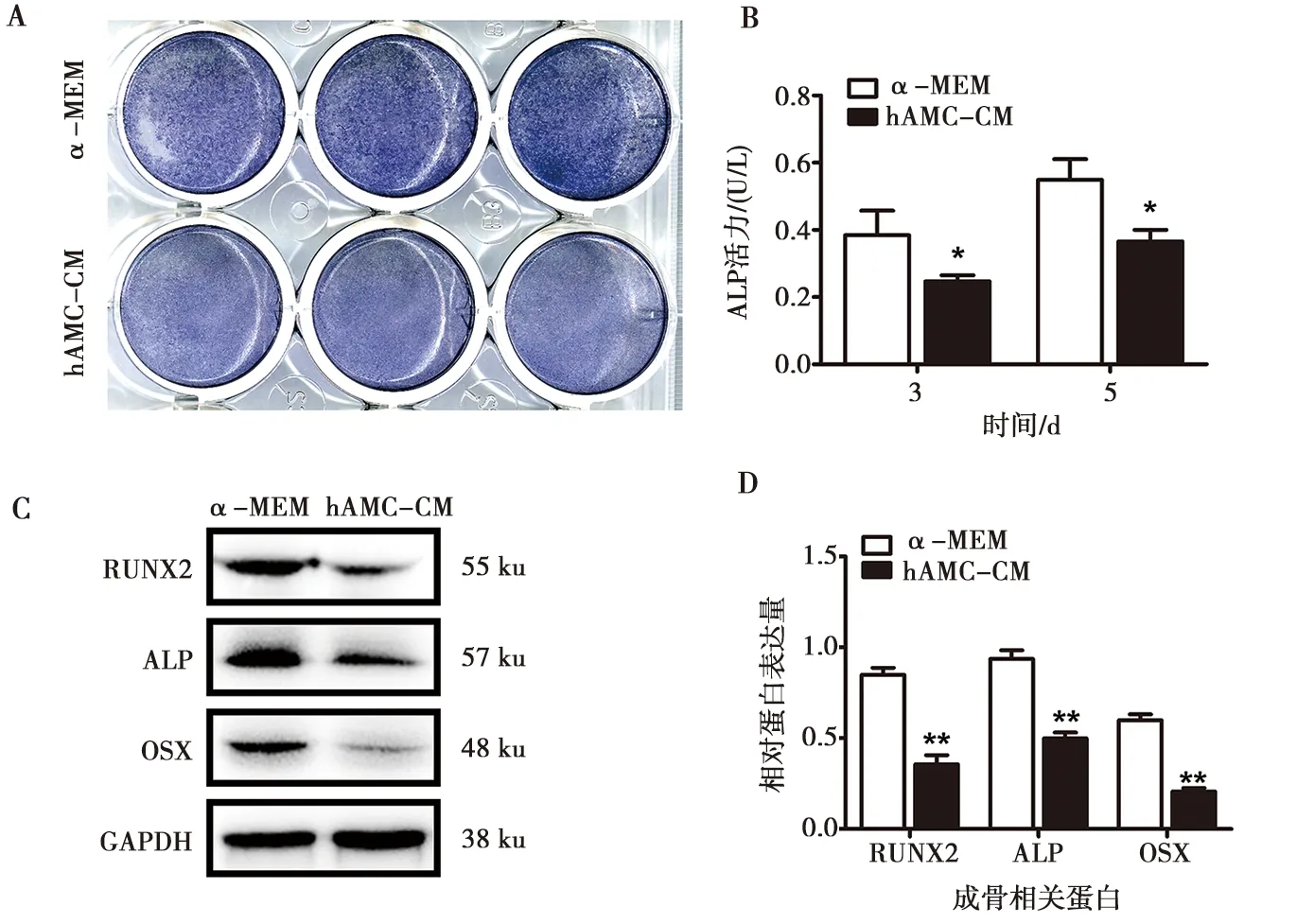
A:hAMC-CM培养hBMSCs 5 d后的碱性磷酸酶染色结果;B:hAMC-CM培养hBMSCs 3、5 d后的碱性磷酸酶活性检测结果;C:hAMC-CM培养hBMSCs 7 d后RUNX2、ALP及OSX的表达情况;D:图C蛋白条带的灰度值分析;*:P<0.05,**:P<0.01
2.4 hAMC-CM对hBMSCs晚期成骨能力的影响
两种培养液配置的成骨诱导液培养hBMSCs 14 d后进行茜素红染色,结果显示α-MEM培养液组着色程度及范围明显强于hAMC-CM培养液组(图3A),利用10% CPC溶液溶解经茜素红染色后的钙化结节,然后进行相应的定量检测发现α-MEM培养液组钙离子浓度显著高于条件培养液组,差异具有统计学意义(P<0.01)(图3A)。通过Western blot实验结果发现成骨晚期的相关蛋白BSP、OPN、OCN以及Collagen Ⅰ的表达在加入hAMC-CM后均有不同程度的下调,灰度值分析具有统计学差异(P<0.01或P<0.05)(图3)。

A:不同培养液培养hBMSCs 14 d后的茜素红染色结果;B:茜素红染色结果的钙离子含量分析;C:不同培养液培养hBMSCs 7 d后BSP、OPN、OCN及Collagen Ⅰ的表达情况;D:图C蛋白条带的灰度值分析;*:P<0.05,**:P<0.01
2.5 hAMC-CM对hBMSCs自噬活性的影响
hAMC-CM培养hBMSCs 7 d后通过Western blot实验发现自噬相关蛋白ATG5、Beclin1和LC3b的表达较正常培养组均有明显下调,灰度值分析,差异具有统计学意义(P<0.01)(图4)。说明加入了成釉细胞条件培养液后hBMSCs的自噬活性受到了抑制。
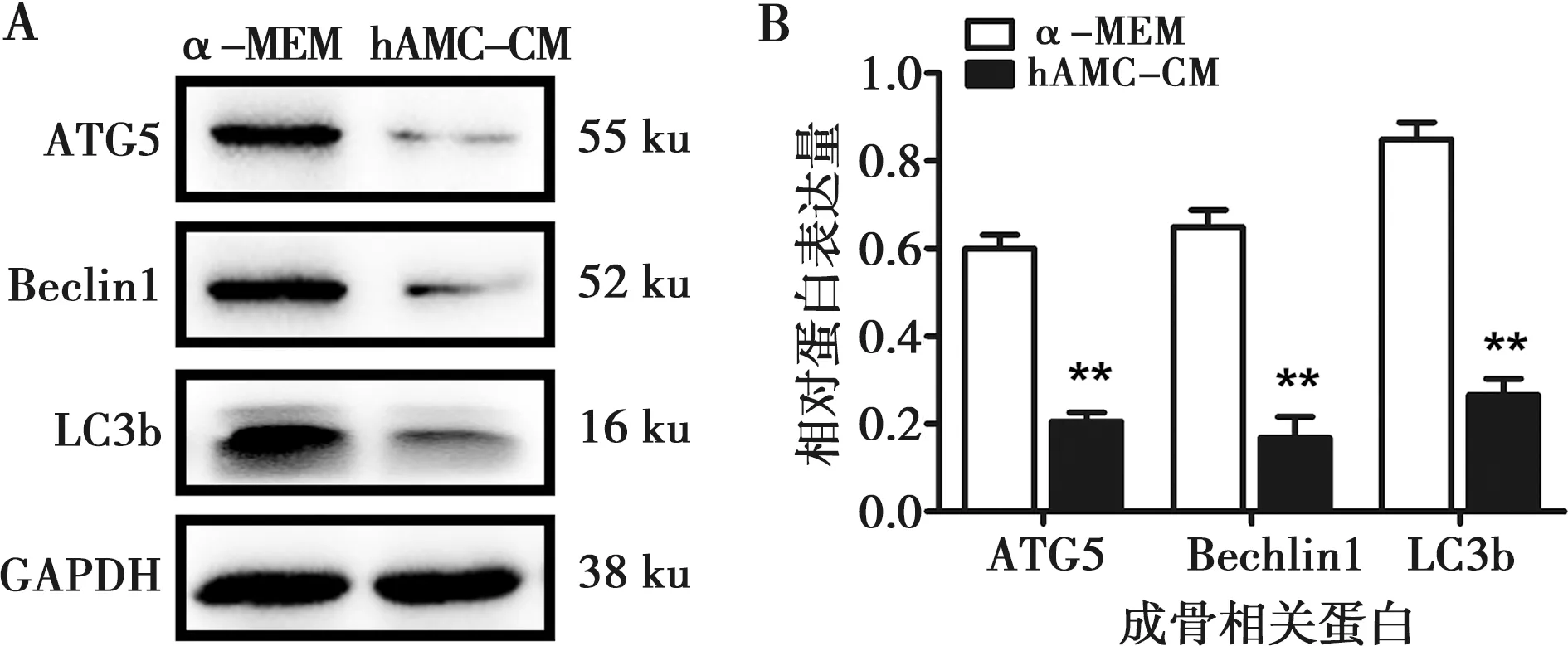
A:hAMC-CM培养hBMSCs 7 d后ATG5、Beclin1及LC3b的表达情况;B:自噬相关蛋白ATG5、Beclin1及LC3b的灰度值分析;**:P<0.01
3 讨 论
本研究根据文献所报道的方法[15]分离提取的分离成釉细胞瘤细胞(hAMCs)呈现两种主要的细胞形态,即内皮细胞样成釉细胞瘤细胞(epithelial cell-like hAMCs, E-hAMCs)和间充质样成釉细胞瘤细胞(mesenchymal cell-like hAMCs, M-hAMCs),符合成釉细胞瘤公认的组织病理结构中存在上皮成分和纤维成分的特征,通过Western blot对所提取的hAMCs的标志物进行验证,其也与成釉细胞瘤研究的相关文献中所提取的hAMCs特征相一致[15-16]。然而,本研究中所获得的hAMCs在原代培养传代后出现增殖缓慢,到P2代时逐渐呈现停止增殖并凋亡的趋势。因此本研究中所收集的hAMCs条件培养液(hAMC-CM)为生长增殖状态基本正常的P2代之前的细胞条件培养液(收集时经过0.22 μm过滤)。
为研究hAMCs对骨再生的影响,本研究选择标准提取流程所获得的hBMSCs作为细胞模型进行体外实验。首先验证hAMC-CM的毒性作用,通过CCK-8验证hBMSCs在hAMC-CM中的增殖情况,结果显示,细胞的形态和增殖情况与对照组(α-MEM)无统计学差异。因此我们可以判定后续用hAMC-CM培养的hBMSCs在成骨表型中的所呈现的与对照的差异并非来自hAMC-CM的毒性。我们在实验中对hBMSCs进行成骨诱导,并选取成骨诱导早期、晚期的特征性实验和相关蛋白水平的标志物进行验证[17]。在成骨诱导液中掺入hAMC-CM后,hBMSCs的ALP活性明显受到抑制,成骨早期的标志物转录因子RUNX2、OSX以及胞内ALP表达显著下降。RUNX2和OSX同为成骨相关的转录因子,表达于细胞核内,是干细胞成骨分化调控的重要因子,抑制其表达会直接抑制细胞成骨分化[18]。而ALP是成骨细胞表面标志物之一,直接反映成骨细胞的活性或功能状况[19],ALP表达降低、活性降低都反映出成骨细胞矿化障碍。经过14 d的成骨诱导培养,hAMC-CM对hBMSCs成骨分化呈现持续性的抑制,hBMSCs所形成的矿化结节明显少于对照组。成骨表型相关的标志物OCN、BSP、Collagen Ⅰ[17]也都呈现下调的趋势。肿瘤组织会侵蚀破坏正常颌骨,造成骨质破坏。而另一方面,由上述实验结果分析可知,成釉细胞瘤还会对正常的骨髓干细胞的成骨分化进行抑制,进而使机体失去自我修复的能力,间接加重颌骨病变。
已有大量报道发现hBMSCs的成骨分化过程存在自噬现象[20-21]。为了进一步验证hAMCs分析对hBMSCs成骨抑制的作用机制,我们验证了hAMC-CM是否会抑制hBMSCs的自噬水平。结果显示hAMC-CM显著抑制了hBMSCs中自噬相关标志物Beclin1、ATG5和LC3b的表达。Beclin 是自噬过程中重要的调节分子[22],Beclin1主要通过与PI3K形成复合体来调节ATG蛋白在自噬前体结构中定位,调节自噬活性[23]。ATG5则是自噬形成的标志,其表达量可在某种程度上反应细胞自噬活性[24]。LC3是自噬泡膜的通用标记物,主要有两种存在形式:LC3a(胞质型)及LC3b(膜型)[25]。LC3a转变为LC3b表示自噬体形成,因此LC3b常被作为自噬体形成的分子标志。结果表明:成釉细胞瘤细胞在抑制hBMSCs成骨分化的同时还可以抑制hBMSCs自噬,阻碍干细胞的自我循环利用,间接影响骨髓干细胞对颌骨病损的修复进程。
4 结 论
本研究通过分离hAMCs,所收集hAMC-CM可抑制hBMSCs成骨分化,且这一抑制作用与hBMSCs的自噬水平降低密切相关。说明成釉细胞瘤组织侵蚀正常颌骨组织的同时,间接抑制骨髓间充质干细胞促进骨再生的能力。这一研究结论的意义在于,手术切除成釉细胞瘤后,可通过调节缺损处肿瘤微环境中骨髓干细胞的自噬水平促进机体内源性骨再生,为成釉细胞瘤术后骨再生提供补充治疗策略。
