苍术属植物中倍半萜类化合物化学结构和生物活性研究进展
2021-01-05王艺萌王知斌孙延平杨炳友匡海学
王艺萌,王知斌,孙延平,杨炳友,匡海学
苍术属植物中倍半萜类化合物化学结构和生物活性研究进展
王艺萌,王知斌,孙延平,杨炳友,匡海学*
黑龙江中医药大学教育部北药基础与应用研究重点实验室,黑龙江省中药及天然药物药效物质基础研究重点实验室,黑龙江 哈尔滨 150040
倍半萜类化合物是苍术属植物的主要活性成分之一,从苍术属植物根茎中分离得到的倍半萜类化合物按骨架类型可分为桉叶烷型、愈创木烷型、香根螺烷型和艾里莫酚烷型4种,以桉叶烷型为主。苍术属倍半萜类化合物具有广泛的生物活性,包括抗炎、抗肿瘤、保护神经系统、保肝、抗菌和抗病毒等活性。总结了苍术属植物中倍半萜类化合物化学成分的结构特点和生物活性,为该属植物深度开发利用提供参考。
苍术属;倍半萜;桉叶烷型;愈创木烷型;香根螺烷型;艾里莫酚烷型;抗炎;抗肿瘤;保护神经系统;保肝;抗菌;抗病毒
苍术属DC.为菊科多年生草本植物,苍术属植物约有7个种,主要分布在亚洲东部地区,在我国有5个种[1]。《中国药典》2020年版中规定苍术为茅苍术(Thunb.) DC.或北苍术(DC.)Koidz.的干燥根茎[2]。苍术属植物在我国分布较广,种类及资源分布见表1,除鄂西苍术根茎不发达不作药用外,其他苍术属植物均以根茎入药,可作药用。倍半萜类化合物是苍术属植物的主要化学成分之一,种类繁多、结构多样、药理活性广泛。目前发现苍术属植物中倍半萜类化合物具有抗炎、抗肿瘤、保护神经系统、保肝、抗菌、抗病毒等药理作用。近年来,苍术属下级各植物的倍半萜类化合物的研究受到了国内外学者的广泛关注,尤其对茅苍术和白术的研究较多,但对整个苍术属植物倍半萜类化合物的结构及生物活性的系统性归纳总结尚显欠乏。本文对苍术属植物倍半萜类化学成分的分类、来源、结构、药理作用等研究现状进行综述,重点总结了该属植物中倍半萜的种类和药理活性方面的研究进展。
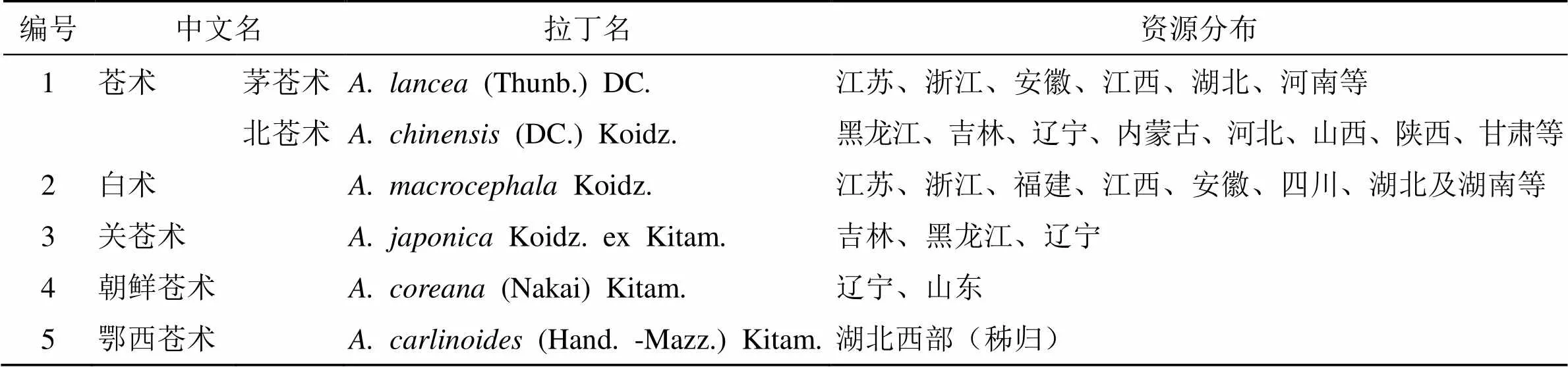
表1 中国苍术属植物种类及资源分布
1 化学结构
苍术属植物以根茎入药,从苍术属植物根茎中分离得到的98个倍半萜类化合物,根据其骨架类型可分为桉叶烷型、愈创木烷型、香根螺烷型和艾里莫酚烷型4种,其中桉叶烷型有63个,可见苍术属所含倍半萜以桉叶烷型骨架为主。
1.1 桉叶烷型倍半萜
苍术属中已报道的桉叶烷型倍半萜有63个,占该属已报道倍半萜的一半以上,化学成分及结构见表2和图1。其基本骨架母核是由15个碳原子组成的2个六元环和4个甲基,此类倍半萜结构多样,结构变化与环外羟基、羰基的取代位置、糖基的类型和取代位置以及环内双键位置有关。其中,化合物9具有优于阳性药的保肝作用,推测可能与C-2、C-3位的羰基有关。桉叶烷型倍半萜苷类的糖基部分主要为β--吡喃葡萄糖基和β--呋喃芹菜糖基,氧苷的糖链主要结合在苷元的C-3、C-11位。桉叶烷内酯类大多在C-8、C-12位成环,同时,在C-11位多具有甲基。此类倍半萜内酯具有抗炎、抗肿瘤、保护神经系统、抗菌、抗病毒等多种生物学活性。此外,在相同剂量下化合物55比化合物41、45具有更强的抑制一氧化氮释放的作用[15],推测可能与C-9位上具有羟基有关。从苍术属中分离得到3个倍半萜二聚体,其结构都是倍半萜内酯在C8-C8a桥头位置相连形成二聚体倍半萜内酯。
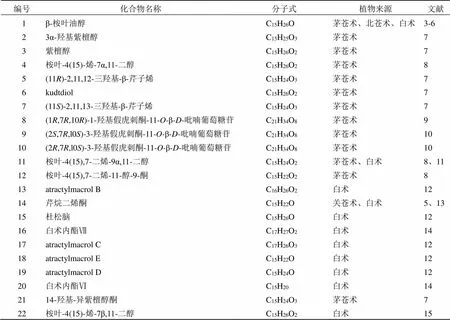
表2 从苍术属中分离得到的桉叶烷型倍半萜
续表2

编号化合物名称分子式植物来源文献 23苍术苷CC21H36O7茅苍术、关苍术16-18 24苍术苷DC27H46O12茅苍术、关苍术16-18 25苍术苷EC32H54O16茅苍术、关苍术16-18 26苍术苷FC37H62O20茅苍术、关苍术6、17-18 27苍术苷GC21H36O8茅苍术、关苍术16-18 28苍术苷G 2-Ο-β-D-吡喃葡萄糖苷C27H46O13茅苍术16 29苍术苷HC32H54O17茅苍术、关苍术17-18 30苍术苷ⅠC27H44O13茅苍术、关苍术16-18 31(5R,7R,10S)-3-羟基异紫檀醇酮-3-O-β-D-吡喃葡萄糖苷C21H34O8茅苍术10 32(5R,7R,10S)-6′′-O-乙酰苍术苷ⅠC29H46O14茅苍术10 33(5R,7R,l0S)-6′-O-乙酰苍术苷ⅠC29H46O14茅苍术10 34(5R,7R,10S)-异紫檀醇酮-11-O-β-D-呋喃芹菜糖基- (1→6)-β-D-吡喃葡萄糖基C26H42O11茅苍术10 35(5R,7R,10S)-3-O-β-D-吡喃葡萄糖基异紫檀醇酮-11-O-β- C32H52O17茅苍术9 D-呋喃芹菜糖基-(1→6)-β-D-吡喃葡萄糖苷 36(5R,7R,10S)-异紫檀醇酮-β-D-吡喃葡萄糖苷C21H34O7茅苍术16 37(5R,7R,10S)-14-羧基异紫檀醇酮-11-O-β-D-吡喃葡萄糖苷C21H32O9茅苍术9 38(5R,7R,10S)-14-羟基异紫檀醇酮-11-O-β-D-吡喃葡萄糖苷C21H34O8茅苍术19 39白术内酰胺C15H19ON白术15、20 40白术内酯ⅠC15H18O2茅苍术、北苍术、关苍术、白术3、12、14、 21-24 41白术内酯ⅡC15H20O2茅苍术、关苍术、北苍术、白术12、14、21- 24、25 42白术内酯ⅢC15H20O3茅苍术、北苍术、关苍术、白术12、14、21- 22 43白术内酯ⅣC17H23O5白术14 44异白术内酯IC15H22O2白术26 458β-甲氧基-白术内酯ⅠC16H22O3白术12、15 468-epiasterolidC15H20O2关苍术21 4713-羟基-白术内酯IIC15H20O3白术15 488-表白术内酯IIIC15H20O3白术27 493β-乙酰氧基-白术内酯ⅠC17H22O4白术26 508β-ethoxyasterolidC17H24O3白术13 51(3S)-3-羟基白术内酯III-3-O-β-D-吡喃葡萄糖苷C21H30O9关苍术17 52苍术酮C15H20O茅苍术、北苍术、关苍术、白术6、21-23、28 533β-乙酰氧基苍术酮C17H22O3白术20 544-酮基-白术内酯IIIC14H18O4白术15 55白术内酯ⅤC15H20O4白术14 56羟基白术内酯C15H20O3白术29 578β,9α-二羟基白术内酯IIC15H20O4白术30 58白术醚C15H22O2白术26 594(R),15-环氧-8β-羟基白术内酯IIC15H24O4白术26 604R,15-环氧白术内酯IIC15H20O3白术30 61双白术内酯C30H38O4白术11、27 62双表白术内酯C30H38O4白术29 63双白术内酯IIC34H42O8白术31
1.2 愈创木烷型倍半萜
愈创木烷型倍半萜是一种特殊的倍半萜,属于薁类化合物,可看成是由五元环的环戊二烯负离子和七元环的环庚三烯正离子骈合而成,所以薁是一种非苯型的芳烃类化合物,具有一定的芳香性,这类化合物多具有抗肿瘤、保护神经系统等生物活性。苍术属中的愈创木烷型倍半萜多在C-11位有糖基取代形成倍半萜苷。可在C-4、C-7、C-10和C-11位被氧化,在C-4和C-7、C-7和C-10处出现环氧桥,这类结构对小鼠白血病P388和人肺癌A549细胞有细胞毒作用[8]。此外,苍术属愈创木烷型倍半萜糖苷的C-10位羟基可能具有重要的抗炎活性[35]。从苍术属中分离得到20个愈创木烷型倍半萜,化学成分及结构见表3和图2。
1.3 香根螺烷型倍半萜
香根螺烷型倍半萜是螺环化合物,其结构特点为1个六元环和1个五元环通过1个螺原子相连而成,苍术属中该类型倍半萜的结构变化与五元环的构型、六元环内双键位置及C-3、C-4、C-10和C-11位的取代基有关。其中,具有2个立体中心(C-5和C-7)的化合物86~88与具有1个立体中心(C-7)的化合物84~85具有相似的ECD谱数据。从苍术属中分离得到13个该类型化合物,化学成分结构见表4和图3。
1.4 艾里莫酚烷型倍半萜
苍术属中艾里莫酚烷型倍半萜较少,从茅苍术中分离得到2个艾里莫酚烷型倍半萜[19],分别为(3,4,5,7)-3,11-二羟基-11,12-二氢诺卡酮-11-- β--吡喃葡萄糖苷(97)、(3,4,5,7)-3,4,11-三羟基-11,12-二氢诺卡酮-11--β--吡喃葡萄糖苷(98),从苍术属中分离得到的艾里莫酚烷型倍半萜类化合物的结构见图4。
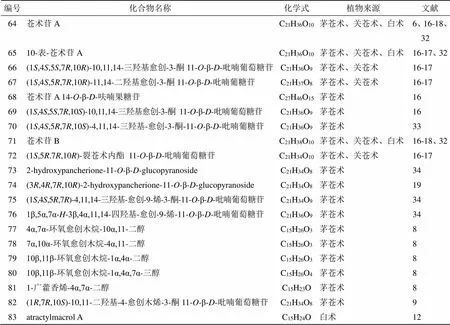
表3 从苍术属中分离的愈创木烷型倍半萜
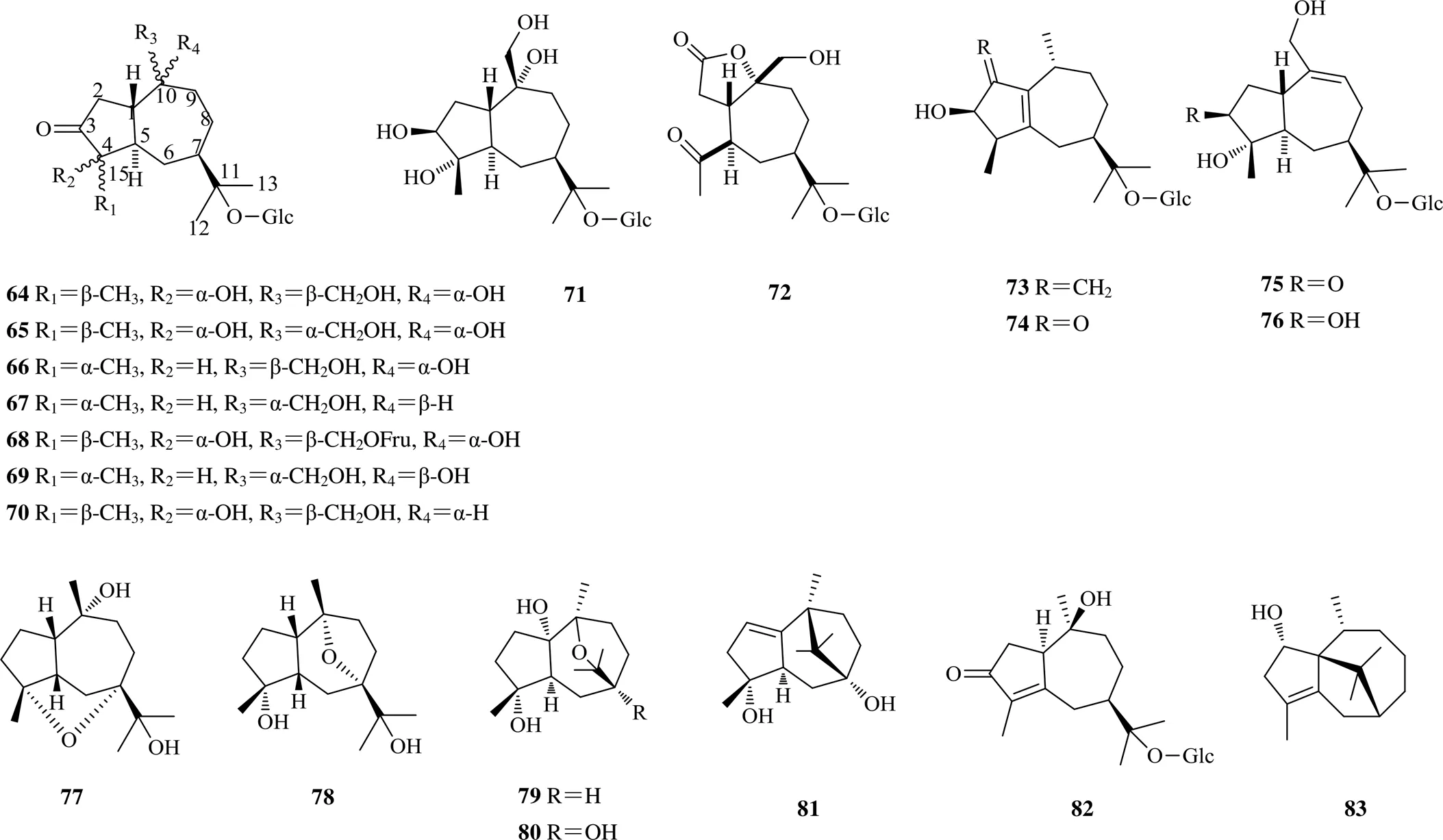
图2 从苍术属中分离得到的愈创木烷型倍半萜类化合物的结构
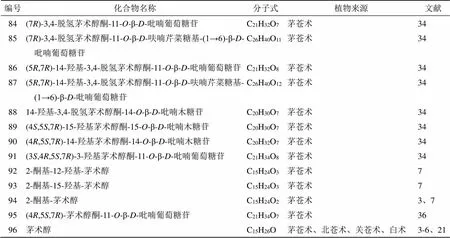
表4 从苍术属中分离的香根螺烷型倍半萜
2 生物活性
近年来,国内外学者对苍术属倍半萜类化合物进行药理研究,发现其具有抗炎、抗肿瘤、保护神经系统、保肝、抗菌、抗病毒等活性,并对其作用机制进行了探讨。整理了近年来苍术属倍半萜类化合物生物活性及作用机制的研究进展,为该属植物深度开发利用提供参考。

图3 从苍术属中分离得到的香根螺烷型倍半萜类化合物的结构

图4 从苍术属中分离得到的艾里莫酚烷型倍半萜类化合物的结构
2.1 抗炎
苍术属植物具有抗炎活性,化合物40和42均可通过抑制肿瘤坏死因子-α(TNF-α)和一氧化氮的产生而发挥抗炎作用,且化合物40的抑制作用更强[37],作用机制为剂量相关性的抑制TNF-α、白细胞介素-1β(IL-1β)、血管内皮生长因子(VEGF)、胎盘生长因子(PIGF)和一氧化氮的水平[38],其抗炎作用还可能与抑制NF-κB、ERK1/2和p38信号通路有关[39]。从茅苍术中分离的化合物52具有很强的抗炎镇痛作用,能显著抑制细胞中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)等的表达[40],在卵白蛋白诱发的变应性鼻炎动物模型中,化合物52显示出抑制过敏性炎症的作用。化合物52还能抑制Caspase-1/NF-κB/MAPKs信号通路,降低佛波酯-12-肉豆蔻-13-乙酸酯加钙离子载体A23187(PMACI)诱导人肥大HMC-1细胞产生的炎症反应。在动物模型中,可降低白细胞介素-1(IL-1)、白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-6(IL-6)、白细胞介素-13(IL-13)、COX-2、细胞间黏附分子-1和巨噬细胞炎症蛋白-2的表达[41]。化合物41、45和55均具有抗炎活性,可降低脂多糖诱导巨噬细胞RAW264.7产生一氧化氮而发挥抗炎活性,半数抑制浓度(IC50)值分别为(48.6±0.5)、(32.3±2.9)、(46.4±3.2)μmol/L,其中化合物55对一氧化氮生成的抑制作用最强[15]。
2.2 抗肿瘤
苍术属倍半萜类化合物具有广泛的抗肿瘤活性,化合物40对多种癌细胞增殖具有抑制作用,可通过线粒体介导的凋亡途径诱导肺癌A549细胞凋亡[42]。此外,化合物40对人早幼粒白血病HL-60细胞具有剂量相关性的细胞毒活性,作用机制可能是通过抑制HL-60细胞的铜锌超氧化物歧化酶(Cu,Zn-SOD),从而诱导细胞凋亡有关[43]。此外,化合物40可以通过灭活Notch通路有效抑制癌细胞增殖和诱导细胞凋亡[44],化合物40还可通过上调基因表达,同时下调、、基因表达来抑制膀胱癌细胞增殖,使细胞周期阻滞在G2/M期。在小鼠实验中,化合物40阻断了T-24或253J诱导的异种移植瘤的生长,但无明显毒性[45]。化合物42对TSLP刺激的人肥大细胞白血病细胞系HMC-1具有抗肿瘤活性,作用机制为抑制肥大细胞增殖,IL-13及磷酸化信号转导和转录激活子。化合物11、39~41对B16癌细胞具有抑制作用,其中39~41较有效,IC50值分别为54.88、76.46、84.02 μmol/L,其作用机制可能与诱导细胞分化,抑制细胞迁移有关[46]。化合物92~94对B16黑色素瘤细胞的黑色素合成有中度的抑制作用(100 mmol/L时抑制率分别为39%、34%、48%)[7]。化合物41可以调控Akt/ERK信号通路而显著抑制胃癌细胞的活性、增殖和诱导细胞凋亡[47]。化合物77~78、80对P388和A549细胞有细胞毒作用,但均无活性[8]。化合物1对肿瘤HeLa、SGC-7901和BEL-7402细胞增殖呈时间和剂量相关性的抑制作用。此外,2.55 mg/kg化合物1显著抑制小鼠体内H22和S180肿瘤的生长,作用机制是通过抑制生长因子信号通路CREB的激活而抑制血管生成[48],化合物1还可抑制白血病HL-60细胞生长并使其凋亡[49]。
2.3 保护神经系统
苍术属倍半萜类化合物对中枢神经系统具有保护作用,在以暴露于1-甲基-4-苯基-吡啶离子(MPP+)的人骨髓神经母细胞瘤SH-SY5Y细胞建立帕金森病模型实验中。化合物40~42、44、53、61表现出神经保护作用。其中40~42、44、61在1 μmol/L时有保护作用,在10 μmol/L时有明显的神经细胞保护作用[27]。化合物42能显著改善大鼠慢性高剂量同型半胱氨酸所致的学习记忆障碍,降低同型半胱氨酸诱导的活性氧生成,恢复同型半胱氨酸诱导的磷酸化蛋白激酶C表达水平的下降。此外,化合物42可保护原代培养神经元免受同型半胱氨酸诱导的凋亡,对学习和记忆受损的大鼠起到神经保护作用[50]。化合物61对-半乳糖诱导小鼠的记忆损伤有神经保护作用,可显著降低活性氧的形成,降低乙酰胆碱酯酶的活性,增加突触素I和蛋白激酶C的表达,提示化合物61对老年相关记忆障碍有治疗潜力[51]。此外,化合物61可以诱导PI3K-Akt-GSK3β通路影响谷氨酸的合成,进而对大鼠肾上腺嗜铬细胞瘤细胞和SH-SY5Y细胞系细胞损伤具有神经保护作用[52]。化合物1对神经系统有多种独特的作用,在浓度为100、150 μmol/L时可显著诱导大鼠嗜铬细胞瘤PC-12细胞的轴突延伸,最高浓度(150 μmol/L)时可抑制[3H]胸腺嘧啶核苷掺入,机制可能与影响磷脂酰肌醇特异性磷脂酶C(phosphatidylinositol-specific phospholipase C, PI-PLC)和丝裂原活化蛋白激酶(MAPK)参与轴突的生长有关。而且化合物1是一种小分子,因此可能是一种很有前途的先导化合物[53]。
2.4 对消化系统的作用
肠道黏膜系统是防止微生物感染的物理屏障。在各种胃肠道疾病的过程中,可以观察到黏膜上皮屏障的完整性受损,肠上皮IEC-6细胞的迁移和增殖是黏膜溃疡和创面愈合的重要修复方式。化合物40调控多胺介导的Ca2+信号通路促进IEC-6细胞的迁移,有潜力进一步开发治疗炎症性肠病和消化性溃疡等疾病[54]。化合物42可剂量相关性地阻止乙醇诱导的PRGM细胞死亡和细胞膜损伤,有抗酒精性急性胃溃疡作用,半数有效浓度(50% effective concentration,EC50)值分别为0.27、0.34 mmol/L,其作用机制与抑制基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)途径有关[55]。化合物96特异性抑制H+和K+-ATP酶活性而发挥抗胃溃疡的作用,其IC50值为58.3 μmol/L[56]。
2.5 保肝
化合物9和97在10 μmol/L(双环醇为阳性药物)浓度下对-乙酰-对氨基苯酚诱导的HepG2细胞损伤有明显的保护作用,细胞存活率分别为34.6%、37.7%(<0.001),高于阳性药双环醇,说明其具有较强的保肝作用[10]。化合物52可以抑制四氯化碳诱导的大鼠肝细胞损伤和四氯化碳诱导的大鼠肝微粒体脂质过氧化而发挥保肝作用[57]。化合物96可阻滞人肝癌SMMC-7721和LM3细胞的细胞周期于G1期来抑制细胞增殖,诱导细胞凋亡,其机制与抑制丝裂原激活蛋白激酶的激酶(MEK)和胞外信号调节激酶(ERK)的磷酸化、下调NF-κB p65和磷酸化p65在细胞核的表达有关[58]。
2.6 抗菌和抗病毒
《本草纲目》记载苍术辟一切恶气,在古代常用苍术熏蒸防疫,一直延续至今,常运用在病房、手术室等医院场景,效果显著,在广东省抗击重症急性呼吸综合征、甲型流感病毒期间也曾被广泛运用。据统计,苍术是使用率较高的避疫药。在此次新型冠状病毒肺炎疫情中,治疗轻型和普通型患者的4种推荐方中也均有苍术。苍术挥发油制剂和苍术烟熏剂对金黄色葡萄球菌、大肠杆菌、绿脓杆菌有一定的抑制作用,此外,苍术挥发油在体外实验中可以抑制H3N2型猪流感病毒[59]。从苍术中分离的化合物52以10~40 mg/kg剂量连续给药5 d可减轻甲型流感病毒导致的肺损伤,降低IL-6、TNF-α和IL-1β水平,升高干扰素β水平,可通过调节Toll样受体7信号通路显著减轻甲型流感病毒所致的肺损伤。化合物40、42、52对甲型流感病毒凝集形成有抑制作用,其机制可能与阻断病毒在宿主细胞上的吸附或抑制病毒复制有关[21]。
2.7 其他
化合物40~42具有较强的芳香化酶抑制活性,其芳香化酶抑制率分别为(94.56±0.70)%、(90.93±1.41)%、(86.31±8.46)%,因此,苍术属倍半萜内酯及其衍生物可能是潜在的人工合成药物,值得进一步研究[11];化合物1可改变工蚁角质层化学成分,损害巢友识别而引发报警行为,使巢友具有攻击能力[60]。此外,化合物1可以阻断ERK信号通路显著抑制血管生成,因此,可能开发成为治疗血管生成性疾病的药物[61]。
3 结语和展望
苍术属中桉叶烷型倍半萜内酯具有多种活性,尤其在抗炎、抗肿瘤、保护神经系统、保护胃肠道等方面作用显著,具有深度开发的价值,可在抗肿瘤、治疗肠炎和消化性溃疡、老年相关记忆障碍或血管生成性疾病等方向进行开发利用,其活性成分的作用机制及构效关系研究较少,还有待进一步阐明。苍术属愈创木烷型倍半萜生物活性研究相对较少,其倍半萜糖苷的C-10位羟基可能具有重要的抗炎活性,此类化合物中,在C-4和C-7、C-7和C-10处出现环氧桥的愈创木烷型倍半萜具有细胞毒作用,有深入研究的价值。苍术属中对鄂西苍术与朝鲜苍术的化学成分研究仅有GC-MS法测其挥发油的报道,鄂西苍术因根茎太小不作药用,但民间有用其治疗类风湿性关节炎的记载,朝鲜苍术水提液对胃癌SGC-7901细胞的增殖有抑制作用[62],故二者有一定的开发价值。此外,苍术熏蒸阻断病毒传播的研究前景十分广阔,其有效物质和作用机制尚不明确,值得进一步研究,以期为抗击新型冠状病毒肺炎做出贡献。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1987: 23-29.
[2] 中国药典 [S]. 一部. 2020: 168.
[3] Ding H Y, Wu Y C, Linc H C. Phytochemical and pharmacological studies on Chinese Changzhu [J]., 2000, 47(3): 561-566.
[4] Nakai Y, Kido T, Hashimoto K,. Effect of the rhizomes ofand its constituents on the delay of gastric emptying [J]., 2003, 84(1): 51-55.
[5] Endo K, Taguchi T, Taguchi F,. Antiinflammatory principles ofrhizomes [J].(Tokyo), 1979, 27(12): 2954-2958.
[6] Na-Bangchang K, Plengsuriyakarn T, Karbwang J. Research and development of(Thunb) DC. as a promising candidate for cholangiocarcinoma chemotherapeutics [J]., 2017, 2017: 5929234.
[7] Kamauchi H, Kinoshita K, Takatori K,. New sesquiterpenoids isolated fromfermented by marine fungus [J]., 2015, 71(13): 1909-1914.
[8] Wang H X, Liu C M, Liu Q,. Three types of sesquiterpenes from rhizomes of[J]., 2008, 69(10): 2088-2094.
[9] Jiang J S, Xu K, Feng Z M,. Four new sesquiterpenes from[J]., 2018, 26: 88-92.
[10] Xu K, Feng Z M, Yang Y N,. Eight new eudesmane- and eremophilane-type sesquiterpenoids from[J]., 2016, 114: 115-121.
[11] Jiang H, Shi J, Li Y Y. Screening for compounds with aromatase inhibiting activities fromKoidz [J]., 2011, 16(4): 3146- 3151.
[12] Wang S Y, Ding L F, Su J,. Atractylmacrols A-E, sesquiterpenes from the rhizomes of[J]., 2018, 23: 127-131.
[13] Chen Z L. The acetylenes from[J]., 1987, 53(5): 493-494.
[14] Ruqiao L, Yueli C, Xuelan Z,. Rhizoma: A review of photochemistry, pharmacokinetics and pharmacology [J]., 2020, 75(2): 42-55.
[15] Hoang L S, Tran M H, Lee J S,. Inflammatory inhibitory activity of sesquiterpenoids fromrhizomes [J].(Tokyo), 2016, 64(5): 507-511.
[16] Kitajima J, Kamoshita A, Ishikawa T,. Glycosides of[J].(Tokyo), 2003, 51(6): 673-678.
[17] Kitajima J, Kamoshita A, Ishikawa T,. Glycosides of[J].(Tokyo), 2003, 51(2): 152-157.
[18] Shoji Y, Tomoko H, Kazue I,. Studies on the constituents oflancea [J]., 1989, 37(11): 2995-3000.
[19] 绪扩. 茅苍术化学成分及药理活性研究 [D]. 北京: 北京协和医学院, 2017.
[20] Chen Z L, Cao W Y, Zhou G X,. A sesquiterpene lactam from[J]., 1997, 45(4): 765-767.
[21] Cheng Y, Mai J Y, Hou T L,. Antiviral activities of atractylon from[J]., 2016, 14(4): 3704-3710.
[22] Meng H, Li G Y, Dai R H,. Chemical constituents of(DC.) koidz [J]., 2010, 38(6): 1220-1223.
[23] Resch M, Steigel A, Chen Z L,. 5-Lipoxygenase and cyclooxygenase-1 inhibitory active compounds from[J]., 1998, 61(3): 347- 350.
[24] Sin K S, Kim H P, Lee W C,. Pharmacological activities of the constituents of[J]., 1989, 12(4): 236-238.
[25] Nishikawa Y, Yasuda I, Watanabe Y,. Studies on the components of Atractylodes. II. New polyacetylenic compounds in the rhizome ofDe Candolle var.Kitamura (author’s transl) [J]., 1976, 96(11): 1322-1326.
[26] Zhang N, Liu C, Sun T M,. Two new compounds fromwith neuroprotective activity [J]., 2017, 19(1): 35-41.
[27] Li Y, Yang X W. New eudesmane-type sesquiterpenoids from the processed rhizomes of[J]., 2014, 16(2): 123-128.
[28] Yu S, Yasukawa K, Takido M.extract and its component, atractylon, inhibit tumor promotion in mouse skin two-stage carcinogenesis [J]., 1994, 1(1): 55-58.
[29] Bagal S K, Adlington R M, Baldwin J E,. Biomimetic synthesis of biatractylolide and biepiasterolide [J]., 2003, 5(17): 3049-3052.
[30] 李滢, 杨秀伟. 生白术化学成分研究 [J]. 中国现代中药, 2018, 20(4): 382-386.
[31] Li Y Z, Dai M, Peng D Y. New bisesquiterpenoid lactone from the wild rhizome ofKoidz grown in Qimen [J]., 2017, 31(20): 2381-2386.
[32] Kitajima J, Kamoshita A, Ishikawa T,. Glycosides of[J].(Tokyo), 2003, 51(9): 1106-1108.
[33] Yin M, Xiao C C, Chen Y,. A new sesquiterpenoid glycoside from rhizomes of[J]., 2015, 7(4): 371-374.
[34] Xu K, Jiang J S, Feng Z M,. Bioactive sesquiterpenoid and polyacetylene glycosides from[J]., 2016, 79(6): 1567- 1575.
[35] Yin M, Xiao C C, Chen Y,. Two new sesquiterpenoid glycosides from rhizomes of[J]., 2015(3): 495-499.
[36] Long L P, Wang L S, Qi S Z,. New sesquiterpenoid glycoside from the rhizomes of[J]., 2020, 34(8): 1138-1145.
[37] Li C Q, He L C, Jin J Q. Atractylenolide I and atractylenolide III inhibit lipopolysaccharide-induced TNF-α and NO production in macrophages [J]., 2007, 21(4): 347-353.
[38] Wang C H, Duan H J, He L C. Inhibitory effect of atractylenolide I on angiogenesis in chronic inflammationand[J]., 2009, 612(1/ 2/3): 143-152.
[39] Ji G Q, Chen R Q, Zheng J X. Atractylenolide I inhibits lipopolysaccharide-induced inflammatory responses via mitogen-activated protein kinase pathways in RAW264.7 cells [J]., 2014, 36(6): 420-425.
[40] Chen L G, Jan Y S, Tsai P W,. Anti-inflammatory and antinociceptive constituents ofkoidzumi [J]., 2016, 64(11): 2254- 2262.
[41] Kim H Y, Nam S Y, Hwang S Y,. Atractylone, an active constituent of KMP6, attenuates allergic inflammation on allergic rhinitisandmodels [J]., 2016, 78: 121-132.
[42] Liu H Y, Zhu Y J, Zhang T,. Anti-tumor effects of atractylenolide I isolated fromin human lung carcinoma cell lines [J]., 2013, 18(11): 13357-13368.
[43] Wang C C, Lin S Y, Cheng H C,. Pro-oxidant and cytotoxic activities of atractylenolide I in human promyeloleukemic HL-60 cells [J]., 2006, 44(8): 1308-1315.
[44] Ma L, Mao R R, Shen K,. Atractylenolide I-mediated Notch pathway inhibition attenuates gastric cancer stem cell traits [J]., 2014, 450(1): 353-359.
[45] Yu R, Yu B X, Chen J F,. Anti-tumor effects of Atractylenolide I on bladder cancer cells [J]., 2016, 35: 40.
[46] Zhao H, Ji Z H, Liu C,. Neuroprotection and mechanisms of atractylenolide III in preventing learning and memory impairment induced by chronic high-dose homocysteine administration in rats [J]., 2015, 290: 485-491.
[47] Ye Y, Chou G X, Wang H,. Effects of sesquiterpenes isolated from largehead atractylodes rhizome on growth, migration, and differentiation of B16 melanoma cells [J]., 2011, 10(1): 92-100.
[48] Tian S, Yu H D. Atractylenolide II inhibits proliferation, motility and induces apoptosis in human gastric carcinoma cell lines HGC-27 and AGS [J]., 2017, 22(11): E1886.
[49] Ma E L, Li Y C, Tsuneki H,. Beta-eudesmol suppresses tumour growth through inhibition of tumour neovascularisation and tumour cell proliferation [J]., 2008, 10(1/2): 159-167.
[50] Masuda Y, Kadokura T, Ishii M,. Hinesol, a compound isolated from the essential oils ofrhizome, inhibits cell growth and induces apoptosis in human leukemia HL-60 cells [J]., 2015, 69(3): 332-339.
[51] Ji Z H, Liu C, Zhao H,. Neuroprotective effect of biatractylenolide against memory impairment in- galactose-induced aging mice [J]., 2015, 55(3): 678-683.
[52] Zhu L, Ning N, Li Y,. Biatractylolide modulates PI3K-Akt-GSK3-dependent pathways to protect against glutamate-induced cell damage in PC12 and SH-SY5Y cells [J]., 2017, 2017: 1291458.
[53] Obara Y, Aoki T, Kusano M,. Beta-eudesmol induces neurite outgrowth in rat pheochromocytoma cells accompanied by an activation of mitogen-activated protein kinase [J]., 2002, 301(3): 803-811.
[54] Song H P, Hou X Q, Li R Y,. Atractylenolide I stimulates intestinal epithelial repair through polyamine- mediated Ca2+signaling pathway [J]., 2017, 28: 27-35.
[55] Wang K T, Chen L G, Wu C H,. Gastroprotective activity of atractylenolide III fromon ethanol-induced gastric ulcerand[J]., 2010, 62(3): 381-388.
[56] Satoh K, Nagai F, Kano I. Inhibition of H+, K+-ATPase by hinesol, a major component of So-jutsu, by interaction with enzyme in the E1 state [J]., 2000, 59(7): 881-886.
[57] Kiso Y, Tohkin M, Hikino H. Mechanism of antihepatotoxic activity of atractylon, I: Effect on free radical generation and lipid peroxidation [J]., 1985(2): 97-100.
[58] Guo W Q, Bin X U, Meng Q Y,. Anti-tumor effect of hinesol on liver cancer via downregulating MEK/ERK and NF-κB pathway in SMMC-7721 and LM3 cells [J]., 2018, 32(4): 282-282.
[59] 胡伟尚, 吴巧凤. 中药熏蒸防疫历史沿革与现代应用探讨 [J]. 中草药, 2020, 51(4): 895-901.
[60] Lukasz D, Waclaw W. Ant-root aphid relations in different plant associations [J]., 2008, 77(3): 151-163.
[61] Tsuneki H, Ma E L, Kobayashi S,. Antiangiogenic activity of β-eudesmoland[J]., 2005, 512(2/3): 105-115.
[62] 徐卫东, 芮梦珏, 欧阳臻, 等. 术属植物水提物对胃癌SGC-7901细胞的增殖抑制作用研究 [J]. 时珍国医国药, 2015, 26(12): 2861-2864.
Research progress on chemical structure and biological activity of sesquiterpenes from
WANG Yi-meng, WANG Zhi-bin, SUN Yan-ping, YANG Bing-you, KUANG Hai-xue
Key Laboratory of Basis and Application Research of North Medicine, Ministry of Education, Heilongjiang Provincial Key Laboratory of Traditional Chinese Medicines and Effective Substance Basis of Natural Medicines, Heilongjiang University of Chinese Medicine, Harbin 150040, China
Sesquiterpenes are one of the main active components of. According to the skeleton type, sesquiterpenes isolated from the rhizome ofcan be divided into four types: eudesmane-type, guaiane-type, spirovetivane-type and eremophilane-type, eudesmane-type was the main type. Sesquiterpenes ofhave a wide range of biological activities, including anti-inflammatory, anti-tumor, nervous system protection, liver protection, antibacterial and antiviral activities. The structural characteristics and biological activities of sesquiterpenes inare summarized in this paper, in order to provide reference for further development and utilization of.
DC.; sesquiterpenes; eudesmane-type; guaiane-type; spirovetivane-type; eremophilane-type; anti-inflammation; anti-tumor; nervous system protection; liver protection; antibacterial; antiviral
R282.71
A
0253 - 2670(2021)01 - 0299 - 11
10.7501/j.issn.0253-2670.2021.01.035
2020-08-10
国家自然科学基金面上项目(81973439);国家自然科学基金面上项目(81872979);国家自然科学基金资助项目(81803686);黑龙江省科学基金项目(H2018056);黑龙江省博士后科研启动资助金资助项目(LBH-Q16214);黑龙江中医药大学“优秀创新人才支持计划”科研项目(2018RCD03);黑龙江中医药大学校科研基金资助项目(201504)
王艺萌(1997—),女,硕士研究生,研究方向为中药药效物质基础。Tel: 18846066642 E-mail: 2034545341@qq.com
匡海学(1955—),男,教授,博士生导师。Tel: (0451)87267188 E-mail: hxkuang@hljucm.net
[责任编辑 崔艳丽]
