斑马鱼在药物毒理学评估中应用及机制的研究进展
2021-01-05李红燕李金秀任敉宏王佳俊
李红燕,谢 倩,王 成,李金秀,马 荣,任敉宏,李 勇,王佳俊,陈 海,王 建
斑马鱼在药物毒理学评估中应用及机制的研究进展
李红燕,谢 倩,王 成,李金秀,马 荣,任敉宏,李 勇,王佳俊,陈 海,王 建*
成都中医药大学药学院,四川 成都 611137
与其他哺乳动物相比,斑马鱼具有繁殖能力强、繁殖量大、生命周期短、养殖费用低、身体透明等特点。主要从心血管毒性、肝脏毒性、肾脏毒性、神经毒性、脾脏毒性和急性毒性6个方面进行归纳总结,结果发现斑马鱼的多个器官在形态、基因表达及生理特性方面均与哺乳动物高度相似,已被广泛应用于药物的毒性物质筛选研究。药物对斑马鱼毒性研究主要集中在死亡率和畸形率增加,心、肝、肾、脾等脏器形态、表型改变并伴有水肿及神经毒性等方面;其毒性机制主要涉及影响器官中细胞凋亡(p53通路)、炎症(NF-κB通路、白介素)或影响该器官功能蛋白、酶或mRNA,如丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、乙酰胆碱酯酶(AChE)、微球蛋白前体()和α微管蛋白(α tubulin)等。斑马鱼模型可作为一种评估药物安全性与毒性最为高效、快速、便捷的方法,阐明药物的毒性作用及其多组分多靶点的毒性作用机制,可为药物毒理学中的毒性评估提供新的思路。
斑马鱼;药物毒理学;毒性评估;安全性评价;心血管毒性;肝脏毒性;肾脏毒性;神经毒性;脾脏毒性;急性毒性
斑马鱼俗称为斑马担尼鱼、蓝条鱼、印度鱼,是一种原产于印度和孟加拉国的辐鳍亚纲鲤科热带硬骨鱼,身上有数条可直达尾鳍的深蓝色条纹,因其全身条纹形似斑马纹而得名。斑马鱼是仅次于小鼠的第2大模型生物,其具有体积小,样本量大,胚胎透明易于观察,与人类基因同源性高和实验周期短等优势[1-3],其胚胎、幼鱼和成鱼最早是被用来检测水中的有毒物质和致畸物[4]。后来也用于环境污染物的毒性评价,如原油、农药、重金属、工厂污水和消毒副产物等对生态环境的毒性损害[5-7]。Streisinger等[8]于1981年首次将斑马鱼与遗传学和生物学领域划上联系,使其研究领域得以拓展和延伸。目前,斑马鱼已被广泛用于遗传学、生态毒理学、药物药效活性物质筛选、药物代谢、药物毒性物质筛选等方面[9-11]。斑马鱼在药物毒理学评估中的应用汇总如图1所示。
提高药物早期毒性预测的可靠性和灵敏度已成为新药开发行业的迫切需求,而斑马鱼具有高通量的评价、检测和筛选药物毒性作用的独特优势,其作为药物毒性与安全性评价的实验动物受到医药学界越来越多的重视,已逐渐成为药物研发过程中毒性评价和安全性评价的重要工具[12]。结合国内外文献报道,本文综述了斑马鱼作为新兴模式生物在药物毒理学评价方面的研究进展,主要从药物心血管毒性、肝脏毒性、肾脏毒性、神经毒性、脾脏毒性和急性毒性6个方面及多组分多靶点的毒性作用机制进行归纳总结,以期为斑马鱼在药物毒理学中的毒性评估提供新的思路。
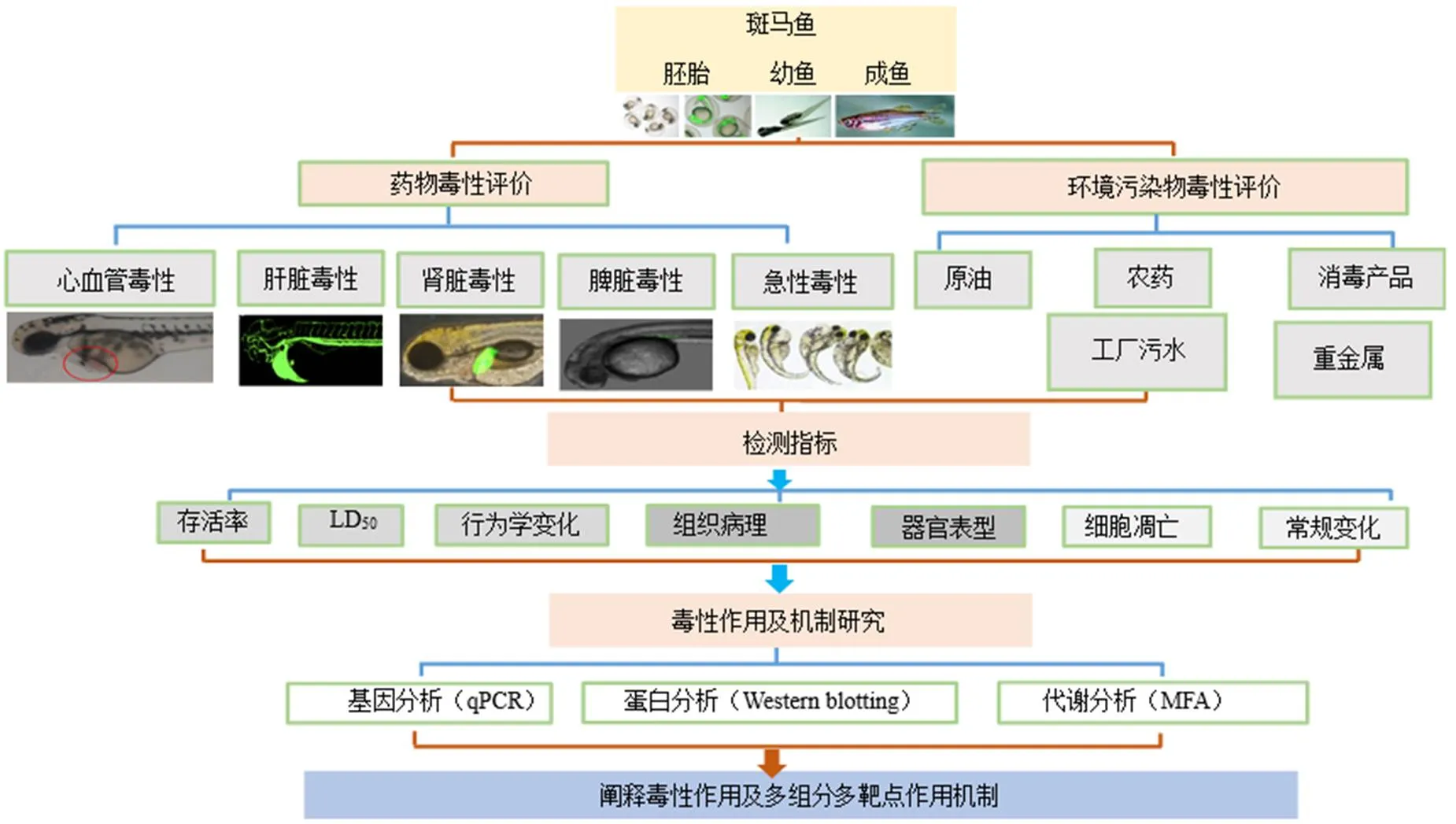
图1 斑马鱼在药物毒理学评估中的应用
1 评估药物的心血管毒性
1.1 斑马鱼评价心血管毒性的优势
心血管毒性是药物研发的主要限制因素[13]。斑马鱼的心血管系统是由心房、心室、静脉窦和动脉球串联而成[14],其心脏发育是一个迅速但复杂的过程,胚胎在受精后5 h(hours post fertilization,hpf)时心脏前体细胞成型,22 hpf时心脏开始出现收缩动作,48 hpf时功能性瓣膜逐渐形成,心率趋于稳定,72 hpf时完成胚胎期心脏的发育。与此同时,斑马鱼在24 hpf时尾部由蜷缩状态开始伸展,节间血管开始生长,到48 hpf时节间血管基本发育完全。有研究报道,斑马鱼心脏发育的形态、基因、生理特性以及血管生成过程均与哺乳动物相似[15-16],可通过光学显微镜对其心脏、血管和血液流动状态进行全程的监视,用于探究药物对斑马鱼的心血管毒性作用,为筛选药物的心血管毒性作用提供有效依据[17]。目前,在血管系统、血液、内皮细胞和心脏中表达荧光蛋白的转基因系斑马鱼的可用性也有助于精确和准确地评价药物对心血管系统的影响[18]。可见斑马鱼的上述优势使其成为筛选药物心血管毒性的重要生物模型。
1.2 药物对心血管毒性的影响
传统中药中提取分离出的很多单体化合物具有明显的药理活性,可以作为新药研发过程中的先导化合物,但是由于它们可能具有一些潜在的心血管毒性作用而限制了其临床应用。何俊霖等[19]以2、4、8、10 μg/mL异甘草素处理正常斑马鱼胚胎10、24 h,结果显示异甘草素质量浓度高于2 μg/mL可抑制斑马鱼胚胎血管生成,达8 μg/mL时,胚胎开始出现轻微血液瘀滞现象,且完全抑制尾部静脉血管的生成。异甘草素处理12 h后,胚胎心率随异甘草素质量浓度的升高而呈降低的趋势,当质量浓度达到10 μg/mL时,对胚胎心率有持续性的抑制作用和诱发心脏畸形的作用,导致胚胎心包和卵黄囊肿大。这表明高剂量的异甘草素对斑马鱼的胚胎发育有较强的毒性作用。赵慧等[20]建立阿霉素诱导的转基因Tg(∶)系心脏特异表达绿色荧光斑马鱼心肌损伤模型,结果显示阿霉素30、40 μg/mL干预24、48 h后,胚胎生存率显著降低,其活动受到抑制,心房、心室变大,出现不同程度的心包水肿,且动脉球间距显著增大;病理染色结果也提示给药后斑马鱼心脏明显变大,且结构紊乱,有红细胞溢出等。此外,氯化钡、广藿香、诺氟沙星、京大戟等对斑马鱼心血管发育生长也具有一定影响[21-27]。斑马鱼在药物心血管毒性中的研究见表1。
1.3 药物对斑马鱼心血管毒性的作用机制
赵慧等[20]通过阿霉素建立心肌损伤模型,通过DAPI和TUNEL染色发现阿霉素40 μg/mL组斑马鱼心脏明显变大,细胞数目减少且较稀疏,细胞核增大,凋亡细胞增多,且阿霉素对斑马鱼胚胎的心肌损伤作用呈时间和浓度相关性。表明阿霉素诱导的斑马鱼心肌损伤模型是可靠的,且其机制可能与增加心肌细胞凋亡有关。王冬梅等[24]观察了0、10、20、40 μmol/L诺氟沙星对斑马鱼胚胎不同发育时期脊柱弯曲、心包囊肿、卵黄囊肿和死亡率等毒性作用,结果显示随着诺氟沙星暴露浓度的增大,胚胎的发育延迟,孵化时间延长,胚胎死亡率增加;且暴露于不同浓度诺氟沙星的斑马鱼胚胎中基因表达随发育时间延长而增加趋势减缓。提示诺氟沙星的心脏毒性机制与基因相关。
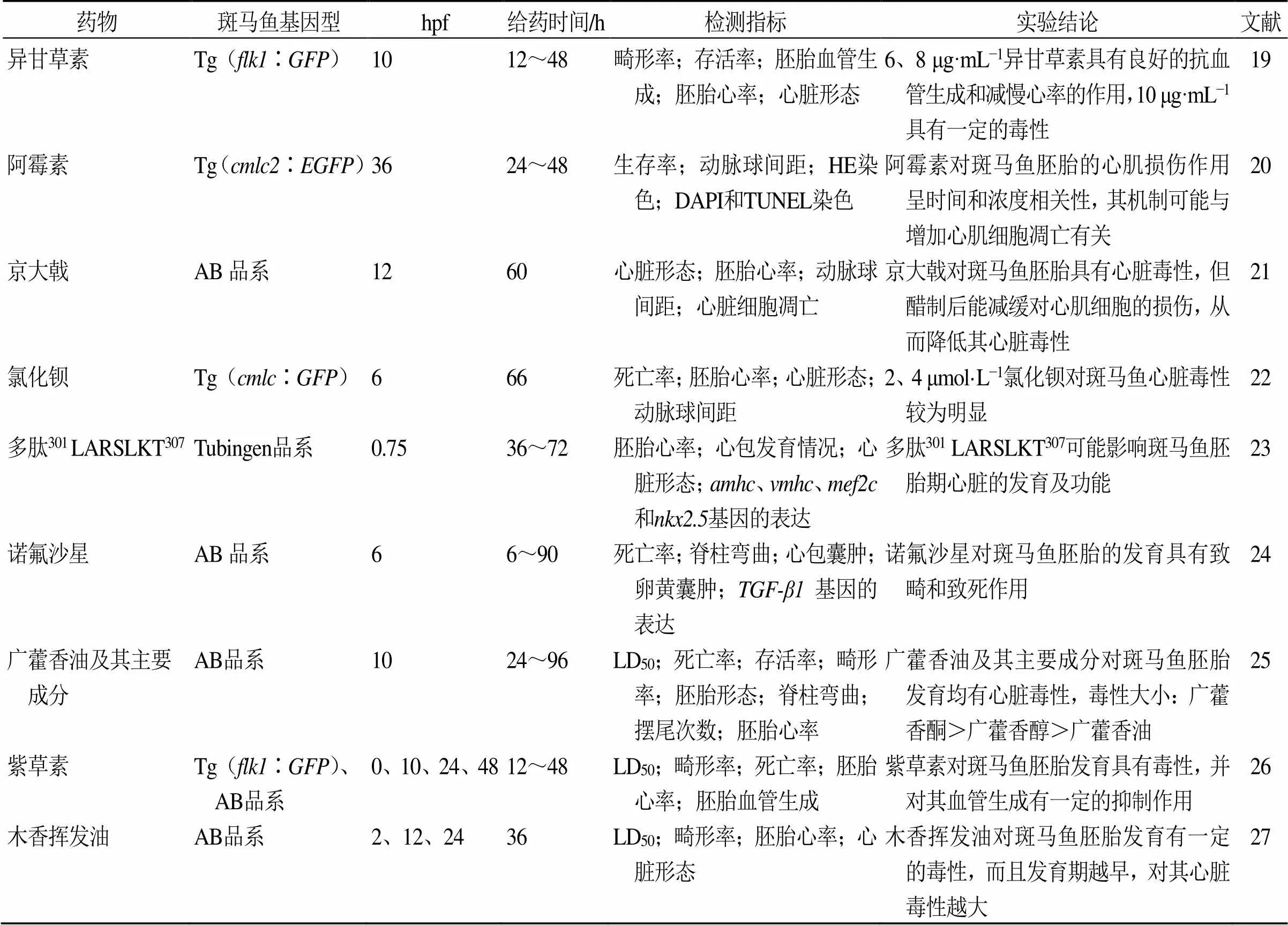
表1 斑马鱼在药物心血管毒性研究中的应用
TGF-β1-转化生长因子-β1 LD50-半数致死量
TGF-β1-transforming growth factor-β1 LD50-median lethal dose
2 评估药物的肝脏毒性
2.1 斑马鱼评估肝脏毒性的优势
药物性肝损伤已逐渐变成临床医学和新药研发中的一个重大挑战。因此,寻找新的模型来预测潜在治疗药物是否导致药物性肝损伤迫在眉睫。研究表明,斑马鱼肝脏在28 hpf时开始发芽,在72 hpf时被血液灌流并具有生理功能,在肝脏的形成过程中,其通体透明,易于观察[28-30]。有研究显示,斑马鱼的器官、生长因子和基因的表达、肝细胞组成、功能、信号和对损伤的反应等方面与高等脊椎动物有很多相似之处[31-32],使其成为检测药物肝毒性和研究其肝毒性机制的重要手段。将胚胎或幼鱼暴露,通过观察肝脏表型、特殊染色处理或生化指标检测等手段,可直接或间接探究药物对斑马鱼肝脏的影响。此外,采用肝脏荧光转基因斑马鱼,如Tg(∶)、Tg(∶)等作为模型,是评价肝脏毒性的又一手段,通过斑马鱼整体图像的分析技术,对肝脏面积大小和肝脏荧光强度进行综合定量分析,快速、系统的评价药物的肝脏毒性作用[33]。因此,斑马鱼作为药物肝脏毒性筛选的模式生物,也具有重要的意义。
2.2 药物对肝脏毒性的影响
段亚辉等[34]采用斑马鱼模型比较款冬花、叶的肝脏毒性,观察款冬花和叶给药后3 d对健康AB系及转基因系斑马鱼肝、肾形态、肝脏的荧光面积、肝脏丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST),结果显示款冬花和叶对斑马鱼肝脏生化指标无显著影响,但款冬花1.5 mg/mL组斑马鱼肝脏荧光面积减小,提示款冬花对肝脏产生一定的毒性,款冬叶未表现出明显的肝毒性。全云云等[35]首次用肝脏荧光转基因斑马鱼Tg(∶)对何首乌中的18种成分进行了肝脏毒性研究,检测斑马鱼肝脏表型、面积、荧光强度、肝体比和病理情况等指标,结果发现,何首乌肝毒性的物质基础可能是由蒽醌类化合物介导,且以结合蒽醌为主,同时发现芦荟大黄素和芦荟大黄素-8--葡萄糖苷对斑马鱼体内ALT、AST、谷胱甘肽(glutathione,GSH)和总胆红素(total bilirubin,TBIL)水平、肝脏组织病理等影响较大,可能是肝毒性主要物质基础[36]。此外,吡嗪酰胺、香加皮、芫花等对斑马鱼肝脏毒性作用,也取得了一定的成果[37-40]。见表2。
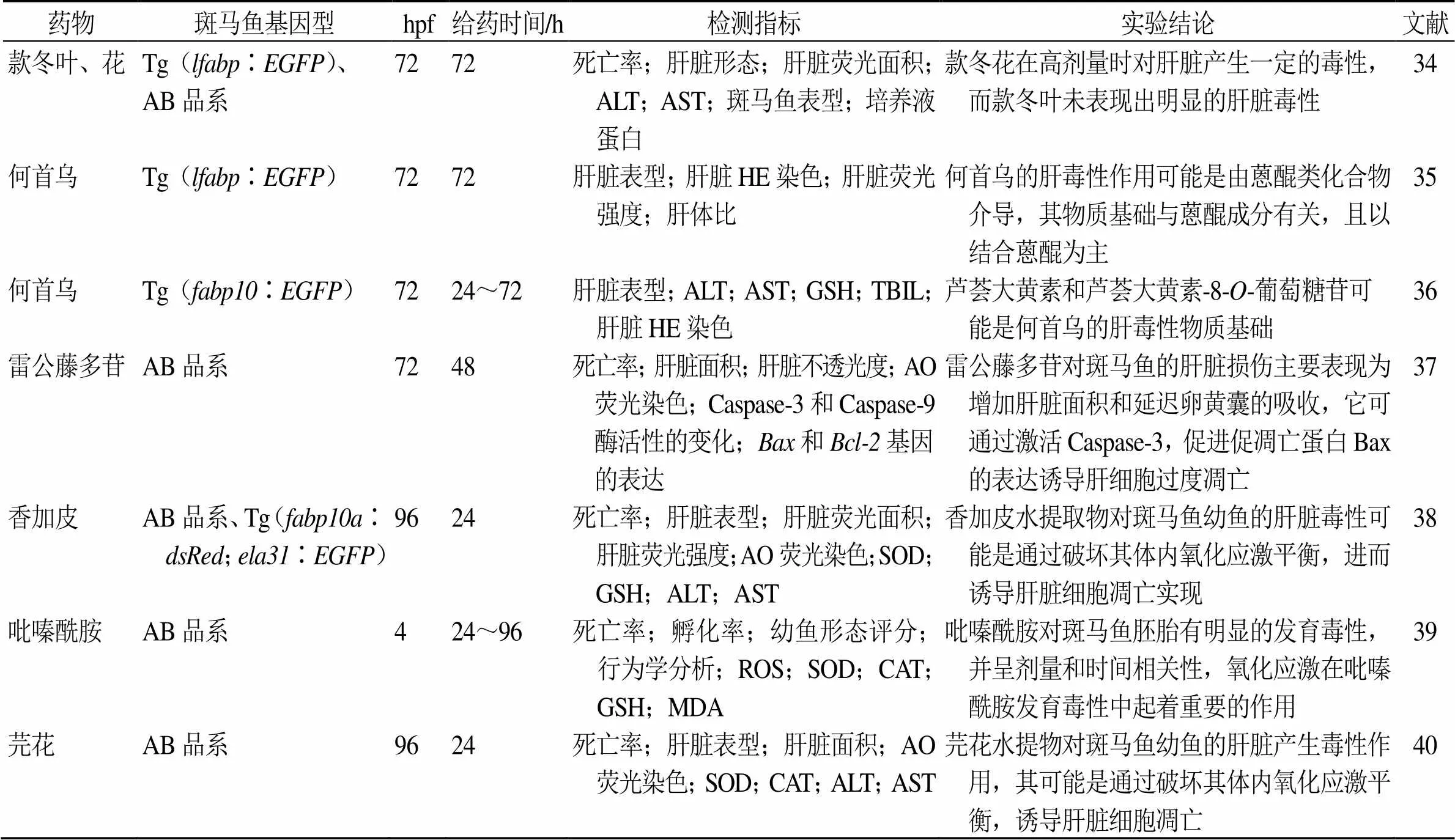
表2 斑马鱼在药物肝脏毒性研究中的应用
Caspase-3-半胱氨酸蛋白酶-3 Bax-Bcl-2关联X蛋白 Bcl-2-B细胞CLL/淋巴瘤2 SOD-超氧化物歧化酶 ROS-活性氧 CAT-过氧化氢酶 MDA-丙二醛
Caspase-3-cysteine protease 3 Bax-Bcl-2-associated X protein Bcl-2-B-cell CLL/lymphoma 2 SOD-superoxide dismutase ROS-reactive oxygen species CAT-catalase MDA-malondialdehyde
2.3 药物对斑马鱼肝脏毒性的作用机制
付晓春等[37]考察雷公藤多苷对斑马鱼肝脏损伤的表型及对肝细胞凋亡的影响,结果显示雷公藤多苷383、417 g/mL时给药24~48 h显著性增加斑马鱼的卵黄囊面积、增加肝脏面积和延迟卵黄囊的吸收。雷公藤多苷42.5、128、383 g/mL连续给药48 h后可观察到斑马鱼肝细胞凋亡明显增加,Caspase-3蛋白活性增加,促凋亡蛋白Bax的表达量显著增加,但Caspase-9蛋白的活性以及基因的表达未见明显改变。提示雷公藤多苷的肝毒性机制与Caspase-3蛋白激活,促肝细胞过度凋亡有关。Quan等[41]用Tg(∶)型斑马鱼研究芦荟大黄素的肝毒性作用及其潜在的毒性机制,结果发现芦荟大黄素的肝毒性机制与核因子κB(nuclear factor kappa-B,NF-κB)蛋白的炎症通路和基因的凋亡通路的激活有关。
3 评估药物的肾脏毒性
3.1 斑马鱼评估肾脏毒性的优势
肾脏是人和高等动物主要的排泄器官,主要滤过血液中的杂质、维持体液和电解质的平衡、药物代谢等,因此肾脏容易成为药物毒性物质累积并引发急性损伤的靶器官。斑马鱼胚胎在24 hpf内形成,具有由2个肾单位组成的解剖学上简单的肾上腺,其肾单位结构、功能和分子组成与人类肾脏高度相似[42-43],具有排泄水和维持渗透的功能[44],故近年来在肾脏发育和肾脏疾病研究中的应用进展有了巨大的增长[45-46]。渗透压调节紊乱易损伤斑马鱼肾脏,使其肾脏出现不同程度的水肿、组织形态改变等,可通过显微观察或组织病理切片观察肾脏异常,还可通过荧光显微镜观察转基因斑马鱼肾脏的荧光面积,评价肾脏损伤情况。快速、高通量筛选是斑马鱼作为肾脏毒性研究工具的重要优势。
3.2 药物对肾脏毒性的影响
Hentschel等[47]利用肾毒性药物第1次成功地构建了斑马鱼急性肾损伤模型,在50、72 hpf的斑马鱼胚胎心脏静脉窦内注射庆大霉素或顺铂引起严重的肾小管重吸收功能障碍。梁锦锋等[48]利用斑马鱼模型评价注射用盐酸万古霉素和厄贝沙坦片的肾毒性,结果发现万古霉素在注射剂量为16.4 ng/尾时,斑马鱼发育正常,未见明显的毒性,注射剂量在54.7~273 ng/尾,有明显的肾毒性。厄贝沙坦在8.3~91 μg/mL时,斑马鱼肾脏均发育正常,未见肾毒性。此外,也有关于中药对斑马鱼肾毒性的相关研究。研究表明,款冬花和款冬叶中含有毒性物质吡咯里西丁生物碱[49]。段亚辉等[34]通过款冬花和叶给药后3 d对健康AB系及转基因系斑马鱼的肾形态、表型和培养液蛋白量水平进行观察,评价药物肾脏毒性,结果显示各给药组斑马鱼形态无明显的改变,全身或局部未出现水肿,培养液上清中也无蛋白,提示斑马鱼肾小球滤过功能正常,药物对斑马鱼肾脏无明显毒性。说明斑马鱼可作为药物肾毒性的筛选工具。
3.3 药物对斑马鱼肾脏毒性的作用机制
Gorgulho等[50]采用10%庆大霉素、扑热息痛和替诺福韦对斑马鱼幼鱼肾脏的影响进行观察,结果显示庆大霉素和扑热息痛降低肾清除率,扑热息痛和替诺福韦扩大近端小管,其肾毒性机制与线粒体改变有关,包括变形、线粒体肿胀、嵴断裂和(或)基质颗粒丢失。王雪等[51]采用Tg(∶)转基因斑马鱼研究马兜铃酸的肾毒性,发现马兜铃酸40~80 μmol/L处理后斑马鱼的肾出现肾小球囊性膨胀、结构疏松、前肾管上皮细胞细胞排列松散、紊乱及管腔扩张样改变,qPCR检测发现20 μmol/L马兜铃酸处理24 h后nephrin蛋白(nephrin表达于肾小球足细胞,其与裂孔隔膜的形成相关)表达显著降低,表明马兜铃酸诱发肾损伤的原因可能是肾小球足细胞的功能变化。以上结果说明斑马鱼是研究药物对于肾毒性作用的良好模型,并可以利用斑马鱼模型进一步研究药物肾毒性的相关研究。
4 评估药物的神经毒性
4.1 斑马鱼评估神经毒性的优势
随着人口老龄化,神经退行性疾病的发生率也逐渐增加。近些年,研究人员发现斑马鱼作为模式生物进行药物神经毒性研究评估较其他模型生物有不可比拟的优势。斑马鱼的中枢神经系统排列、神经形成的过程和具体的机制以及对药物的反应与其他脊椎动物相似,且很多神经退行性疾病蛋白与人类同源[52]。尽管斑马鱼的神经系统简单,但可以支配复杂的生理活动,还能够对其进行运动、学习和记忆等相关评价[53]。因此,斑马鱼作为脊椎动物模型被广泛应用于筛选神经系统疾病药物和某些药物神经毒性的研究评估[54-55]。模式动物斑马鱼的死亡率、孵化率、半数致死浓度(lethal concentration 50,LC50)、斑马鱼幼鱼总移动距离和平均速度是评价药物神经毒性的主要指标。
4.2 药物对神经毒性的影响
二甲基亚砜(dimethyl sulfoxide,DMSO)被称为“万能溶剂”,在斑马鱼实验中广泛被用来助溶某些实验试剂[56],但目前关于DMSO在斑马鱼体内的神经毒性报道较少。甘津凡等[57]用0.5%、0.8%、2.5% DMSO对Tg(∶)斑马鱼胚胎及多巴胺能神经元发育的影响进行了研究,其结果发现DMSO会引起斑马鱼神经毒性,造成间脑多巴胺能神经元丢失及细胞增殖减少,导致胚胎发育障碍。尚楠等[58]将6 hpf的斑马鱼胚胎暴露于不同浓度氯丙嗪和丙戊酸钠中,结果显示氯丙嗪质量浓度>4.0 mg/L、丙戊酸钠质量浓度>2.0 mg/L可引起斑马鱼胚胎出现浓度相关性死亡;氯丙嗪和丙戊酸钠质量浓度达到2.0 mg/L时可显著降低斑马鱼幼鱼总移动距离和平均速度,且丙戊酸钠毒性大于氯丙嗪。曹建斌等[59]观察丙泊酚5、10、20 μg/mL对斑马鱼胚胎运动神经元发育的影响,结果显示丙泊酚5 μg/mL组胚胎整体形态发育正常,但运动神经元发育受到抑制,丙泊酚10、20 μg/mL组胚胎发育停滞在原肠胚时期。提示丙泊酚暴露可抑制斑马鱼运动神经元的发育。刘静等[60]研究牛黄镇惊丸对斑马鱼胚胎发育的影响,结果显示质量浓度低于200 μg/mL时,未见胚胎发育异常。质量浓度高于200 μg/mL时,胚胎头眼发育较小,瞳孔无色;心脏畸形、心率较弱、血流受阻;尾干扭曲,卵黄囊延伸结构变粗,脊索变细等。说明牛黄镇惊丸质量浓度大于200 μg/mL时对斑马鱼胚胎的神经系统、心血管系统和骨骼等发育均有影响。
4.3 药物对斑马鱼神经毒性的作用机制
王翀昊等[61]以斑马鱼为动物模型研究乌头碱0.1、0.5、1、10、100 μmol/mL的神经毒性并初步探索其神经毒性的致病机制,结果发现乌头碱浓度大于0.5 μmol/mL时可呈剂量相关性的显著性降低斑马鱼游泳活力、幼鱼的肌节长度,抑制Rohon- Beard神经元的生理性凋亡,推测其神经毒性与抑制乙酰胆碱酯酶活性有关。但有研究认为,药物的神经毒性机制与提高乙酰胆碱酯酶(acetyl cholinesterase,AChE)活力有关。朱璧然等[62]研究氯硝柳胺5、10、20、40、80 μg/L对斑马鱼幼鱼的神经毒性,结果显示氯硝柳胺40、80 μg/L处理幼鱼存活率降低、畸形率增加、运动速度降低,且幼鱼微球蛋白前体(microglobulin precursor,)和α微球蛋白mRNA表达降低、AChE活力增加。顾杰等[63]采用幼鱼染毒、运动行为学测试和胚胎整条原位杂交等实验以及荧光定量PCR手段,来研究双酚AP(bisphenol AP,BPAP)和双酚AF(bisphenol AF,BPAF)对斑马鱼早期神经发育和行为的影响,发现BPAP和BPAF可扰乱斑马鱼运动轨迹,降低平均运动速度和移动距离,使其出现呆滞现象,推测其神经毒性机制与抑制斑马鱼神经发育关键基因和突触蛋白基因(synapsin ΙΙa,)的表达有关。王雪等[64]研究冈田酸0.05、0.10、0.20 μmol/L对斑马鱼幼鱼神经行为功能的影响,结果显示0.05、0.10 μmol/L冈田酸处理后幼鱼存活率、游动轨迹无明显差异。但0.20 μmol/L冈田酸处理后幼鱼存活率、游动活力、游动距离明显降低,呆滞时间明显延长,且幼鱼体内蛋白磷酸酶2A(protein phosphatase 2A,)表达水平明显下调,α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,)基因表达水平则无明显改变。说明冈田酸的神经毒性与基因相关。
5 评估药物的脾脏毒性
脾脏是斑马鱼重要的免疫器官,主要起调控免疫作用,在对抗外来抗原方面至关重要。郑美娜等[65]探索香泽兰总黄酮对斑马鱼脾脏显微组织结构的毒性作用结果发现,随着香泽兰总黄酮水触媒染毒浓度的增加,斑马鱼脾脏显微组织结构出现了不同程度的病变,主要表现含铁血黄素沉着增多,脾窦扩张,脾脏内淋巴细胞增多,血细胞核浓缩、溶解,甚至导致脾脏坏死。说明模式生物斑马鱼是可以用来作为药物脾脏毒性研究评估的实验模型。
6 评估药物的急性毒性
6.1 斑马鱼评估药物急性毒性的优势
安全性和有效性是药物的两大基本属性,而我国传统中药,成分复杂、配伍多样,为避免临床使用中的不良反应,对药物进行临床前毒性评价和安全性评估显得尤为重要。急性毒性实验是评价药物安全性的主要指标,对阐明药物的毒性作用和探索其毒性靶器官具有重大意义[66]。与其他模型动物相比,斑马鱼具有发育快、易获取、易观察、易检测等显著的优势,其胚胎也被广泛应用于药物早期急性毒性研究评估。在斑马鱼急性毒性试验中,常选用LC50来表示该药物的急性毒性大小。
6.2 药物对急性毒性的影响
陈宏降等[67]研究鱼腥草地上部分、鱼腥草根茎、三白草地上部分、三白草根茎的95%乙醇提取物对斑马鱼成鱼和胚胎的急性毒性,发现4种药物的LD50分别为2.85、10.40、2.54、1.19 mg/L,且致畸主要表现为心包和卵黄囊水肿,提示这4种药物的急性毒性主要体现在心脏。熊关庆等[68]研究了和厚朴酚0.1、0.2、0.4、0.6、0.8 mg/L对斑马鱼的毒性损伤,发现和厚朴酚处理96、72、48、24 h后LC50分别为(0.530±0.014)、(0.679±0.013)、(0.758±0.012)、(0.816±0.01)mg/L,其安全浓度为(0.264±0.003)mg/L。和厚朴酚处理斑马鱼后虽未出现明显的临床病理变化,但组织病理学显示斑马鱼的鳃和脑出现充血,还可见鳃呼吸上皮坏死,提示鳃和脑可能是和厚朴酚对斑马鱼的主要毒性靶器官。林青华等[69]通过比较槟榔不同炮制品对斑马鱼的LC50值及其生物碱、鞣质类成分的含量,探讨槟榔的毒性成分,发现生槟榔、炒槟榔和焦槟榔对斑马鱼幼鱼的LC50值分别为29.74、32.47、40.03 μg/mL,水提物中总生物碱的含量依次为生槟榔>炒槟榔>焦槟榔,总鞣质含量依次为炒槟榔>生槟榔>焦槟榔,提示炒槟榔、焦槟榔的急性毒性较生槟榔低,且生物碱类成分可能是其毒性成分。费倩倩等[70]采用代谢组学的手段研究三七总皂苷给药1 d后对Tuebingen品系斑马鱼胚胎急性毒性作用及可能机制,结果表明,随着三七总皂苷给药时间的延长,斑马鱼幼鱼内源性代谢物的改变越加明显,且呈现出时间相关性代谢轨迹,提示三七总皂苷给药剂量越大,斑马鱼幼鱼出现毒性症状的时间会大大缩短,且给药时间越长,体内代谢更紊乱。揭示了三七总皂苷过量所出现的急性毒性可能与脂质代谢、氨基酸代谢以及能量代谢等代谢通路的紊乱有关。此外,1-萘酚、醋酸甲羟孕酮、姜黄素等对斑马鱼急性毒性研究也取得了一定的成果[70-76]。斑马鱼在药物急性毒性中的研究见表3。
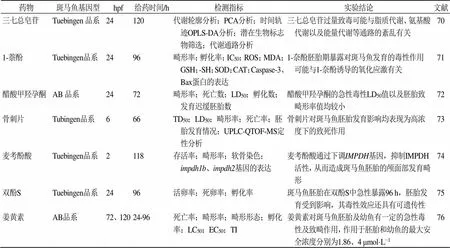
表3 斑马鱼在药物急性毒性中的研究
TD50-半数中毒剂量 EC50-半数致畸浓度 IC50-半数抑制浓度 impdh1b-IMP(次黄苷单磷酸)脱氢酶1b impdh2-IMP(次黄苷单磷酸)脱氢酶2 IMPDH-IMP(次黄苷单磷酸)脱氢酶 TI-致畸指数
TD50-median toxic dose EC50-medianteratogenic concentration IC50-median inhibiting concentration impdh1b-IMP (inosine monophosphate) dehydrogenase 1b impdh2-IMP (inosine monophosphate) dehydrogenase 2 IMPDH-IMP (inosine monophosphate) dehydrogenase TI-Teratogenic Index
7 结语及展望
斑马鱼作为一个整体的模型生物,具有易于养殖、给药量少、成本廉价、毒性评价指标多样化等特点,其胚胎和幼鱼可作为高通量药物筛选的实验模型,既弥补了细胞模型的单一性,又弥补了啮齿动物模型的长时间性,符合动物福利的“3R”(减少、替代和优化)理论,被广泛应用于药物和环境污染物的毒性研究,特别是对我国具有分类庞杂、种类繁多和成分复杂的传统单味中药、复方和中成药的毒性作用评估。此外,模式生物斑马鱼在药物活性物质筛选研究、疾病机制研究、药物体内代谢研究和药物作用机制研究等方面也发挥着越来越重要的作用。
总结文献资料显示,药物毒性研究主要集中于斑马鱼心血管、肝脏、肾脏、神经、脾脏等方面,其主要表现为死亡率和畸形率增加、器官形态和表型改变、可能伴有水肿等发生等。部分研究从整体情况探讨了药物的器官毒性,少部分研究探索了药物毒性机制,总结发现其主要影响细胞凋亡、炎症以及特异性表达蛋白或酶等,影响斑马鱼胚胎或幼鱼的发育从而产生一定的毒性。
目前斑马鱼在中药毒性研究中的应用还处于探索阶段。在已有的很多文献报道中,采用斑马鱼对中药、中药复方或中成药进行毒性及其机制研究时,大部分都只是针对中药里面的全部成分或个别单体化合物进行毒性检测。而中药或复方中包含成百上千种的化合物,各化合物之间可能通过多种途径、多个靶点以及多个环节对机体造成不可逆转的毒性作用。同时,在中药或复方的相关研究中,应考虑斑马鱼模型是否具有代表性以及所测定的指标是否具有针对性。如何更简单、更高效的利用模式生物斑马鱼明确某些中药或复方中的毒性作用、作用靶点以及具体的毒性机制还需要更进一步的拓展研究。通常情况下,器官毒性相关指标的评价都在整体组织处理后获得的,除神经系统毒性研究有少量特异性指标,其他器官毒性的特异性指标有待进一步发现,故在此后的研究中可考虑采用蛋白组、转录组、代谢组等多组学技术研究分子信号通路探索药物毒性作用靶点或机制。
尽管斑马鱼模型在评估药物毒理学方面表现出独有的优势,但是由于与人类物种间的差异,斑马鱼模型也存在一定的局限性。(1)在解剖结构上,斑马鱼血管直径30~50 μm,且血液量少,在检测血压及采血方面难以实现;斑马鱼的呼吸系统与哺乳动物大不相同,且内脏形成较哺乳动物晚,一般发生于体节发育中期;与哺乳动物由单一始基发育形成不同,斑马鱼的消化系统由不同始基形成,故目前对斑马鱼呼吸和消化系统的药物筛选研究较为困难;(2)在基因层面上,斑马鱼基因虽与人类基因高度相似,但也存在差异,不少基因功能与人体差异明显,为更好探究不同基因的作用,可采用斑马鱼配合其他动物模型,特别是哺乳动物(如小鼠等)模型进行进一步的验证。同时,斑马鱼实验动物未实现标准化,没有统一的规格和质控方法,故药物研究结果的稳定性和重复性值得研究者思考。
此外,目前只有少量的文献报道过关于斑马鱼胰腺、脂质代谢和免疫系统方面的毒性作用,笔者猜测其可能的原因是这些器官和系统的代谢紊乱很难在光学显微镜下被观察到[77]。然而,人类的这些器官和系统是常被怀疑为毒性物质暴露的靶点,这些靶点可能与人类某些疾病的发生有密切联系。因此,这些亟待解决的疑难问题依旧是今后科研人员重点研究的对象。
综上所述,在众多的模型动物中,斑马鱼作为一种评估药物安全性与毒性最为高效、快速、便捷的方法,可以阐明药物具体的毒性作用及其多组分多靶点的毒性作用机制,目前已受到了医药学界和科研学界的广泛关注。随着人类社会科学技术的不断发展和创新,这一新兴的模式生物在药物毒性研究领域将会有更加广阔的应用前景,同时也为推动中药的研究与开发提供新的思路和新的平台。
利益冲突 所有作者均声明不存在利益冲突
[1] Howe K, Clark M D, Torroja C F,. The zebrafish reference genome sequence and its relationship to the human genome [J]., 2013, 496(7446): 498-503.
[2] Gratacap R L, Wheeler R T. Utilization of zebrafish for intravital study of eukaryotic pathogen-host interactions [J]., 2014, 46(1): 108-115.
[3] Lin C Y, Chiang, Tsai H J. Zebrafish and Medaka: New model organisms for modern biomedical research [J]., 2016, 23: 19.
[4] Laale H W. The biology and use of zebrafish, Brachydanio rerio in fisheries research. A literature review [J]., 1977, 10(2): 121-173.
[5] Hermsen S A B, van den Brandhof E J, van der Ven L T M,. Relative embryotoxicity of two classes of chemicals in a modified zebrafish embryotoxicity test and comparison with theirpotencies [J]., 2011, 25(3): 745-753.
[6] He J H, Gao J M, Huang C J,. Zebrafish models for assessing developmental and reproductive toxicity [J]., 2014, 42: 35-42.
[7] Péry A R, Devillers J, Brochot C,. A physiologically based toxicokinetic model for the zebrafish[J]., 2014, 48(1): 781-790.
[8] Streisinger G, Walker C, Dower N,. Production of clones of homozygous diploid zebra fish () [J]., 1981, 291(5813): 293-296.
[9] Steele S L, Prykhozhij S V, Berman J N. Zebrafish as a model system for mitochondrial biology and diseases [J]., 2014, 163(2): 79-98.
[10] 王成, 龚莉虹, 郭朝成, 等. 模式生物斑马鱼在中药药效物质筛选中的应用进展 [J]. 中草药, 2019, 50(24): 6125-6134.
[11] de Abreu M S, Giacomini A C V V, Genario R,. Neuropharmacology, pharmacogenetics and pharmacogenomics of aggression: The zebrafish model [J]., 2019, 141: 602-608.
[12] Sieber S, Grossen P, Bussmann J,. Zebrafish as a preclinicalscreening model for nanomedicines [J]., 2019, 151/152: 152-168.
[13] Guth B D. Preclinical cardiovascular risk assessment in modern drug development [J]., 2007, 97(1): 4-20.
[14] Rocke J, Lees J, Packham I,. The zebrafish as a novel tool for cardiovascular drug discovery [J]., 2009, 4(1): 1-5.
[15] Tu S, Chi N C. Zebrafish models in cardiac development and congenital heart birth defects [J]., 2012, 84(1): 4-16.
[16] Felker A, Prummel K D, Merks A M,. Continuous addition of progenitors forms the cardiac ventricle in zebrafish [J]., 2018, 9: 2001.
[17] Kitambi S S, Nilsson E S, Sekyrova P,. Small molecule screening platform for assessment of cardiovascular toxicity on adult zebrafish heart [J]., 2012, 12: 3.
[18] Milan D J, MacRae C A. Zebrafish genetic models for arrhythmia [J]., 2008, 98(2/3): 301-308.
[19] 何俊霖, 于思, 曹治兴, 等. 异甘草素对斑马鱼胚胎发育、血管生成和心脏的影响 [J]. 四川动物, 2018, 37(6): 672-677.
[20] 赵慧, 费飞, 丛丽烨, 等. 阿霉素诱导的斑马鱼心肌损伤模型研究 [J]. 上海中医药大学学报, 2019, 33(1): 50-55.
[21] 曹雨诞, 张楷承, 姚芳, 等. 京大戟醋制前后对斑马鱼胚胎心脏的毒性 [J]. 中国实验方剂学杂志, 2019, 25(24): 73-77.
[22] 石亚楠, 姚磊, 王佑华, 等. 氯化钡对斑马鱼心脏毒性的初步研究 [J]. 中国药理学通报, 2019, 35(1): 145- 146.
[23] 胡银, 刘恒, 严湘芸, 等. 多肽301LARSLKT307对斑马鱼胚胎早期心脏发育的影响 [J]. 安徽医科大学学报, 2019, 54(5): 678-684.
[24] 王冬梅, 谷从友, 刘铜, 等. 诺氟沙星对斑马鱼胚胎发育的毒性作用及对TGF-β1的影响 [J]. 生物技术通报, 2016(1): 169-173.
[25] 杨雨婷, 何育霖, 张雪, 等. 广藿香油及其主要成分对斑马鱼胚胎发育毒性的比较研究 [J]. 中国民族民间医药, 2015, 24(21): 14-16.
[26] 何育霖, 杨雨婷, 何贝轩, 等. 紫草素对斑马鱼胚胎毒性和血管抑制作用 [J]. 中成药, 2016, 38(2): 241-245.
[27] 何贝轩, 杨雨婷, 何育霖, 等. 木香挥发油对斑马鱼胚胎发育毒性的初步研究 [J]. 中华中医药杂志, 2016, 31(11): 4714-4716.
[28] Wallace K N, Yusuff S, Sonntag J M,. Zebrafish hhex regulates liver development and digestive organ chirality [J]., 2001, 30(3): 141-143.
[29] Field H A, Ober E A, Roeser T,. Formation of the digestive system in zebrafish. I. liver morphogenesis [J]., 2003, 253(2): 279-290.
[30] Korzh S, Pan X F, Garcia-Lecea M,. Requirement of vasculogenesis and blood circulation in late stages of liver growth in zebrafish [J]., 2008, 8(1): 84.
[31] Menke A L, Spitsbergen J M, Wolterbeek A P,. Normal anatomy and histology of the adult zebrafish [J]., 2011, 39(5): 759-775.
[32] Tao T, Peng J. Liver development in zebrafish (Danio rerio) [J]., 2009, 36(6): 325-334.
[33] 冯胜虎, 韩铭, 成军. 模式生物斑马鱼在肝脏疾病研究中的应用 [J]. 诊断学理论与实践, 2015, 14(4): 389- 392.
[34] 段亚辉, 张云, 王雪, 等. 基于模式生物斑马鱼的款冬叶肝肾毒性比较研究 [J]. 中草药, 2019, 50(3): 669- 674.
[35] 全云云, 周忆梦, 刘美辰, 等. 斑马鱼模型评价何首乌中18种成分的肝脏毒性 [J]. 天然产物研究与开发, 2018, 30(5): 744-752.
[36] 全云云, 周忆梦, 刘美辰, 等. 斑马鱼模型筛选何首乌肝毒性的物质基础 [J]. 中国实验方剂学杂志, 2019, 25(6): 52-57.
[37] 付晓春, 沈小莉, 俞航萍, 等. 雷公藤多苷促进斑马鱼肝细胞凋亡的实验研究 [J]. 中国医院药学杂志, 2019, 39(10): 1032-1038.
[38] 代一航, 赵崇军, 田敬欢, 等. 香加皮水提取物对斑马鱼幼鱼肝脏毒性的初步研究 [J]. 环球中医药, 2017, 10(10): 1161-1166.
[39] 李娟娟, 韩利文, 邱昌辉, 等. 吡嗪酰胺对斑马鱼胚胎发育和氧化应激效应的影响 [J]. 中国抗生素杂志, 2018, 43(11): 1419-1425.
[40] 李二文, 赵崇军, 冯丹, 等. 芫花水提取物对斑马鱼肝脏的毒性作用 [J]. 中华中医药杂志, 2019, 34(4): 1747- 1750.
[41] Quan Y Y, Gong L H, He J L,.induces hepatotoxicity by activating NF-κB inflammatory pathway and P53 apoptosis pathway in zebrafish [J]., 2019, 306: 66-79.
[42] 陈朝红, 刘志红. 模式动物斑马鱼在肾脏疾病研究中的应用 [J]. 肾脏病与透析肾移植杂志, 2016, 25(2): 159-164.
[43] Chambers B E, Wingert R A. Mechanisms of nephrogenesis revealed by zebrafish chemical screen: Prostaglandin signaling modulates nephron progenitor fate [J]., 2019, 143(1): 68-76.
[44] Hill A J, Bello S M, Prasch A L,. Water permeability and TCDD-induced edema in zebrafish early-life stages [J]., 2004, 78(1): 78-87.
[45] Naylor R W, Qubisi S S, Davidson A J. Zebrafish pronephros development [J]., 2017, 60: 27-53.
[46] Drummond I A, Davidson A J. Zebrafish kidney development [J]., 2010, 100: 233-260.
[47] Hentschel D M, Park K M, Cilenti L,. Acute renal failure in zebrafish: A novel system to study a complex disease [J]., 2005, 288(5): F923-F929.
[48] 梁锦锋, 朱勇, 张洪瑶, 等. 斑马鱼模型在药物研发早期肾脏毒性中的应用研究 [J]. 中国比较医学杂志, 2016, 26(9): 30-35.
[49] 陈雪园, 张如松, 杨苏蓓. 款冬花化学成分及药理毒理研究进展 [J]. 亚太传统医药, 2012, 8(1): 173-174.
[50] Gorgulho R, Jacinto R, Lopes S S,. Usefulness of zebrafish larvae to evaluate drug-induced functional and morphological renal tubular alterations [J]., 2018, 92(1): 411-423.
[51] 王雪, 刘可春, 王荣春, 等. 马兜铃酸对斑马鱼胚胎肾毒性作用 [J]. 动物学杂志, 2015, 50(5): 773-779.
[52] Laird A S, Mackovski N, Rinkwitz S,. Tissue- specific models of spinal muscular atrophy confirm a critical role of SMN in motor neurons from embryonic to adult stages [J]., 2016, 25(9): 1728-1738.
[53] Cornet C, di Donato V, Terriente J. Combining zebrafish and CRISPR/Cas9: Toward a more efficient drug discovery pipeline [J]., 2018, 9: 703.
[54] Khan K M, Collier A D, Meshalkina D A,. Zebrafish models in neuropsychopharmacology and CNS drug discovery [J]., 2017, 174(13): 1925- 1944.
[55] 陈香平, 黄长江, 陈元红, 等. 铅和得克隆联合暴露对斑马鱼胚胎的神经毒性作用 [J]. 生态毒理学报, 2017, 12(3): 309-316.
[56] Kais B, Schneider K E, Keiter S,. DMSO modifies the permeability of the zebrafish () chorion- implications for the fish embryo test (FET) [J]., 2013, 140/141: 229-238.
[57] 甘津凡, 吴永梅, 李淑蓉, 等. 不同浓度的二甲基亚砜对斑马鱼胚胎及其多巴胺能神经元发育的影响 [J]. 第三军医大学学报, 2019, 41(16): 1538-1544.
[58] 尚楠, 张勤丽, 候美娟, 等. 药物神经发育毒性比较及筛查模型建立 [J]. 中国医院药学杂志, 2020, 40(7): 775-780.
[59] 曹建斌, 朱敏淑, 曹东航, 等. 丙泊酚对斑马鱼胚胎运动神经元发育的影响 [J]. 浙江医学, 2019, 41(10): 1010-1012.
[60] 刘静, 张靖溥, 孟杰, 等. 牛黄镇惊丸对斑马鱼胚胎发育的影响 [J]. 药物评价研究, 2017, 40(7): 931-934.
[61] 王翀昊, 王心童, 朱娜. 乌头碱在斑马鱼胚胎和幼鱼发育过程中的神经毒性作用 [J]. 中国实验诊断学, 2018, 22(8): 1432-1435.
[62] 朱璧然, 李博, 冯秋珍, 等. 氯硝柳胺对斑马鱼幼鱼的神经毒性研究 [J]. 中国寄生虫学与寄生虫病杂志, 2019, 37(5): 588-592.
[63] 顾杰, 王宏烨, 廖振东, 等. 双酚AP和双酚AF对斑马鱼的早期神经发育毒性作用研究 [J]. 环境与职业医学, 2019, 36(1): 11-16.
[64] 王雪, 刘可春, 杨学亮, 等. 冈田酸对斑马鱼幼鱼神经行为功能的影响 [J]. 实验动物与比较医学, 2020(3): 190-195.
[65] 郑美娜, 刘金荣, 吴雄宇, 等. 香泽兰总黄酮对斑马鱼脾脏毒性病理组织学作用 [J]. 中兽医医药杂志, 2012, 31(1): 5-8.
[66] 赵崇军, 田敬欢, 王金凤, 等. 斑马鱼在中药研究中的应用进展 [J]. 中草药, 2015, 46(17): 2635-2648.
[67] 陈宏降, 刘佳楠, 阮洪生, 等. 鱼腥草、三白草地上部分和根茎醇提物对斑马鱼成鱼和胚胎的毒性研究 [J]. 中成药, 2020, 42(6): 1633-1636.
[68] 熊关庆, 冯杨, 杨玉涔, 等. 厚朴酚对斑马鱼()的急性毒性病理损伤评估 [J]. 四川农业大学学报, 2020, 38(1): 105-112.
[69] 林青华, 屈文佳, 秦华珍, 等. 槟榔不同炮制品对斑马鱼急性毒性比较研究 [J]. 亚太传统医药, 2020, 16(2): 9-11.
[70] 费倩倩, 韦英杰, 汪晶, 等. 基于代谢组学研究三七总皂苷在斑马鱼幼鱼中的急性毒性机制 [J]. 中国中药杂志, 2019, 44(17): 3798-3805.
[71] 任平平, 舒莉萍, 王一慧, 等. 1-萘酚胚胎期暴露对斑马鱼发育的毒性作用 [J]. 第三军医大学学报, 2019, 41(14): 1321-1327.
[72] 泰刚, 张蕻, 赵思俊, 等. 醋酸甲羟孕酮对斑马鱼急性毒性和生殖毒性作用研究 [J]. 中国药物与临床, 2017, 17(10): 1451-1453.
[73] 刘静, 张靖溥, 孟杰, 等. 骨刺片对斑马鱼胚胎发育的急性毒性研究 [J]. 药物评价研究, 2018, 41(10): 1804-1809.
[74] 杨迷芳, 马兰, 严冬琳, 等. 麦考酚酸对斑马鱼胚胎颅面部发育的影响 [J]. 口腔医学, 2019, 39(2): 103-107.
[75] 王英红, 徐虹, 孔庆鑫, 等. 双酚S急性暴露对斑马鱼胚胎及子代胚胎发育的毒性效应 [J]. 中国卫生检验杂志, 2019, 29(1): 32-36.
[76] 陈娇娇, 王涛, 王成蹊, 等. 姜黄素对斑马鱼胚胎及幼鱼急性毒性的研究 [J]. 深圳中西医结合杂志, 2017, 27(19): 1-4.
[77] 李盛, 龙鼎新. 斑马鱼在发育毒理学研究中的应用 [J]. 实用预防医学, 2016, 23(6): 762-765.
Research progress on application and mechanism of zebrafish in drug toxicology assessment
LI Hong-yan, XIE Qian, WANG Cheng, LI Jin-xiu, MA Rong, REN Mi-hong, LI Yong, WANG Jia-jun, CHEN Hai, WANG Jian
School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
Compared with other mammals, zebrafish have the characteristics of strong reproduction ability, large reproduction capacity, short life cycle, low breeding cost, and transparent body. The cardiovascular, liver, kidney, nerve, spleen and acute toxicity of zebrafish were reviewed in this paper. The results showed that multiple organs of zebrafish were highly similar to mammals in terms of morphology, gene expression and physiological characteristics, and they have been widely used in drug screening studies. Studies on drug toxicity to zebrafish mainly focus on: increased mortality and malformation rate, changes in the morphology and phenotype of the heart, liver, kidney, spleen and other organs, as well as whether it is accompanied by edema, neurotoxicity, etc.; The toxicity mechanism mainly involves affecting cell apoptosis in organs (p53 pathway), inflammation (NF-κB and interleukin), or proteins, enzymes or mRNA that affect the function of the organ, such as ALT, AST, AChE,, and α tubulin. It shows that the zebrafish model can be used as the most efficient, fast and convenient method for evaluating the safety and toxicity of drugs, elucidating the toxic effects of drugs and their multi-component and multi-target toxic mechanisms, which can provide new ideas for drug toxicology.
zebrafish; drug toxicology; toxicity assessment; safety evaluation; cardiovascular, liver toxicity; kidney toxicity; nerve toxicity; spleen toxicity; acute toxicity
R285.53
A
0253 - 2670(2021)01 - 0278 - 11
10.7501/j.issn.0253-2670.2021.01.033
2020-09-16
国家自然科学基金面上项目(81873023);国家自然科学基金面上项目(81473371)
李红燕(1995—),女,四川阆中人,硕士,研究方向为中药不良反应与合理用药。E-mail: 2390346837@qq.com
王 建(1959—),女,博士生导师,教授,研究方向为中药不良反应与合理用药。E-mail: jianwang08@163.com
[责任编辑 崔艳丽]
