基于肠道菌群研究两亲性嵌段共聚物用于汤剂抑苦的适宜性
2021-01-05林俊芝柯秀梅伍振峰张定堃
林俊芝,李 潘,仇 敏,柯秀梅,韩 丽,杨 明,伍振峰*,张定堃*
基于肠道菌群研究两亲性嵌段共聚物用于汤剂抑苦的适宜性
林俊芝1,李 潘2,仇 敏3,柯秀梅4,韩 丽3,杨 明5,伍振峰5*,张定堃3*
1. 成都中医药大学附属医院 中心实验室,四川 成都 610072 2. 成都市青白江区人民医院,四川 成都 610300 3. 成都中医药大学 西南特色中药资源省部共建国家重点实验室,四川 成都 611137 4. 重庆医科大学中医药学院,重庆 400016 5. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004
从肠道菌群角度,评价两亲性嵌段共聚物用于中药汤剂抑苦的适宜性和安全性。以苦味强烈的盐酸小檗碱(berberine hydrochloride,BH)溶液为模型药物,采用高通量测序技术,对比研究两亲性嵌段共聚物、天然甜味剂(蔗糖)与人工甜味剂(阿斯巴甜)连续给药2周后对大鼠肠道菌群的影响。BH经过两亲性嵌段共聚物、蔗糖、阿斯巴甜掩味后,其物种总数有升高的趋势。两亲性嵌段共聚物不影响BH菌群的多样性与群落构成;蔗糖具有使BH菌群多样性升高的趋势,阿斯巴甜具有使BH菌群多样性降低的趋势。在长期服药条件下,两亲性嵌段共聚物作为汤剂抑苦辅料不干扰药物对肠道菌群的作用,对于儿童用药是一种更为安全的掩味剂。
中药汤剂;抑苦;两亲性嵌段聚合物;肠道菌群;汤剂伴侣开发;小檗碱
中药汤剂普遍苦味重、口感差,严重影响服药的顺应性,尤其是儿童人群难以忍受。这与汤剂中苦味成分多以分子态形式存在、分散度大,能在极短时间内瞬时完成苦味信号传导密切相关[1]。目前,甜味剂是应用最为广泛的矫味剂,包括天然甜味剂与人工甜味剂。在普通家庭中,主要添加大量蔗糖干扰汤剂苦味,个别医院药房有小包装甜菊素提供,但蔗糖与甜菊素均为天然甜味剂,其矫味效果通常是苦味与甜味的复合,对小剂量且苦味不强的药物有效,但对大剂量或苦味强烈的药物效果并不理想。在部分中成药制剂处方中,有使用三氯蔗糖、阿斯巴甜、纽甜等人工甜味剂抑苦的用法[2]。人工甜味剂刺激的甜味感知通路与苦味感知通路相同,常作为抑苦的“特效”物质[3]。但最新研究表明,人工甜味剂可能会引发肠道菌群的紊乱,影响菌群的代谢通路,增加宿主对代谢疾病的易感性,尤其是降低肠道菌群葡萄糖耐受性[4-5]。纽甜还可降低菌群多样性,改变肠道微生物的代谢途径和粪便代谢物的分布,引起多种脂肪酸、脂质和胆固醇升高,苹果酸和甘油酸大量减少[6]。因此,人工甜味剂并不适合长期服用,尤其对于肠道菌群平衡脆弱的儿童群体,可能是威胁其健康的潜在因素[7-8]。
两亲性嵌段共聚物是指存在两种或两种以上结构不同的链段的单一线性分子,可根据需要合成具有特定化学结构、相对分子质量的共聚物,是一种广泛应用且安全性好的辅料[9-10]。课题组前期发现两亲性嵌段共聚物是一种液体制剂的新型苦味掩蔽剂,对于多种结构的苦味成分均有明确的抑苦效果,并可在水中自组装形成胶束,包裹苦味成分的疏水性苦味基团,阻断苦味基团与苦味受体的结合,达到掩蔽苦味的目的;同时,其口服后可在体内降解,对药物药效与体内吸收过程无显著影响[11-12]。但两亲性嵌段共聚物长期给药是否影响肠道菌群的平衡尚不明确,制约了其作为新型抑苦辅料的开发与应用。为此,本实验以苦味强烈的盐酸小檗碱(berberine hydrochloride,BH)溶液为模型药物,采用高通量测序技术,对比研究两亲性嵌段共聚物、天然甜味剂(蔗糖)与人工甜味剂(阿斯巴甜)连续给药2周后对大鼠肠道菌群的影响,以期为两亲性嵌段共聚物进一步的抑苦应用提供科学依据。
1 仪器与材料
1.1 仪器
Tc-Meter 4K-7.2K离心机,美国Topscience公司;Qubit 3.0定量仪,美国Life technologies公司;CF-F9677型PCR扩增仪,美国Coyote Bioscience公司;涡旋振荡器,美国Thermo Fisher公司;Agilent 4200 TapeStation电泳仪,美国Agilent Technology公司;QuantiFluor™-ST蓝色荧光定量系统,美国Promega公司;NovaSeq 6000测序仪,美国Illumina公司;AxyPrep DNA凝胶回收试剂盒,Axygen公司;AM10027磁力架,美国Invitrogen公司;FastPure Gel DNA Extraction Mini Kit,南京诺唯赞生物科技有限公司。
1.2 供试药品
BH,购于中国食品药品检定研究院,批号713- 9003;单甲氧基聚乙二醇-左旋聚乳酸(mPEG2000- PLLA2000),批号2019071415,相对分子质量均为2000,购于济南岱罡生物科技有限公司;阿斯巴甜,批号WMO327DY13,购于上海源叶生物科技有限公司;蔗糖,批号20081113,购于成都科龙化工试剂厂;水为实验室自制超纯水,Milli-Q级别。
1.3 动物
SPF级KM小鼠,雄性,体质量18~22 g,购于四川省中医药科学院实验动物中心,许可证号:SCXK(川)2018-19。实验环境为SPF洁净级屏障系统,室温20~22 ℃,相对湿度40%~70%,12 h明暗交替照明。实验过程中,动物自由饮水、饮食,使用实验动物标准饲料,购于成都达硕生物科技有限公司,许可证号:SCXK(川)2014-0008,实验遵循成都中医药大学附属医院有关实验动物管理和使用的规定,均符合3R原则。
2 方法
2.1 供试品溶液的制备
取BH 0.13 g,精密称定,各4份,分别加入100 mL超纯水超声溶解。按照前期试验结果[10]及甜味剂常用剂量,其中3份分别加入0.16% mPEG 2000-PLLA2000、20%蔗糖、0.6%阿斯巴甜,即得供试品溶液。
2.2 分组及样品采集
SPF级KM雄性小鼠30只,分为5组,每组6只。按体质量随机分为BH组、BH+共聚物组、 BH+蔗糖组、BH+阿斯巴甜组、对照组。SPF级动物房适应性饲养后,ig给药,ig容量0.02 mL/g,每天1次,连续14 d。末次给药后各组小鼠禁食不禁水,无菌条件下采集小鼠新鲜粪便3~5粒,立即放入灭菌后的离心管中,超低温保存,以备肠道菌群分析[13]。
2.3 基因组DNA抽提、PCR扩增和测序
样品微生物多样性测序由上海元莘生物医药科技有限公司完成。利用DNA提取试剂盒提取大鼠粪便的基因组DNA,采用1%琼脂糖凝胶电泳检测抽提的基因组DNA。PCR扩增细菌16S核糖体RNA基因的V3~V4可变区。采用338F 5’-ACTCCTAC GGGAGGCAGCAG-3’,806R 5’-GGACTACHVGG GTWTCTAAT-3’为引物,TransStart Fastpfu DNA Polymerase为扩增酶,在20 μL反应体系(5×FastPfu Buffer 5 μL,2.5 mmol/L dNTPs 2.5 μL,Forward Primer (5 μmol/L) 1 μL,Reverse Primer (5 μmol/L) 1 μL,FastPfu Polymerase 0.5 μL,BSA 0.25 μL,Template DNA 10 ng,ddH2O补至20 μL)中进行扩增,每个样品均进行3次重复扩增。将同一样本的PCR产物混合,采用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。随后构建Illumina PE250文库,上机测序。
根据overlap关系,将Illumina PE250测序得到的PE reads进行拼接,同时对序列质量进行质控和滤过,区分样本后进行OTU(operational taxonomic units)聚类分析和物种分类学分析,相似度为97%。
2.4 菌群的多样性分析
利用OTU聚类结果与R语言工具绘制稀释曲线、Shannon-Wiener曲线、Rank-Abundance曲线与Specaccum物种累积曲线以检测测序深度。其中,随着测序量的增加,稀释曲线的平缓程度反映测序深度对样品中物种的覆盖度。Shannon-Wiener曲线是反映各样本在不同测序量时的微生物多样性。Rank-Abundance曲线表明,样品所含物种的丰富程度和均匀程度。物种的丰富程度呈现于曲线在横轴上的长度,曲线越宽,表示物种的组成越丰富;物种组成的均匀程度呈现于曲线的形状,曲线越平坦,表示物种组成的均匀程度越高。Specaccum物种累积曲线可以判断样本量是否充分,并可以预测样品的物种丰富度。曲线趋于平缓,表示在实验环境中的物种并不会随样本量的增加而显著增多,抽样充分,可以进行数据分析。采用SPSS 20.0统计软件进行α多样性分析,按照0.97的相似性阈值将序列划分为一个物种,比较试验组间OTU、Ace、Chao、Coverage、Shannon、Simpson指数的差异。OTU表示在样品中微生物物种的数量;Ace与Chao指数是对菌群物种的总数评估;Shannon指数主要用来估算样本中微生物多样性,Shannon越大,说明群落多样性越高。Simpson指数描述从一个群落种连续两次抽样所得到的个体数属于同一种的概率,Simpson越大,即种类越均一。
2.5 β多样性分析
样本间的物种或功能的丰度分布差异程度可通过统计学中的距离进行量化分析,使用统计算法Bray-Curtis计算两两样本间距离,通过距离矩阵比较不同样本间物种差异,即β多样性分析,包括主成分分析(principal components analysis,PCA)、主坐标分析(principal coordinate analysis,PCoA)、非度量多维尺度分析(nonmetric multidimensional scaling,NMDS)。
2.6 物种组成与差异菌群分析
基于分类学信息,对各个分类水平上进行群落结构的统计分析。采用Usearch软件和Gold数据库,利用Donovo和Reference结合的方式去除嵌合体,Silva(SSU115)16S细菌和古菌核糖体数据库进行分类学比对。采用LEfSE分析,找出对样本划分产生显著性差异影响的群落或物种。
3 结果
3.1 菌群的多样性分析
利用OTU聚类结果进行测序深度的检测与α多样性分析,如图1所示,30个样本的稀释曲线均趋于平缓,且大部分样品达到平台期,可以认为测序深度已经基本覆盖到样品中所有的物种。Shannon-Wiener曲线均趋向平坦,表明测序数据量足够大,可以反映样品中绝大多数的微生物物种信息。Rank-Abundance样本曲线的延伸终点的OTU值均大于200,物种数量较多,且曲线均平滑下降,表明样本的物种多样性较高。Specaccum物种累积曲线趋于平缓,表示在实验环境中的物种并不会随样本量的增加而显著增多,抽样充分,可以进行数据分析。
采用SPSS 20.0统计软件进行统计学分析,各组间OTU、Ace、Chao、Coverage、Shannon、Simpson差异均不显著,结果见表1。相比于BH组,BH+阿斯巴甜组、BH+共聚物组、BH+蔗糖组的OTU数量、Ace与Chao指数均有增大的趋势,且3种多样性评价指标变化趋势相同。增大趋势最明显的是BH+阿斯巴甜组,其次是BH+共聚物组,表明BH溶液经过蔗糖、共聚物、阿斯巴甜掩味后,其物种总数有升高的趋势。相比于BH组,BH+共聚物组的菌群Shannon指数最为接近,即2组间菌群多样性基本不变,BH+蔗糖组菌群多样性有升高的趋势,BH+阿斯巴甜组有降低的趋势。因此,甜味剂可能会影响肠道菌群的多样性,而经共聚物掩味后,不影响肠道菌群的多样性。
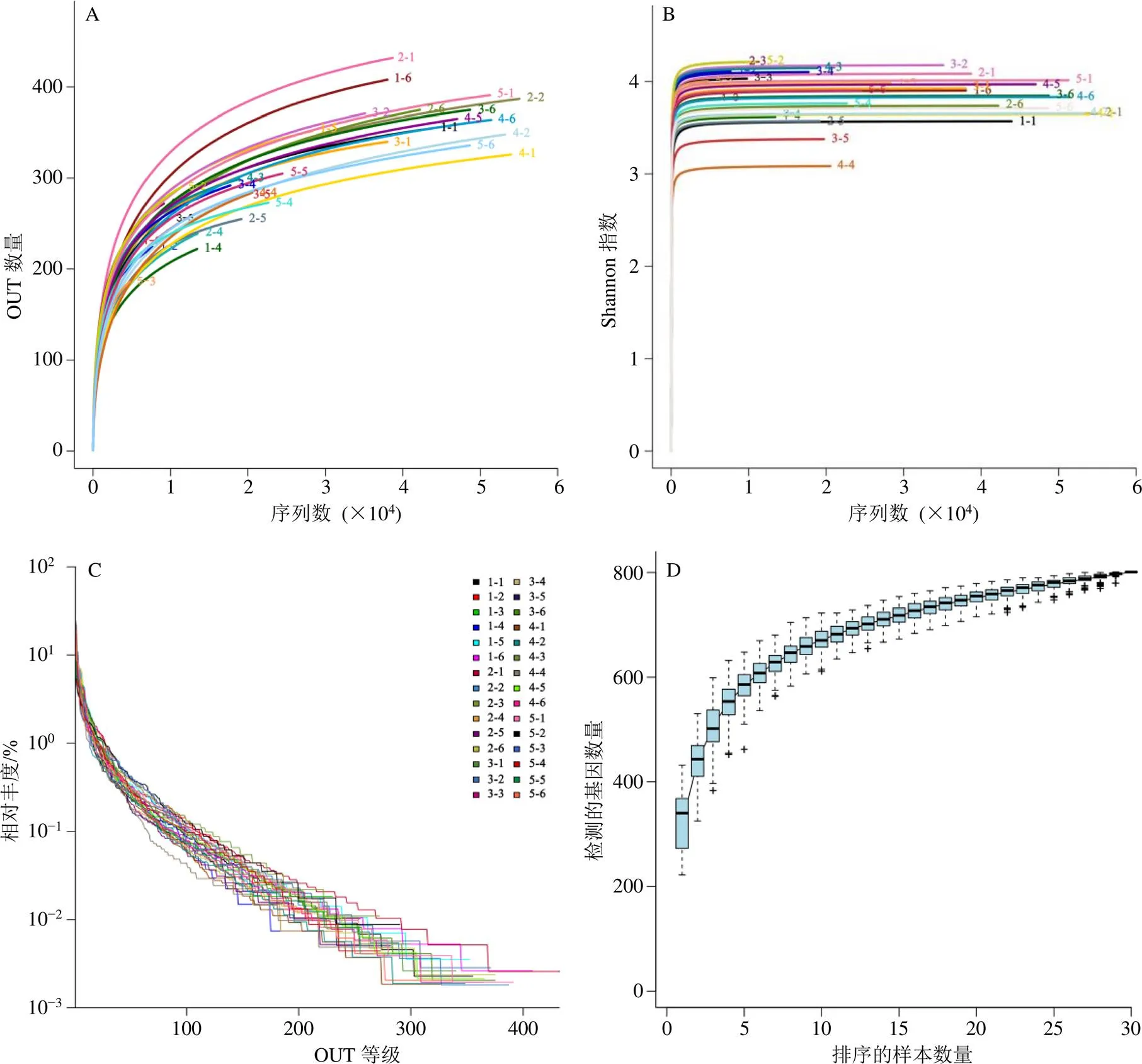
A-稀释曲线 B-Shannon-Wiener曲线 C-Rank-Abundance曲线 D-Specaccum物种累积曲线 1-BH组 2-BH+共聚物组 3-BH+蔗糖组 4-BH+阿斯巴甜组 5-对照组

表1 各组小鼠肠道菌群多样性指数(, n = 6)
3.2 β多样性分析
通过β多样性分析比较样本间的物种或功能的丰度分布差异程度,如图2-A所示,各组样品间组内差异与组间差异均较大。其中,各组间组内差异程度几乎一致,与BH组比较,对照组群落构成差异最大,与其余组之间的差异不大;与BH+共聚物组相比,BH+蔗糖与对照组群落构成差异最大;与对照组比较,BH组与BH+阿斯巴甜组群落构成差异最大。PCA、PCoA与NMDS结果显示,与BH组相比,BH+共聚物组群落构成最接近,其次是BH+阿斯巴甜组;与对照组比较,BH组群落构成差异最大,其次是BH+共聚物组与BH+阿斯巴甜组(图2-B~D)。样品间的群落构成无论是组内差异还是组间差异均具有明显的差异,可能是由于微生物的群落构成存在着很大的个体差异。BH组与BH+共聚物组微生物的群落构成最接近,且与对照组群落构成存在明显差异,表明BH与BH+共聚物组具有明显的抑菌药效,且共聚物不影响BH的抑菌药效。BH+蔗糖组微生物的群落构成最接近于正常肠道微生物群落构成,可能是由于利用蔗糖对药物进行矫味后,可引起肠道的细菌数与淀粉酶活性降低,大肠杆菌数与蛋白酶活性升高[14],从而降低BH抑菌药效。
3.3 物种组成分析
样品各分类水平中的物种Profiling柱状图见图3。在门水平上,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)占绝对优势,BH组与BH+共聚物组中变形菌门占比较其余3组小, BH+阿斯巴甜组中放线菌门占比较其余4组小。在属水平上,拟杆菌目$24-7组(Bacteroidales S24-7 group_ norank)占绝对优势;BH组与BH+共聚物组中拟杆菌属、毛螺菌科Lachnospira、肠杆菌属为优势菌种;BH+蔗糖、 BH+阿斯巴甜组与对照组螺杆菌属占比明显升高。因此,变形菌门数量增多、放线菌门数量减小与螺杆菌属升高很可能是甜味剂导致肠道菌群多样性升高的原因。

A-组间组内距离箱式图 B-PCA图 C-PCoA图 D-NMDS分析图 1-BH组 2-BH+共聚物组 3-BH+蔗糖组 4-BH+阿斯巴甜组 5-对照组

A-按门划分的微生物群落柱状图 B-按属划分的微生物群落柱状图 1-BH组 2-BH+共聚物组 3-BH+蔗糖组 4-BH+阿斯巴甜组 5-对照组
3.4 差异菌群分析
采用LEfSE分析,统计对样本划分产生显著性差异影响的群落或物种,结果见图4。BH组有4个显著差异菌群,分别是戈登氏杆菌属、布劳特氏菌属、瘤胃球菌科NK4A214群(Ruminococcaceae NK4A214 group)、。BH+共聚物组有4个显著差异菌群,分别为拟杆菌目(Bacteroidales)、拟杆菌纲(Bacteroidia)、拟杆菌门(Bacteroidetes)、Tyzzerella 3。BH+蔗糖组有6个显著差异菌群,分别为嗜木聚糖真杆菌属([Eubacterium] xylanophilum group)、红螺菌目(Rhodospirillales)、红螺菌科(Rhodospirillaceae)、未培养的红螺菌科(Rhodospirillaceae uncultured)、变形菌纲(Alphaproteobacteria)、理研菌科-RC9(Rikenellaceae RC9 gut group)。BH+阿斯巴甜组有2个显著差异菌群,分别为理研菌科(Rikenellaceae)、另枝菌属。对照组有5个显著差异菌群,分别为瘤胃球菌科UCG-013(Ruminococcaceae UCG- 013)、未培养的红蝽杆菌科(Coriobacteriaceae uncultured)、拟杆菌目$24-7组、未培养的拟杆菌目(Bacteroidales uncultured)以及属。

A-进化分枝图: 红色区域和绿色区域表示不同分组,红色节点表示在红色组别中起到重要作用的微生物类群,绿色节点表示在绿色组别中起到重要作用的微生物类群,黄色节点表示的是在两组中均没有起到重要作用的微生物类群 B-LDA分析柱状图: 1-BH组,2-BH+共聚物组,3-BH+蔗糖组,4-BH+阿斯巴甜组,5-对照组
采用SPSS 20.0统计软件进行统计学分析,比较不同矫味剂对差异菌群的影响,结果见表2。在BH组4个显著差异菌群中,戈登氏杆菌属、布劳特氏菌属、瘤胃球菌科NK4A214群以及属相对丰度最高,且瘤胃球菌科NK4A214群仅在BH组检测出。在BH+共聚物组的4个显著差异菌群中,拟杆菌目、拟杆菌纲、拟杆菌门的相对丰度最高,且Tyzzerella 3仅在BH+共聚物组中检测出。在BH+蔗糖组的5个显著差异菌群中,嗜木聚糖真杆菌的相对丰度最高,与其余组均具有显著性差异。理研菌科-RC9在BH组与BH+共聚物组的相对丰度具有显著降低。在BH+阿斯巴甜组的2个显著差异菌群中,相比于BH组,理研菌科、另枝菌属在BH+蔗糖组、BH+阿斯巴甜组与对照组的相对丰度显著高于BH组,BH组与BH+共聚物组没有显著差异。在对照组的5个显著差异菌群中,瘤胃球菌科UCG-013、未培养的红蝽杆菌科、未培养的拟杆菌目、Tyzzerella菌群丰度最高,而拟杆菌目$24-7组在BH+共聚物组中丰度最高。

表2 小鼠肠道菌群的相对丰度
与BH组比较:*<0.05;与BH+共聚物组比较:Δ<0.05;与BH+蔗糖组比较:&<0.05;对照组比较:#<0.05
*< 0.05BH group;Δ< 0.05BH+ copolymers group;&< 0.05BH+ sucrose group;#< 0.05blank control group
4 讨论
通过多样性分析发现,BH经过蔗糖、mPEG 2000-PLLA2000、阿斯巴甜掩味后,其物种总数有升高的趋势。共聚物不影响BH菌群的多样性,蔗糖具有使BH菌群多样性升高的趋势,阿斯巴甜具有使BH菌群多样性降低的趋势。因此,甜味剂可能会影响肠道菌群的多样性。BH组与BH+共聚物组微生物的群落构成最接近,且与对照组群落构成存在明显差异,表明共聚物不影响BH的抑菌药效。加入甜味剂掩味后,变形菌门数量增多、放线菌门数量减小、与螺杆菌属升高可能引起肠道菌群多样性升高。
虽然瘤胃球菌科NK4A214群仅在BH组检测出,Tyzzerella-3仅在BH+共聚物组中检测出,但其含量远远低于其余显著差异菌群,体内活性未见相关报道。在人类中,神经递质5-羟色胺在胃肠道中浓度最高,其参与胃肠分泌、运动和疼痛感知的调节。5-羟色胺的含量升高,可引起炎症性疼痛,而据以往研究报道,另枝菌属可能是产生5-羟色胺的菌群[15]。BH+阿斯巴甜组可引起肠道菌群中另枝菌属丰度的升高,增加疼痛的感知。因此,阿斯巴甜有可能降低BH的镇痛药效。另外,理研菌科的丰度与血清瘦素水平呈正相关,血清瘦素参与糖、脂肪及能量代谢的调节,可促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成。其相对丰度的升高与强制性脊柱炎、系统性红斑狼疮等自身免疫疾病还存在有明显的相关性[16]。因此,阿斯巴甜与蔗糖可能会引起理研菌科相对丰度升高,而影响糖、脂肪及能量代谢,或引起免疫系统的紊乱。有研究表明,嗜木聚糖真杆菌的增多与小细胞肺癌的发生可能存在正相关,大量长期服用蔗糖存在发生小细胞肺癌的风险[17]。因此,经甜味剂掩蔽BH苦味后,长期使用可能会导致BH的镇痛药效降低,引起体内代谢紊乱,应尽量避免长期大剂量使用。两亲性嵌段共聚物不会对BH肠道菌群造成显著影响,进一步证明了其临床实用价值。
开发儿童用中药汤剂伴侣剂,显著抑制汤剂苦味、改善汤剂口感,是中医儿科临床与医院药学的期盼,对于提高儿童服药顺应性、提升中医药在我国卫生健康领域的服务能力具有重要意义[18]。本研究证明了两亲性嵌段共聚物的安全性,尤其是长期服药条件下几乎不干扰药物对肠道菌群的作用。这为以两亲性嵌段共聚物为主要辅料,开发儿童用中药汤剂伴侣剂奠定了科学基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 张婷, 张定堃, 林俊芝, 等. 小分子苦味淬灭剂应用于口服液体制剂的研究概况 [J]. 中国药学杂志, 2017, 52(18): 1569-1575.
[2] 林俊芝, 张定堃, 段渠, 等. 中药涩味的形成原理及掩蔽技术的研究概况 [J]. 中草药, 2014, 45(18): 2716-2721.
[3] Margolskee R F. Molecular mechanisms of bitter and sweet taste transduction [J]., 2002, 277(1): 1-4.
[4] Wang Q P, Browman D, Herzog H,. Non-nutritive sweeteners possess a bacteriostatic effect and alter gut microbiota in mice [J]., 2018, 13(7): e0199080.
[5] 曹承旭, 武俊瑞, 乌日娜. 几种常用的甜味剂对肠道微生物的调节机制 [J]. 微生物学报, 2018, 58(11): 1979-1988.
[6] 张敏纯, 麻静. 人造甜味剂影响糖代谢的肠道机制 [J]. 中华糖尿病杂志, 2018, 10(12): 813-816.
[7] Chi L, Bian X M, Gao B,. Effects of the artificial sweetener neotame on the gut microbiome and fecal metabolites in mice [J]., 2018, 23(2): E367.
[8] Cox L M, Blaser M J. Pathways in microbe-induced obesity [J]., 2013, 17(6): 883-894.
[9] Hao F, Lee R J, Zhong L H,. Hybrid micelles containing methotrexate-conjugated polymer and co-loaded with microRNA-124 for rheumatoid arthritis therapy [J]., 2019, 9(18): 5282-5297.
[10] Li Y P, Zhang T, Liu Q H,. PEG-derivatized dual- functional nanomicelles for improved cancer therapy [J]., 2019, 10: 808.
[11] Li P, Tian Y, Ke X M,. Amphiphilic block copolymers: A novel substance for bitter-masking in aqueous solutions [J]., 2020, 17(5): 1586-1595.
[12] 李潘, 仇敏, 田寅, 等. mPEG-PLLA掩蔽黄连生物碱苦味的构-效关系研究 [J]. 中国中药杂志, 2020, 45(13): 3128-3135.
[13] 徐航宇, 王彦礼, 王敦方, 等. 高通量测序技术研究黄芩汤对溃疡性结肠炎大鼠肠道菌群的影响 [J]. 药学学报, 2017, 52(11): 1673-1682.
[14] 彭昕欣. 蔗糖对七味白术散治疗菌群失调腹泻小鼠肠道微生物及酶的影响[D]. 长沙: 湖南中医药大学, 2015.
[15] Valles-Colomer M, Falony G, Darzi Y,. The neuroactive potential of the human gut microbiota in quality of life and depression [J]., 2019, 4(4): 623-632.
[16] Clemente J C, Manasson J, Scher J U. The role of the gut microbiome in systemic inflammatory disease [J]., 2018, 360: j5145.
[17] 张蓝方. 小细胞肺癌患者与健康人肠道菌群的差异性研究 [D]. 大连: 大连医科大学, 2017.
[18] 张定堃, 郭治平, 杨殿兴, 等. 新型中药口腔速溶散的设计原理与应用前景 [J]. 中草药, 2020, 51(14): 3617-3622.
Study on suitability of amphiphilic block copolymer for bitterness inhibition of traditional Chinese medicine decoction based on intestinal flora
LIN Jun-zhi1, LI Pan2, QIU Min3, KE Xiu-mei4, HAN Li3, YANG Ming5, WU Zhen-feng5, ZHANG Ding-kun3
1. Central Laboratory, Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China 2. Chengdu Qingbaijiang District People’s Hospital, Chengdu 610300, China 3. Pharmacy School, State Key Laboratory of Characteristic Chinese Medicine Resources in Southwest China, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 4. College of Traditional Chinese Medicine, Chongqing Medical University, Chongqing 400016, China 5. Key Lab of Modern Preparation of TCM, Ministry of Education, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
To evaluate the suitability and safety of amphiphilic block copolymers for bitter suppression of traditional Chinese medicine decoction based on intestinal flora.Berberine hydrochloride (BH) with strong bitterness was used as model drug, the effects of amphiphilic block copolymer, natural sweetener (sucrose) and artificial sweetener (aspartame) on intestinal microflora of rats were compared after 2 weeks of continuous administration by high throughput sequencing technology.After being masked by amphiphilic block copolymers, sucrose and aspartame, the total number of species of BH was increased. The results showed that amphiphilic block copolymers did not affect the diversity and community composition of BH. Sucrose had a tendency to increase the diversity of BH flora, while aspartame had a tendency to decrease it.Amphiphilic block copolymers do not interfere with the effect of the drug on intestinal flora in long-term medication, so it is a safe taste masking agent for children.
traditional Chinese medicine decoction; bitter-masking; amphiphilic block copolymer; intestinal flora; development of decoction companion; berberine
R283.6
A
0253 - 2670(2021)01 - 0065 - 10
10.7501/j.issn.0253-2670.2021.01.009
2020-08-28
国家自然科学基金项目(81803745);四川省科技厅青年杰出科技人才资助项目(2019JDJQ0007);2019-2021年度中华中医药学会青年人才托举工程项目(2019-QNRC2-B05);江西中医药大学现代中药制剂教育部重点实验室开放基金(TCM-201904)
林俊芝,女,硕士,助理研究员,研究方向为中药制剂新技术与分子生物学研究。E-mail: 582097013@qq.com
张定堃,男,博士,副教授,硕士生导师,研究方向为中药制剂与品质评价新技术。E-mail: zhangdingkun@cdutcm.edu.cn
伍振峰,男,博士,副教授,硕士生导师,研究方向为中药新剂型与新技术/中药制药装备研究。E-mail: zfwu57@163.com
[责任编辑 郑礼胜]
