野山参中1个新的聚炔类化合物
2021-01-05牛雪妮吕重宁路金才
牛雪妮,罗 文,吕重宁,路金才
野山参中1个新的聚炔类化合物
牛雪妮,罗 文,吕重宁,路金才*
沈阳药科大学中药学院,辽宁 沈阳 110016
研究野山参根与根茎的化学成分。利用HPD-400大孔吸附树脂和反相硅胶柱色谱以及半制备高效液相色谱等方法进行分离纯化,通过质谱、核磁共振波谱(1H- 和13C-NMR以及HSQC、HMBC实验)等手段鉴定化合物结构。从野山参70%乙醇提取物经HPD-400大孔吸附树脂90%乙醇洗脱部位分离得到5个化合物,分别鉴定为8-癸烷-4,6-二炔-1β吡喃葡萄糖基-(1→2)-β吡喃葡萄糖苷(1)、三七皂苷Rt(2)、20()-人参皂苷F4(3)、人参皂苷Rg6(4)、20()-人参皂苷Rg9(5)。化合物1为新的聚炔类化合物,命名为人参炔氧苷A;化合物2~5为首次从野山参中分离得到。
野山参;人参;人参炔氧苷A;聚炔类化合物;人参皂苷;三七皂苷Rt;20()-人参皂苷F4;人参皂苷Rg6
人参系五加科(Araliaceae)人参属植物人参C. A. Meyer的干燥根及根茎[1]。根据其生长环境与生长模式,人参可分为野生人参、林下山参和园参。自然传播、生长于深山密林的原生态人参为“野生人参”。播种在深山密林中自然生长的为“林下山参”,多于播种后10年以上采收。按《野山参鉴定及分等质量》GBT18765-2015规定,生长年限达15年以上的林下山参称为“野山参”。栽培者为“园参”,多于播种后3~6年采收[2‑4]。目前市场上流通的人参多为林下山参与园参,然而人参相关研究大多集中在园参及其加工品,对林下山参(含野山参)的研究相对较少[5-6]。研究表明人参的化学成分主要为三萜及其苷类[7]、聚炔类[8-10]、倍半萜类[11]以及氨基酸、生物碱、寡糖等其他类型化合物。其中,三萜及其苷类主要是以达玛烷型、齐墩果烷型为母核的三萜及其苷类化合物,目前分离得到的人参皂苷绝大多数为达玛烷型和齐墩果烷型,是人参的主要活性成分[12-13]。另外,从人参中分离得到的以人参炔醇、人参环氧炔醇为代表的聚炔类化合物具有营养及保护神经细胞、抗肿瘤和预防心脑血管系统疾病等药理作用[14]。因此,林下山参作为目前商品人参的重要来源,对其进行深入研究十分必要,本研究选取野山参对其化学成分进行系统研究。
本研究利用HPD-400大孔吸附树脂柱色谱、硅胶开放柱色谱、半制备高效液相色谱对野山参的根及根茎进行了系统的分离纯化研究,得到5个单体化合物,并通过质谱、核磁共振波谱等手段分别鉴定为8-癸烷-4,6-二炔-1β吡喃葡萄糖基- (1→2)-β吡喃葡萄糖苷[8-decane-4,6-diyn-1βglucopyranosyl-(1→2)-βglucopyranoside,1]、三七皂苷Rt(notoginsenoside Rt,2)、20()-人参皂苷F4[20()-ginsenoside F4,3]、人参皂苷Rg6(ginsenoside Rg6,4)、20()-人参皂苷Rg9[20()-ginsenoside Rg9,5]。化合物1为新的聚炔类化合物,命名为人参炔氧苷A;化合物2~5为首次从野山参中分离得到。
1 仪器与材料
Bruker ARX-600核磁共振波谱仪(Bruker Co.,Billerica,MA,USA);Shimadzu ftir-8400s红外光谱仪(Shimadzu Corporation,Tokyo,Japan);Micro TOF质谱(Bruker Co.,Karlsruhe,Germany);L5S紫外可见分光光度计(上海棱光科技技术有限公司);LC-10A制备HPLC(Shimadzu,Kyoto,Japan)配置SPD-10A检测器(Shimadzu,Kyoto,Japan);半制备高效液相色谱柱为YMC Pack ODS-A 色谱柱(250 mm×10 mm,5 μm;YMC Co.,Ltd.,Kyoto,Japan)。
薄层色谱用硅胶G和柱色谱用硅胶(100~200、200~300目)购自青岛海洋化工有限公司分厂;柱色谱用ODS(20 µm)购自YMC上海代表处;分析级甲醇、乙醇、二氯甲烷购买自天津市永大化学试剂有限公司;色谱级甲醇和乙腈购自天津市富宇精细化工有限公司;纯净水购自杭州娃哈哈集团有限公司;氘代试剂均购买自西格玛奥德里奇(上海)贸易有限公司。
野山参采自辽宁省桓仁满族自治县,经沈阳药科大学中药学院路金才教授鉴定为五加科人参属植物野山参C. A. Meyer的根及根茎。标本(MCG-20190830)存放于沈阳药科大学中药学院标本室。
2 提取与分离
取野山参干燥药材约5 kg,切成约0.5 mm的薄片,水煎煮提取3次,水用量分别为75、60、50 L,提取时间分别为3、3、2 h。提取完毕后,滤过,合并滤液,减压浓缩至15 L,浓缩液以HPD-400大孔吸附树脂柱色谱初步纯化,再依次以水及60%、90%乙醇溶液洗脱,90%乙醇洗脱液减压浓缩得浸膏约217.8 g,用于本实验的分离。
将上述干燥后的粗提物经硅胶柱色谱,以二氯甲烷-甲醇-水系统(15∶1∶0→9∶1∶0.1→5∶1∶0.1→4∶1∶0.1→6∶2∶0.2→6∶4∶0.4→0∶1∶0)梯度洗脱得到15个组分(Fr. 1~15)。Fr.6经ODS开放柱色谱梯度洗脱(18%→30%→40%→ 50%→76%→90%→100%甲醇梯度洗脱)得到6个亚组分(Fr. 6-1~6-6),Fr. 6-2经半制备HPLC(45%甲醇水溶液洗脱)得到化合物1(20 mg,R=77 min);Fr. 6-3经半制备HPLC(28%乙腈洗脱)得到化合物2(6 mg,R=27 min);Fr. 6-4经半制备HPLC(70%甲醇洗脱)得到化合物3(18 mg,R=95 min)、4(9 mg,R=106 min)、5(7 mg,R=116 min)。
3 结构鉴定
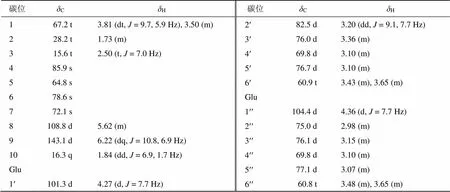
表1 化合物1的1H- 和13C-NMR谱数据(600/150 MHz, DMSO-d6)

图1 化合物1主要的HMBC相关图
化合物2:白色粉末;TLC检测,喷雾10%硫酸乙醇试液显紫红色。1H-NMR (600 MHz, Py-5) 谱显示有9个角甲基的质子信号H0.96 (3H, s), 1.07 (3H, s), 1.24 (3H, s), 1.58 (3H, s), 1.60 (3H, s), 1.60 (3H, s), 1.65 (3H, s), 2.07 (3H, s), 2.09 (3H, s);2个糖基端基质子信号H5.05 (1H, d,= 7.7 Hz), 5.22 (1H, d,= 7.7 Hz) 及C-3上的质子信号H3.51 (1H, dt,= 11.2, 5.1 Hz);13C-NMR (150 MHz, Py-5)谱显示出44个碳信号,其中C61.8 (C-5)为达玛烷母核取代羟基C-6的特征信号;C98.6和C106.3为两个糖基端基碳信号;C126.3和131.3为达玛烷母核侧链上的2个烯碳(C-24、C-25)信号;C171.3为羰基碳信号。化合物2的1H-NMR谱及13C-NMR谱信号与文献报道一致[20],故确定化合物2为三七皂苷Rt,碳信号归属见表2。
化合物3:白色粉末,TLC检测,喷雾10%硫酸乙醇试液显紫红色。1H-NMR (600 MHz, Py-5) 谱显示有9个甲基质子信号H: 0.98 (3H, s), 1.00 (3H, s), 1.27 (3H, s), 1.38 (3H, s), 1.59 (3H, s), 1.64 (3H, s), 1.80 (3H, s), 1.81 (3H, s), 2.14 (3H, s);2个糖基端基质子信号H4.82 (1H, d,= 3.7 Hz), 5.29 (1H, d,= 6.9 Hz);2个烯烃质子信号H5.48 (1H, t,= 7.1 Hz), 5.23 (1H, t,= 7.3 Hz) 及C-3上的质子信号H3.50 (1H, dd,= 11.0, 5.1 Hz)。13C-NMR (150 MHz, Py-5) 谱显示出40个碳信号,其中C61.2 (C-5) 为达玛烷母核C-6有羟基取代时的特征信号;C102.2与C102.3为2个糖基端基碳信号;C131.6和140.5为达玛烷母核侧链上的2个烯碳信号。将化合物3的1H- 和13C-NMR谱信号与文献报道对比[21],发现除化合物3的2个烯碳信号被吡啶溶剂峰所掩盖外,其余数据基本一致,故鉴定化合物3为20()-人参皂苷F4,碳信号归属见表2。
化合物4:白色粉末;TLC检测,喷雾10%硫酸乙醇试液显紫红色。1H-NMR (600 MHz, Py-5) 谱显示有8个甲基的质子信号H: 0.99 (3H, s), 1.00 (3H, s), 1.27 (3H, s), 1.38 (3H, s), 1.61 (3H, s), 1.69 (3H, s), 1.81 (3H, s), 2.15 (3H, s);2个糖基端基质子信号H4.82 (1H, d,= 3.7 Hz), 5.29 (1H, d,= 7.1 Hz);3个烯烃质子峰H4.91 (1H, s), 5.13 (1H, s), 5.32 (1H, tt,= 6.8, 1.4 Hz) 及C-3上的质子信号H3.50 (1H, m)。13C-NMR谱(150 MHz, Py-5) 显示出42个碳信号,其中C61.2 (C-5) 为达玛烷母核C-6有羟基取代时的特征信号;C108.4, 125.7, 131.6, 155.8为达玛烷母核侧链上的4个烯碳(C-21、C-24、C-25、C-20)信号;C102.2, 102.3为2个端基碳信号。以上波谱信号与文献报道基本一致[22],故鉴定化合物4为人参皂苷Rg6,碳信号归属见表2。

表2 化合物2~5的13C-NMR谱(150 MHz, Py-d5)数据
a-表示信号峰被溶剂峰掩盖
a-covered by solvent signal
化合物5:白色粉末;TLC检测,喷雾10%硫酸乙醇试液显紫红色。1H-NMR (600 MHz, Py-5) 谱显示有8个角甲基的质子信号H: 0.83 (3H, s), 0.99 (3H, s), 1.23 (3H, s), 1.49 (3H, s), 1.59 (3H, s), 1.63 (3H, s), 1.83 (3H, s), 2.10 (3H, s);2个糖基端基质子信号H4.97 (1H, d,= 7.4 Hz) 和 5.80 (1H, d,= 6.5 Hz);13C-NMR (150 MHz, Py-5) 谱显示出39个碳信号, 其中C61.7 (C-5) 为达玛烷母核C-6有羟基取代时的特征信号;C103.9、105.3为2个糖端基碳信号;C131.6和140.5为达玛烷母核侧链上的2个烯碳信号。将化合物5的1H- 和13C-NMR谱信号与文献报道[23]对比,发现化合物5的13C- NMR谱中,除有2个烯碳信号峰被溶剂峰所掩盖外,其余数据基本一致,故确定化合物5为20()-人参皂苷Rg9,碳信号归属见表2。
4 讨论
本实验利用各种色谱分离及天然产物结构鉴定方法,对野山参70%乙醇提取物经HPD-400大孔吸附树脂90%乙醇洗脱部位进行了研究,得到1个新的聚炔类化合物和5个已知的人参皂苷类化合物。该结果对野山参化学成分的深入挖掘及其专属性成分的发现具有重要指导意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 8.
[2] 野山参鉴定及分等质量: GB/T 18765—2015 [S]. 2015: 1.
[3] Xu X F, Cheng X L, Lin Q H,. Identification of mountain-cultivated ginseng and cultivated ginseng using UPLC/oa-TOF MSE with a multivariate statistical sample-profiling strategy [J]., 2016, 40(4): 344-350.
[4] 陈跃. 清代东北地区生态环境变迁研究[D]. 济南: 山东大学, 2012 .
[5] 常相伟, 李德坤, 王彤, 等. 基于UHPLC-QTOF/MS的植物代谢组学技术鉴别林下山参的不同部位 [J]. 药学学报, 2016, 51(10): 1609-1615.
[6] 朱海林. 基于NMR和UPLC-QTOF-MS/MS技术的林下山参化学成分研究[D]. 长春: 吉林大学, 2017.
[7] Yang W Z, Hu Y, Wu W Y,. Saponins in the genusL. (Araliaceae): A systematic review of their chemical diversity [J]., 2014, 106: 7-24.
[8] Murata K, Iida D, Ueno Y,. Novel polyacetylene derivatives and their inhibitory activities on acetylcholinesterase obtained fromroots [J]., 2017, 71(1): 114-122.
[9] Poplawski J, Wrobel J T, Glinka T. Panaxydol, a new polyacetylenic epoxide fromroots [J]., 1980, 19(7): 1539-1541.
[10] Lee S W, Kim K, Rho M,. New polyacetylenes, DGAT inhibitors from the roots of[J]., 2004, 70(3): 197-200.
[11] Richter R, Basar S, Koch A,. Three sesquiterpene hydrocarbons from the roots ofC.A. Meyer (Araliaceae) [J]., 2005, 66(23): 2708-2713.
[12] Li X, Chu S F, Lin M Y,. Anticancer property of ginsenoside Rh2from ginseng [J]., 2020, 203:112627.
[13] Shi Z Y, Zeng J Z, Wong A S T. Chemical structures and pharmacological profiles of ginseng saponins [J]., 2019, 24(13): 2443.
[14] 赵岩, 王红, 蔡恩博, 等. 人参挥发油化学成分及其主要活性成分聚乙炔醇类药理作用研究进展 [J]. 中国药房, 2017, 28(13): 1856-1859.
[15] 李春彦, 孙振刚, 晏烽根, 等. 中药白术与苍术中聚炔类成分分析与质谱裂解规律研究 [J]. 中国新药杂志, 2017, 26(9): 1071-1078.
[16] Yeo C R, Yong J J, Popovich D G. Isolation and characterization of bioactive polyacetylenesMeyer roots [J]., 2017, 139: 148-155.
[17] Hirakura K, Morita M, Nakajima K,. Three acetylenic compounds from roots of[J]., 1992, 31(3): 899-903.
[18] Zhang H J, Lu Z Z, Tan G T,. Polyacetyleneginsenoside-Ro, a novel triterpene saponin from[J]., 2002, 43(6): 973-977.
[19] Rho M C, Lee H S, Lee S W,. Polyacetylenic compounds, ACAT inhibitors from the roots of[J]., 2005, 53(4): 919-922.
[20] 李霄, 石任兵, 刘斌, 等. 清脑宣窍方有效部位的两个新化合物研究 [J]. 中草药, 2007, 38(9): 1287-1289.
[21] Ryu J H, Park J H, Kim T H,. A genuine dammarane glycoside, (20)-ginsenoside F4 from Korean red ginseng [J]., 1996, 19(4): 335-336.
[22] Ryu J H, Park J H, Eun J H,. A dammarane glycoside from Korean red ginseng [J]., 1997, 44(5): 931-933.
[23] Chen G T, Yang M, Lu Z Q,. Microbial transformation of 20()-protopanaxatriol-type saponins by[J]., 2007, 70(7): 1203-1206.
A new polyacetylene from wild ginseng
NIU Xue-ni, LUO Wen, LYU Chong-ning, LU Jin-cai
School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
To study the chemical constituents from the root and rhizome of wild ginseng ().HPD-400 macroporous resin column chromatography, reversed phase silica gel column chromatography, semi-preparative HPLC methods were used for separation and purification, and mass spectrometry, nuclear magnetic resonance spectroscopy (1H-NMR,13C-NMR, HSQC and HMBC) were analyzed to identify compound structures.Five compounds were isolated from the 90% ethanol fraction of the 70% ethanol extract eluated by HPD-400 macroporous absorption resin from the root and rhizome of wild ginseng, and elucidated as 8-decane-4,6-diyn-1βglucopyranosyl-(1-2)-βglucopyranoside (1), notoginsenoside Rt (2), 20()-ginsenoside F4(3), ginsenoside Rg6(4) and 20()-ginsenoside Rg9(5).Compound 1 is a new polyacetylene, named as panaxyneoside A. Compounds 2—5 are isolated from wild ginseng for the first time.
wild ginseng;C. A. Meyer; panaxyneoside A; polyacetylenes; ginsenosides; notoginsenoside Rt; 20()-ginsenoside F4; ginsenoside Rg6
R284.1
A
0253 - 2670(2021)01 - 0023 - 05
10.7501/j.issn.0253-2670.2021.01.004
2020-08-27
国家重点研发计划项目(2017YFC1702302)
牛雪妮,博士研究生在读,研究方向为生药学。E-mail: niuxueni@outlook.com
路金才,博士研究生导师,教授,主要研究方向为药用植物资源开发及创新药物研究。E-mail: jincailu@126.com
[责任编辑 王文倩]
