聚羟基脂肪酸酯/海藻酸钠纳米纤维的制备及其性能
2021-01-05孙范忱
孙范忱, 郭 静,2, 于 跃,2, 张 森,2
(1. 大连工业大学 纺织与材料工程学院, 辽宁 大连 116034; 2. 辽宁省功能纤维及复合材料工程技术中心, 辽宁 大连 116034)
人体创伤发生的频率逐年增加[1-2],其中外周神经损伤约占5%,神经修复成为急需解决的重要问题[3-4]。常用的神经修复方法是自体移植,其受到来源、供区缺损和供需不匹配等限制,因此,人造神经导管材料应运而生[5-6]。
聚羟基脂肪酸酯(P(3HB-co-4HB))是通过微生物发酵获得的可降解材料,其生物相容性、可塑性、韧性等性能较为突出,所以在农业、包装、生物学及组织工程领域应用广泛[7-8],但由于P(3HB-co-4HB)表面缺乏活性功能基团,使细胞膜与其接触时产生特异性相互作用,导致细胞在材料表面粘附、迁移、增殖受到一定限制。为解决这一问题,刘琴等[9]通过制备同轴P(3HB-co-4HB)/聚乙烯醇复合支架来改善其生物相容性;Wang等[10]通过调解共混物中聚乳酸(PLA)的含量制得了具有高孔隙率、高吸水性的P(3HB-co-4HB)/PLA材料,并用于软骨组织培养。
海藻酸钠是从海中提取的一种天然多糖类化合物,是β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)按(1→4)链连接而成。其生物相容性好,亲水性优良,有利于细胞的粘附、增殖和分化[11-12],但单一SA刚性大,耐水性差,很难静电纺丝成形[13-14]。将P(3HB-co-4HB)和SA共混可在性能上实现取长补短。然而P(3HB-co-4HB)为亲油性,SA为亲水性,在常规情况下很难共溶解,为此,本文以月桂基葡糖苷(APG)为乳化剂,成功将P(3HB-co-4HB)与SA复合,制备了P(3HB-co-4HB)/SA纳米纤维,并对纳米纤维的表面形貌、孔隙率、毒性、生物相容性等进行表征。
1 实验部分
1.1 试剂与仪器
原料与试剂:海藻酸钠(SA),相对分子质量为15 000,其中G片段与M片段比例为1.2∶1,青岛海之林生物有限公司; P(3HB-co-4HB),数均分子量约为7×105,其中4HB的质量分数为15%,山东意可曼科技有限公司;三氯甲烷,分析纯,西陇化工股份有限公司; 烷基糖苷(APG),山东优索化工科技有限公司;RSC96血旺细胞,广州吉妮欧生物科技有限公司;Cell Counting Kit-8(CCK8),合肥新恩源生物技术有限公司;乙醇(75%),铁岭康泰消毒剂有限公司;戊二醛,分析纯,北京索莱宝科技有限公司;叔丁醇,分析纯,国药集团化学试剂有限公司;磷酸缓冲盐溶液(PBS),北京索莱宝科技有限公司。
仪器:Spectrum-One B型红外光谱仪,美国PE公司;DSC200F3型差示扫描量热仪,德国耐驰仪器制造有限公司;JSM-7800F型扫描电子显微镜(SEM),日本电子(JEOL);TL-Pro-BM型高压静电纺丝机,深圳市通力微纳科技有限公司;VD-850型桌上式洁净工作台,苏州净化设备有限公司;酶标仪,上海沛欧分析仪器有限公司。
1.2 实验过程
本文实验机制和实验过程如图1所示。首先将SA溶于去离子水中配制不同质量分数(0%、2%、4%、6%、8%、10%、12%)的SA水溶液。然后将含有一定比例的APG和三氯甲烷加入到SA水溶液中,使APG起到乳化作用,降低共混溶液的表面张力,随后将共混溶液放置在超声波细胞粉碎机上以400 W的功率均质15 min,然后加入一定质量的P(3HB-co-4HB),放置于恒温摇床里连续振荡12 h,待P(3HB-co-4HB)完全溶解后,再次放在超声波细胞粉碎机上以400 W的功率均质15 min,使SA稳定分布于P(3HB-co-4HB)溶液中得到纺丝溶液。最后通过静电纺丝机进行静电纺丝,得到P(3HB-co-4HB)/SA纳米纤维膜。纺丝条件:环境温度为(35±1)℃,相对湿度为(20±5)%,静电压为20 kV,喷丝口距接收板距离为20 cm,流速为2.0 mL/h。

图1 实验机制和实验过程Fig.1 Experimental process and analysis of co-dissolution mechanism
1.3 纳米纤维膜化学结构测试
采用红外光谱仪测试P(3HB-co-4HB)/SA纳米纤维膜的化学结构。将纳米纤维粉末状样品用KBr压片,扫描波数范围为4 000~400 cm-1。
1.4 纳米纤维膜热性能测试
采用差示扫描量热仪测试样品的热性能,测试温度范围为-40~40 ℃,升温速率为10 ℃/min,氮气气氛。
1.5 纳米纤维膜表面形貌观察
首先对纤维膜进行喷金处理,然后采用扫描电子显微镜观察样品的表面形貌。加速电压为10 kV,放大倍数为200~2 000倍。
1.6 纳米纤维膜孔隙率测定
将3 cm×3 cm尺寸的纤维膜浸润于去离子水中20 min,取出用滤纸吸去膜表面水分,称取质量记为m1;然后将膜置于真空烘箱烘干至质量恒定,称取质量,记为m2。用下式计算孔隙率:
式中:A为纤维膜表面积,cm2;Ld为膜厚,cm;ρ为去离子水的密度,取1 g/cm3。
1.7 纳米纤维膜的细胞毒性测试
采用浸提液法对生物医用材料进行毒性实验。将稀释好的RSC 96血旺细胞种植在96 孔细胞培养板中,置于37 ℃、5%的CO2的培养箱中培养24 h后,吸出旧的培养液,换入新的培养液,然后分别加入纳米纤维膜的浸提液,不加纤维膜的为空白组,在相同条件下分别培养12~96 h。取出细胞培养板,在各孔中加110 uL的CCK8 培养基混合液,在细胞培养箱中放置30 min 后用酶标仪在450 nm 下测定各孔的吸光度,取平均值并通过与对照组比较来判断细胞的毒性,计算方法 :细胞的相对增殖率P=实验组吸光度/对照组吸光度×100%。细胞毒性划分标准:细胞相对增殖度大于等于100%为0级,75%~99%为1级,50%~74%为2级,25%~49%为3级,1%~24%为4 级,0为5 级。
1.8 体外细胞培养
为观察细胞在材料上的粘附能力及形态,所有材料用75%乙醇浸泡5 min进行消毒,然后用无菌PBS清洗,每次5 min,重复3次;随后将材料放入细胞培养板,每孔大约接种2×103个/mL的RSC96血旺细胞,放入细胞培养箱培养72 h作为扫描电镜观察的标本,待培养时间到达后,先吸出旧培养液,然后用PBS洗3次,再用4%戊二醛固定4 h,随后进行乙醇梯度脱水各10 min、50%叔丁醇和纯叔丁醇各处理10 min,最后用冻干机冷冻干燥,喷金后用扫描电镜观察其表面形貌。
2 结果与讨论
2.1 化学结构分析
图2 为SA、P(3HB-co-4HB)和P(3HB-co-4HB)/SA(SA质量分数为6%)纤维膜的红外光谱图。可以看出:SA在1 624和1 416 cm-1处存在明显的吸收特征峰,为SA大分子六元环上COO-的不对称伸缩振动峰和对称伸缩振动峰,在3 435 cm-1处为O—H伸缩振动峰[14];P(3HB-co-4HB)的酯基峰在1 726 cm-1处,羰基峰在1 340和1 186 cm-1处;P(3HB-co-4HB)/SA纤维膜的特征峰基本上是SA和P(3HB-co-4HB)吸收峰的加和,没有明显新峰出现,说明二者以共混为主,但观察可发现纤维膜在3 435 cm-1处的羟基的吸收峰强度变大,峰变窄,这是由于SA中存在大量羟基、羧酸基,P(3HB-co-4HB)存在大量的酯基,APG也存在大量的羟基和醚基,三者之间易形成如图3所示的氢键作用,正是这种氢键作用保证了溶液的均匀稳定。
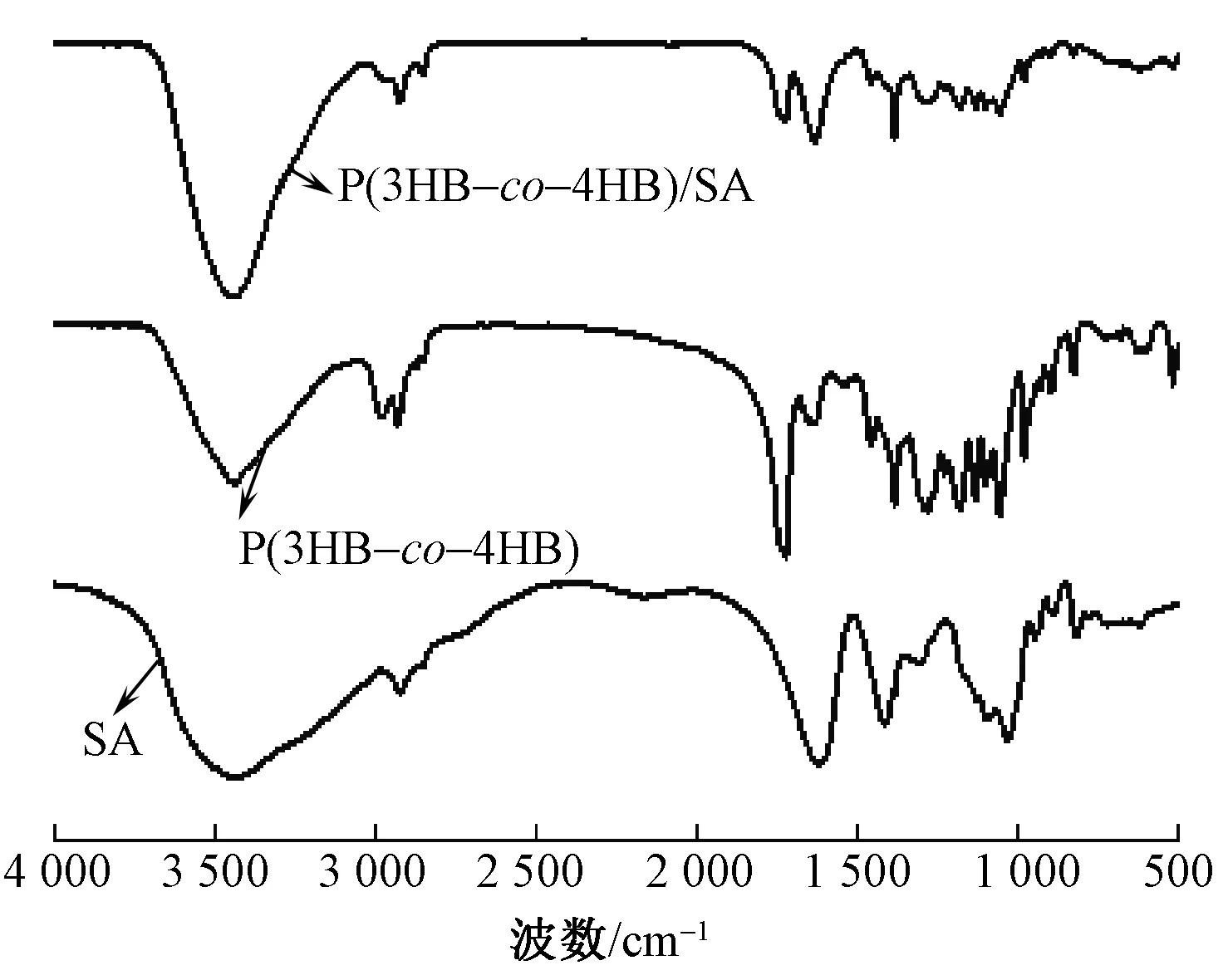
图2 SA、P(3HB-co-4HB) 和P(3HB-co-4HB)/SA的 红外光谱图Fig.2 Infrared spectrum of SA,P(3HB-co-4HB) and P(3HB-co-4HB)/SA composites
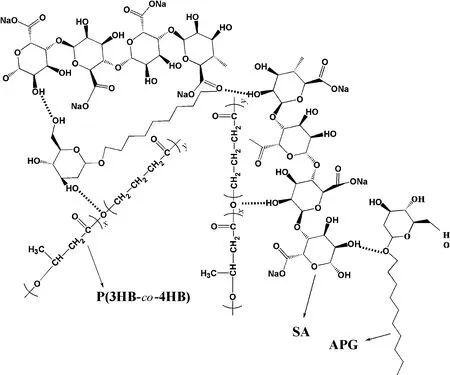
图3 氢键结构示意图Fig.3 Schematic diagram of hydrogen bonding
2.2 相容性分析
图4示出P(3HB-co-4HB)和P(3HB-co-4HB)/SA (SA质量分数为6%)纤维膜的差示扫描量热(DSC)曲线。可以看出,P(3HB-co-4HB)的玻璃化转变温度为-12.09 ℃,P(3HB-co-4HB)/SA纤维膜出现2个玻璃化转变温度,分别为-12.09和-4.37 ℃。原因可能是:P(3HB-co-4HB)与SA为不相容体系,可借助乳化剂APG形成稳定溶液,但在成形过程中可能会产生微相分离,其中一相为P(3HB-co-4HB),对应玻璃化转变温度-12.09 ℃;另一相为P(3HB-co-4HB)与SA的复合相,对应玻璃化转变温度-4.37 ℃,产生复合相的原因是SA分子刚性较强,其可发生相对分子质量的伸展,但不能有效的形成链缠结,导致空间位阻变大,玻璃化转变温度升高。由此可推断,APG实现了P(3HB-co-4HB)与SA的部分相容。

图4 P(3HB-co-4HB)和P(3HB-co-4HB)/SA的DSC曲线Fig.4 DSC curves of P (3HB-co-4HB) and P(3HB-co-4HB)/ SA
2.3 纤维形貌和孔隙率分析
图5示出P(3HB-co-4HB)/SA纳米纤维膜的扫描电镜照片。表1为其相对应的直径和孔隙率测试结果。由图5和表1可知,在SA质量分数小于或等于8%时,P(3HB-co-4HB)/SA纤维的直径随着SA质量分数的提高而增大,之后随SA质量分数的增大有减小趋势,当SA的质量分数为6%时,纤维形态最好,纤维直径分布比较均匀集中,没有明显的珠粒现象,纤维的平均直径为500 nm。当SA的质量分数大于8%时,纤维出现明显的异质化、断丝和缠结,这是由于SA质量分数过高,体系黏度增大,分化作用减小、可纺性变差。由表1还可见,纤维膜的孔隙率随着SA质量分数变化呈现先减小后增大趋势,在SA质量分数为10%时达到最大值89%,这是因为直径比较小的纤维具有大的比表面积,更易产生芯吸效应,从而吸附水分子,使孔隙率变大。但当SA质量分数为12%时,因为形成了过多的珠粒,占据了较大的体积,所以导致纤维膜孔隙率有所下降。高的孔隙率有利于细胞的培养,同时也可作为营养物质及新陈代谢的通道。

图5 不同SA质量分数纤维膜的扫描电镜照片(×5 000)Fig.5 SEM images of fiber membrane with different SA mass fractions(×5 000)

表1 不同SA质量分数纤维膜的直径和孔隙率Tab.1 Average diameter and porosity of fiber membrane with different SA mass fractions
2.4 细胞毒性分析
表2示出纤维膜对神经细胞增殖影响。
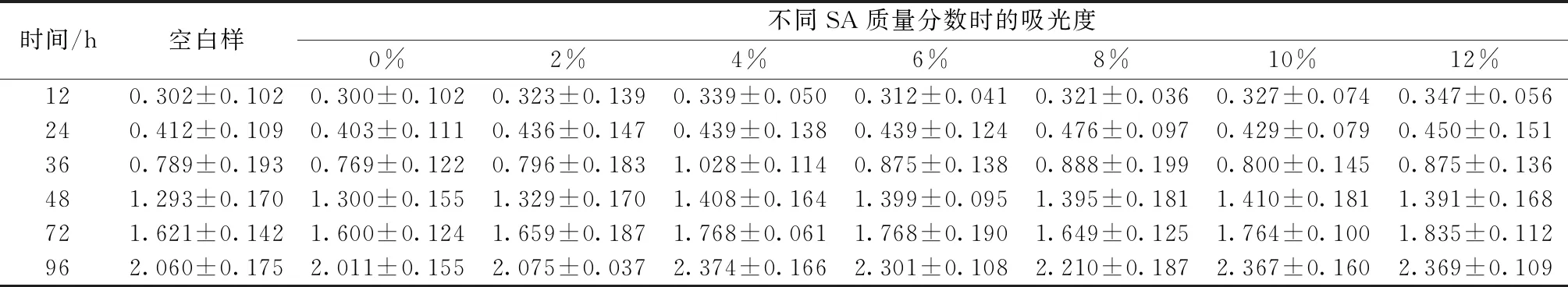
表2 不同SA质量分数纤维膜浸提液的吸光度值Tab.2 Optical density values of fiber membrane with different SA mass fractions
由表2可以看出,P(3HB-co-4HB)纳米纤维虽然无毒,但其浸提液的分级几乎都为1级,而P(3HB-co-4HB)/SA纤维膜浸提液的细胞相对增殖度均大于90%,为0级和少量的1级,不具有细胞毒性。可认为P(3HB-co-4HB)/SA纳米纤维具有良好的细胞相容性和生物安全性,能作为医用材料。
2.5 细胞体外培养形貌分析
图6为P(3HB-co-4HB)和添加不同SA质量分数P(3HB-co-4HB)/SA纤维膜体外细胞培养扫描电镜照片。对比可见,加入SA的膜的细胞数量明显增多,细胞伸出了较多的伪足,且呈现出扁平的形态,紧密地贴附在材料表面。产生这种现象的原因与P(3HB-co-4HB)/SA纤维膜中SA的质量分数相关,即SA的质量分数越高,材料的生物相容性相对越好,越有利于细胞的生长、粘附。

图6 不同SA质量分数纤维膜的体外细胞培养 扫描电镜照片(×500)Fig.6 SEM images of vitro cell culture of fiber membrane with different SA mass fractions(×500)
3 结 论
本文利用烷基糖苷(APG)成功地将聚羟基脂肪酸酯(P(3HB-co-4HB))和海藻酸钠(SA)复合在一起,二者之间可形成稳定的乳液。当SA质量分数为6%时,纤维平均直径为500 nm,纤维表面致密光滑。与P(3HB-co-4HB)纤维膜相比,加入一定量SA的纤维膜的浸提液的分级均大于90%,毒性几乎都为0级,不具有细胞毒性且可促进细胞增长的作用,SA质量分数越高,越有利于细胞在P(3HB-co-4HB)/SA纳米纤维表面的生长、粘附,P(3HB-co-4HB)/SA复合纤维膜较P(3HB-co-4HB)纳米纤维膜有更好的细胞相容性和生物安全性。
