介孔有机硅为载体的纳米递送系统制备及其体外化疗-光热联合治疗性能研究
2021-01-05曾雨淋陈佳杰田正芳朱敏朱钰方
曾雨淋, 陈佳杰, 田正芳, 朱敏, 朱钰方,3
介孔有机硅为载体的纳米递送系统制备及其体外化疗-光热联合治疗性能研究
曾雨淋1,2, 陈佳杰1,3, 田正芳2, 朱敏1, 朱钰方2,3
(1. 上海理工大学 材料科学与工程学院, 上海 200093; 2. 黄冈师范学院 化学化工学院, 催化材料制备及应用湖北省重点实验室, 黄冈 438000; 3. 中国科学院 上海硅酸盐研究所, 上海 200050)
有机/无机杂化的介孔有机硅纳米颗粒因其高的比表面积、丰富的介孔孔道、功能性的骨架以及高的药物装载量等特点而在生物医学领域受到广泛关注。本研究提出以二硫键桥接的有机/无机杂化介孔有机硅纳米颗粒为载体共装载化疗药物和光热剂, 设计制备以DNA分子作为控释“开关”修饰介孔有机硅纳米颗粒的纳米递送系统(ICG/DOX-MONs @DNA20)。该纳米递送系统结合了光热剂的光热效应以及DNA分子随温度升高而从颗粒表面脱附的特性, 可实现近红外光照射激发药物在肿瘤细胞中的控制释放, 同时获得药物化疗–光热联合治疗肿瘤的效果。实验结果表明, 纳米递送系统在近红外光照下能迅速升温至43 ℃以上的热疗温度, 而且在37 ℃条件下6 h内仅缓慢释放药物12.3%, 而当温度升至43 ℃时则快速释放药物52.4%; 细胞实验显示该纳米递送系统能够被HeLa肿瘤细胞吞噬, 在近红外光照下有明显的药物化疗-光热联合治疗效果。因此, ICG/DOX-MONs@DNA20纳米递送系统在药物化疗-光热联合治疗肿瘤方面具有应用前景。
介孔有机硅; 纳米载体; 控制释放; 联合治疗
恶性肿瘤已成为当今世界威胁人类健康的主要疾病之一。药物化疗是临床上肿瘤治疗的主要方法, 但是高毒性的化疗药物往往对机体造成严重的毒副作用, 且肿瘤细胞容易产生耐药性而降低治疗效 果[1-4]。因此, 除药物化疗外, 人们不断探寻新型的肿瘤治疗方式, 以提高肿瘤临床治疗效果。其中, 光热治疗通过近红外光辐照在肿瘤部位聚集的光热剂而产生热量, 使得局部温度快速上升而导致肿瘤细胞消融, 具有外源性控制、无创、低副作用等优势[5], 是实现肿瘤精准治疗的有效策略之一。源于肿瘤的复杂性和多样性以及以提高肿瘤治疗效果为目的, 目前肿瘤治疗研究已经从单一疗法逐步向联合疗法发展[6-13]。已经有研究表明, 药物化疗与光热治疗的联合治疗模式, 不仅可以发挥各自治疗方式的治疗效果, 而且光热治疗引起的局部温度升高可以提高肿瘤细胞对化疗药物的敏感性而增强药物化疗的治疗效果。因此, 药物化疗与光热治疗的联合治疗模式显示出显著的超加性(即“1+1>2”)效应[14], 其协同治疗效果明显高于单一疗法。
研究表明, 纳米材料能够通过肿瘤的高通透性和滞留效应(Enhanced permeability and retention effect, EPR)在肿瘤部位富集。基于纳米颗粒载体的肿瘤治疗方式, 将化疗药物和光热剂通过有效手段装载于纳米颗粒载体, 能够防止药物和光热剂在血液循环或健康组织中的提前释放, 成为改善治疗效果和降低毒副作用的途径之一[3,15]。近几十年来, 有机胶束、脂质体、生物降解高分子、水凝胶、无机纳米粒子等各种纳米材料作为载体递送药物等诊疗剂, 其中有机纳米载体化学性质不稳定, 容易造成药物等诊疗剂的崩解释放, 无机纳米颗粒则面临生物降解性差等问题[16-18]。已有研究表明, 有机/无机杂化纳米颗粒兼具有机纳米材料和无机纳米颗粒的优点, 能有效改善溶血[19]、增强生物降解性[20-21]以及降低细胞毒性等, 因此在纳米递送系统领域具有良好的应用前景[22]。已有研究将有机/无机杂化的介孔有机硅纳米颗粒用于药物递送、成像引导的药物化疗等[6,23], 但以介孔有机硅纳米颗粒构建纳米递送系统用于药物化疗-光热联合治疗肿瘤的研究还未见报道。
本研究提出以二硫键桥接的有机/无机杂化介孔有机硅纳米颗粒(Mesoporous organosilica nanoparticles, MONs)为载体共装载化疗药物(阿霉素DOX)和光热剂(吲哚菁绿ICG), 设计以DNA分子作为控释“开关”修饰介孔有机硅纳米颗粒的纳米递送系统。该纳米递送系统结合了ICG的光热效应以及DNA分子随温度升高而从MONs表面脱附的特性来激发DOX和ICG在肿瘤细胞中的控制释放, 同时获得药物化疗-光热联合治疗肿瘤的效果。
1 实验方法
1.1 药品及试剂
正硅酸四乙酯(TEOS, AR)、十六烷基三甲基氯化铵(CTAC, AR)、三乙醇胺(TEA, AR)、双-[γ-(三乙氧基硅)丙基]-二硫化物(BTDS)、无水甲醇(AR)、无水乙醇(≥99.7%)、无水甲苯(AR)、3-氨基三乙氧基硅烷(APTES, 98%)、浓盐酸(HCl, 36%~38%)、盐酸阿霉素(DOX, 98%)、吲哚菁绿(ICG)、-羟基琥珀酰亚胺(NHS)、吗啉乙磺酸(MES)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)均购于国药集团化学试剂有限公司。DMEM培养基、胎牛血清(FBS)、青链霉素混合液、谷胱甘肽(GSH, ≥95%)和胰酶购买于上海润成生物有限公司。Cell Counting Kit-8 (CCK-8试剂盒)购自上海碧云天生物技术有限公司。磷酸盐药片、DNA购自生工生物工程(上海)有限公司, DNA序列为5’-COOH-(CH2)6-ACT CCT GGT ATG TAG CGC TA.
1.2 介孔有机硅纳米颗粒的合成及氨基修饰
二硫键桥接的MONs制备参照文献报道的方法[21,25]: 2 g CTAC和1 mL TEA的水溶液(10wt%)加入20 mL去离子水, 置于80 ℃油浴中加热搅拌至其完全溶解; 接着滴加1 mL TEOS和0.2 mL BTDS的均匀混合液, 继续反应4 h后将白色沉淀进行高速离心和乙醇洗涤数次, 得到含有结构导向剂的MONs。结构导向剂去除采用盐酸乙醇溶液萃取法, 即将含有结构导向剂的MONs超声分散于300 mL盐酸乙醇溶液(HCl:EtOH= 1: 10)中, 于80 ℃条件下油浴回流12 h, 离心分离并收集沉淀, 此萃取过程重复3次后用乙醇洗涤颗粒, 于80 ℃真空干燥后得到MONs。MONs的氨基修饰过程如下: 将100 mg MONs超声分散于40 mL无水甲苯中, 并在100 ℃油浴中处理2 h以除尽体系中的水分; 然后向上述悬浮液中加入1.5 mL APTES, 在100 ℃条件下回流20 h后高速离心分离, 最后将离心产物用甲苯和乙醇洗涤3次后于60 ℃下真空干燥, 即得到氨基修饰的MONs (MONs-NH2)。
1.3 药物/光热剂装载及包封
本研究以MONs-NH2为载体, 选用DOX为模型药物、ICG为光热剂、羧基修饰的链长为20碱基的DNA(DNA20)为控释“开关”构建纳米递送系统。将ICG和DOX分别配制成0.5和1 mg/mL的甲醇溶液, 各取10 mL溶液混合后加入20 mg MONs-NH2,然后于室温条件下避光搅拌24 h。最后离心分离–甲醇洗涤–离心分离后得到ICG和DOX共装载的MONs(ICG/DOX-MONs)。
DNA20包封过程如下[25-26]: 将DNA20配制成浓度为100 μmol/L的水溶液, 并于–20 ℃保存备用。取50 μL DNA20溶液, 加入50 μL EDC溶液(20 mg/mL)振荡2 min后, 再加入30 μL NHS溶液(20 mg/mL), 继续振荡20 min以活化DNA20的5’端羧基; 然后, 将活化的DNA20溶液加入到2 mL ICG/DOX-MONs的MES(10 mmol/L, pH 6.0)悬浮液中, 室温避光摇晃24 h后得到DNA20包封的ICG/DOX-MONs (ICG/DOX-MONs@DNA20)。最后, 离心分离并用PBS缓冲液洗涤三次后分散于PBS缓冲液中备用。
1.4 结构与理化性能表征
采用Tecnai G2 F30型场发射电子透射显微镜和FEI Quanta 450型场发射电子显微镜观察颗粒的形貌和微观结构。采用Tristar 3020型比表面积和孔径分析仪测定样品的比表面积和孔径分布。采用Nanodrop 2000C型超微量紫外–可见光分光光度计测定药物/光热剂的装载与释放。采用808 nm近红外激光发生器和FLIR AX5 series型红外成像仪测定样品的光热性能。红外图谱采用KBr压片法, 在LAM750型红外光谱仪上测定。采用Epoch型酶标仪测定细胞存活率。采用Olympus IX73P1F型倒置荧光显微镜观察细胞吞噬情况。采用马尔文Nano-ZS90纳米粒径和电位分析仪测定动态光散射(DLS)颗粒粒径分布和颗粒表面Zeta电位。
1.5 光热性能测试
分别配制浓度为0、20、50、100、200、300 μg/mL的颗粒悬浮液, 取1 mL置于48孔板中。用808 nm光源进行照射, 功率密度为0.75 W/cm2, 光照时间为6 min, 使用热成像记录仪记录样品温度, 绘制样品温度随时间的变化曲线。另一方面, 对100 μg/mL颗粒悬浮液改变功率密度0.5、0.75、1、2 W/cm2, 光照6 min, 记录样品的升温曲线。
1.6 药物/光热剂释放性能研究
不同温度下的药物释放: 将ICG/DOX- MONs@DNA20颗粒分散于PBS溶液中得到1 mg/mL的颗粒悬浮液, 取5 mL分别在37和43 ℃的水浴中振荡, 每隔1 h取出15 μL液体同时补充15 μL新鲜缓冲液。使用Nanodrop 2000C测定其在480 nm (DOX)和780 nm (ICG)处的吸光度, 各测试3次, 绘制药物释放率随时间变化的曲线。另外, 采用相同的方法还测定了在37和43 ℃的交替温度情况下的DOX和ICG释放率。
1.7 体外细胞毒性评估
本研究以小鼠的子宫颈癌细胞(HeLa)为细胞模型, 培养基为DMEM, 培养基中加入10%(/)胎牛血清(FBS)、100 U/mL青霉素和100 mg/mL链霉素; 细胞培养在37 ℃、5% CO2气氛的CO2培养箱中。采用标准的CCK-8方法分析MONs的体外细胞毒性。将细胞均匀地播种在96孔板中, 细胞密度为4000个/孔, 培养24 h待细胞贴壁后去除培养基, 然后每孔加入100 μL MONs的DMEM溶液(浓度分别为0、12.5、25、50、100、200 μg/mL); 孵育24 h后, 吸取上层液体, 每孔加入100 μL PBS洗涤, 除去死细胞、细胞代谢物以及加入的颗粒; 接着每孔加入100 μL CCK-8溶液, 共孵育3 h后, 吸取上层液体用于酶标仪测定其450 nm处的吸光度。另一方面, 细胞与MONs共培养24 h后用PBS洗涤, 除去死细胞、细胞代谢物以及加入的颗粒后, 每孔再加入100 μL新鲜DMEM培养液继续培养24 h, 然后每孔加入100 μL CCK-8溶液, 共孵育3 h后, 吸取上层液体用于酶标仪测定其450 nm处的吸光度。将MONs溶液共培养组的活细胞数与空白对照组的活细胞数之间的比值作为细胞毒性分析的依据。
1.8 细胞吞噬
将HeLa细胞均匀播种在24孔板中, 细胞密度为5000个/孔, 待细胞贴壁后, 吸取培养基, 然后每孔加入500 μL的颗粒DMEM溶液(50 μg/mL), 空白组(不加颗粒)加入等体积的培养液; 与细胞共培养3 h后, 吸取上层液体, 接着用PBS洗涤2次以去除未被吞噬的颗粒; 每孔加入500 μL的多聚甲醛溶液(wt%)固定细胞15 min, 用DAPI将细胞核染色5 min; 最后, 细胞用PBS洗涤3次后用倒置荧光显微镜观察颗粒在细胞内的分布情况。
1.9 联合治疗
采用ICG/DOX-MONs颗粒为比较组研究ICG/DOX-MONs@DNA20的化疗–光热联合治疗效果: 配制浓度为100 μg/mL的 ICG/DOX-MONs和ICG/DOX-MONs@DNA20的DMEM溶液待用。将HeLa细胞均匀播种于96孔板中, 细胞密度为8000个/孔, 待细胞贴壁后吸取培养液, 加入100 μL颗粒悬浮液, 每种材料各加15个孔, 设为不光照、一次光照、两次光照三个组, 每组5个平行样, 空白组作为对照; 培养5 h后使用近红外光照射, 功率密度为2 W/cm2, 照射时间为3 min/孔; 照射后的细胞继续培养3 h后, 两次光照组重复上述光照操作, 光照后继续培养3 h。然后采用与上述颗粒细胞毒性测试相同的CCK-8方法测定细胞活性。
2 结果与讨论
2.1 MONs的微观形貌及结构
MONs颗粒的形貌如图1(a, b)所示。MONs 颗粒为球形, 颗粒尺寸均匀, 粒径约45 nm; DLS测试颗粒粒径尺寸比SEM和TEM观察粒径略大(图1(c)), 这是因为DLS测试得到的是颗粒的水合粒径, 同时也与部分颗粒轻微团聚有关。放大的TEM照片中能清晰看到均匀的介孔孔道分布。图1(d)的N2吸附脱附等温线及相应的孔径分布图也表明MONs具有介孔结构, 其比表面积为444.5 m2/g, 平均孔径约为4.5 nm。因此, MONs可作为纳米载体装载药物、光热剂等客体分子。
2.2 纳米递送系统制备及其理化性能
本研究的ICG/DOX-MONs@DNA20纳米递送系统制备包括MONs表面氨基修饰、ICG/DOX装载和DNA20包封。图2(a, b)为ICG/DOX-MONs @DNA20纳米递送系统制备过程各阶段颗粒表面Zeta电位变化和红外光谱图。由图可以看出, MONs的氨基修饰使颗粒表面Zeta电位由–16.9 mV变为+24.2 mV, 且红外图谱在1472 cm–1处出现氨基的弯曲振动峰, 表明氨基成功修饰在MONs表面[27-28]。
由于ICG和DNA分子为负电荷, ICG/DOX的装载和DNA20包封使得颗粒表面Zeta电位逐步降低。在ICG/DOX-MONs@DNA20颗粒的红外图谱上出现酰胺键中—C==O—的特征振动峰(1640 cm–1)[29],这是由于DNA20包封ICG/DOX-MONs颗粒是通过DNA20的5’端羧基和ICG/DOX-MONs颗粒表面氨基之间的酰胺化反应实现的, 也证明DNA20的成功包封。另一方面, ICG/DOX-MONs@DNA20纳米递送系统制备过程各阶段颗粒的紫外–可见光光谱中的特征吸收峰的变化也进一步表明ICG/DOX的装载和DNA包封的成功实现。同时, 利用紫外–可见光光谱分析计算, 得到DOX和ICG的装载量分别为27.2和69.9 μg/mg, 负载率分别为8.2%和21.0%。
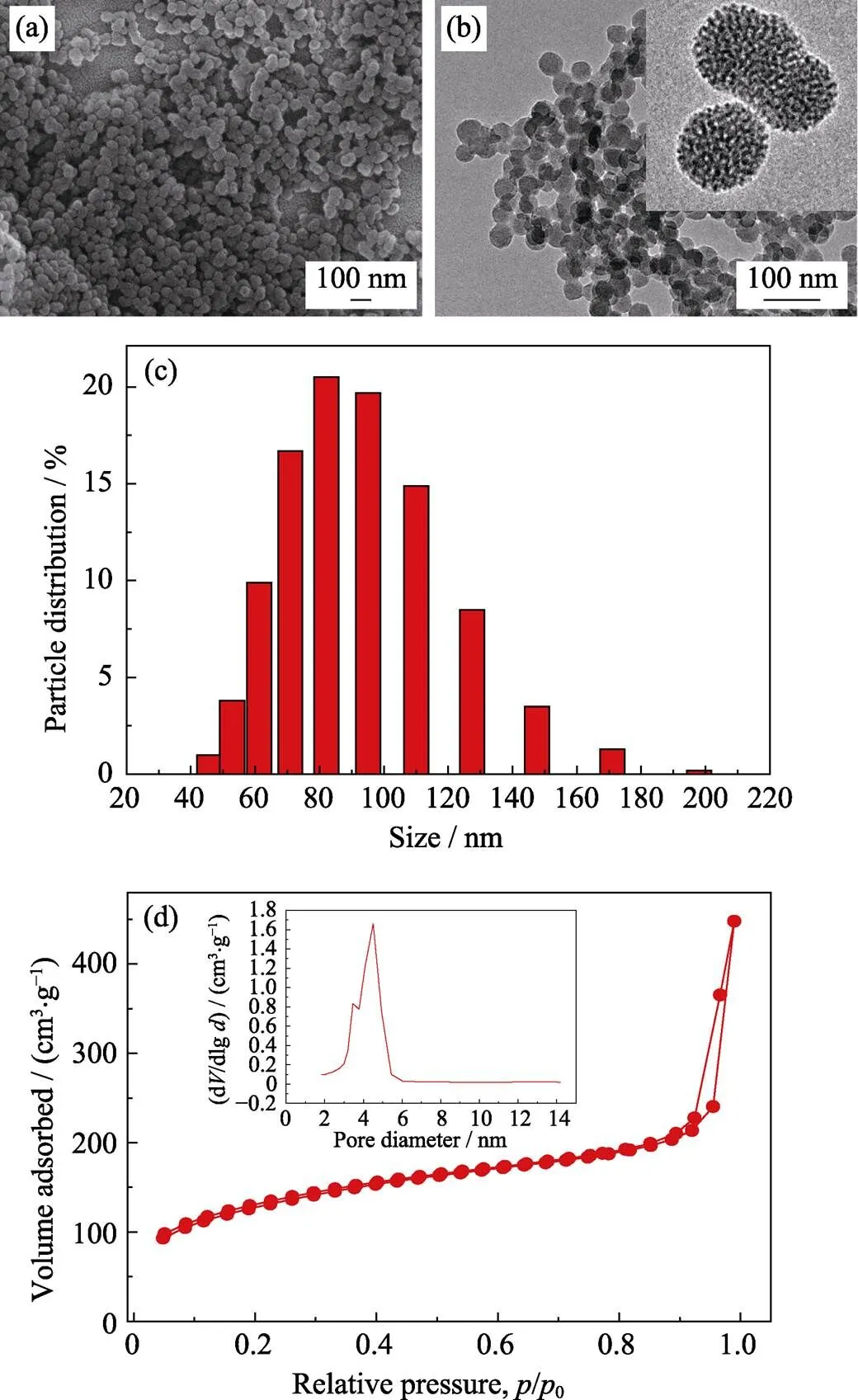
图1 MONs的形貌、结构表征
(a) SEM image of MONs; (b) TEM images of MONs; (c) DLS particle size distribution of MONs; (d) N2adsorption-desorption isotherm and the corresponding pore size distribution of MONs
2.3 纳米递送系统的光热性能
因ICG为FDA批准临床使用的医疗诊断菁染料, 具有光热效应。本研究将ICG装载于纳米递送系统, 赋予了纳米递送系统光热性能。图3为ICG/DOX-MONs@DNA20颗粒的光热升温曲线。
由图可见, 在光功率密度为0.75 W/cm2的近红外光照射下, 不同浓度的颗粒悬浮液温度随浓度增加而升高; 当颗粒悬浮液浓度为200 μg/mL时, 近红外光照射6 min可使悬浮液温度从26 ℃升至50℃(图3(a))。另一方面, 在颗粒悬浮液浓度一定的情况下, 悬浮液温度随光功率密度增加而升高(图3(b)), 即调节近红外光的光功率密度可以控制纳米递送系统的升温情况。因此, ICG的光热效应没有因MONs的装载而失效, ICG/DOX-MONs@DNA20纳米递送系统的光热效应能满足光热治疗要求。另一方面, 热效应能够破坏DNA20与颗粒表面的作用力, 使得DNA20从颗粒表面脱附而打开颗粒的介孔孔道, 实现DOX和ICG的可控释放[24]。
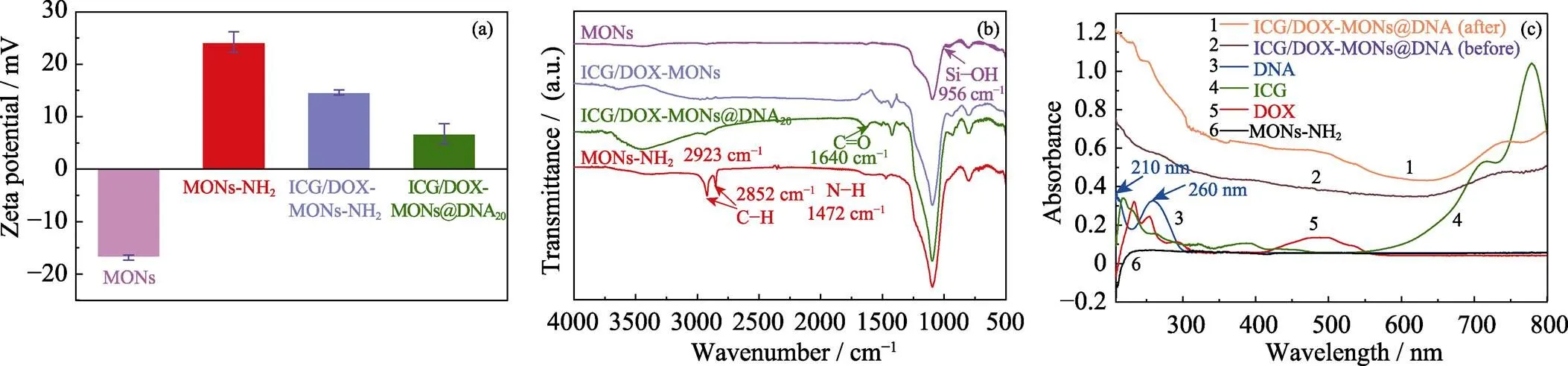
图2 MONs、MONs-NH2、ICG/DOX-MONs和ICG/DOX-MONs@DNA20纳米颗粒的(a)Zeta表面电位变化, (b)FT-IR谱图, 及(c)UV-Vis光谱图
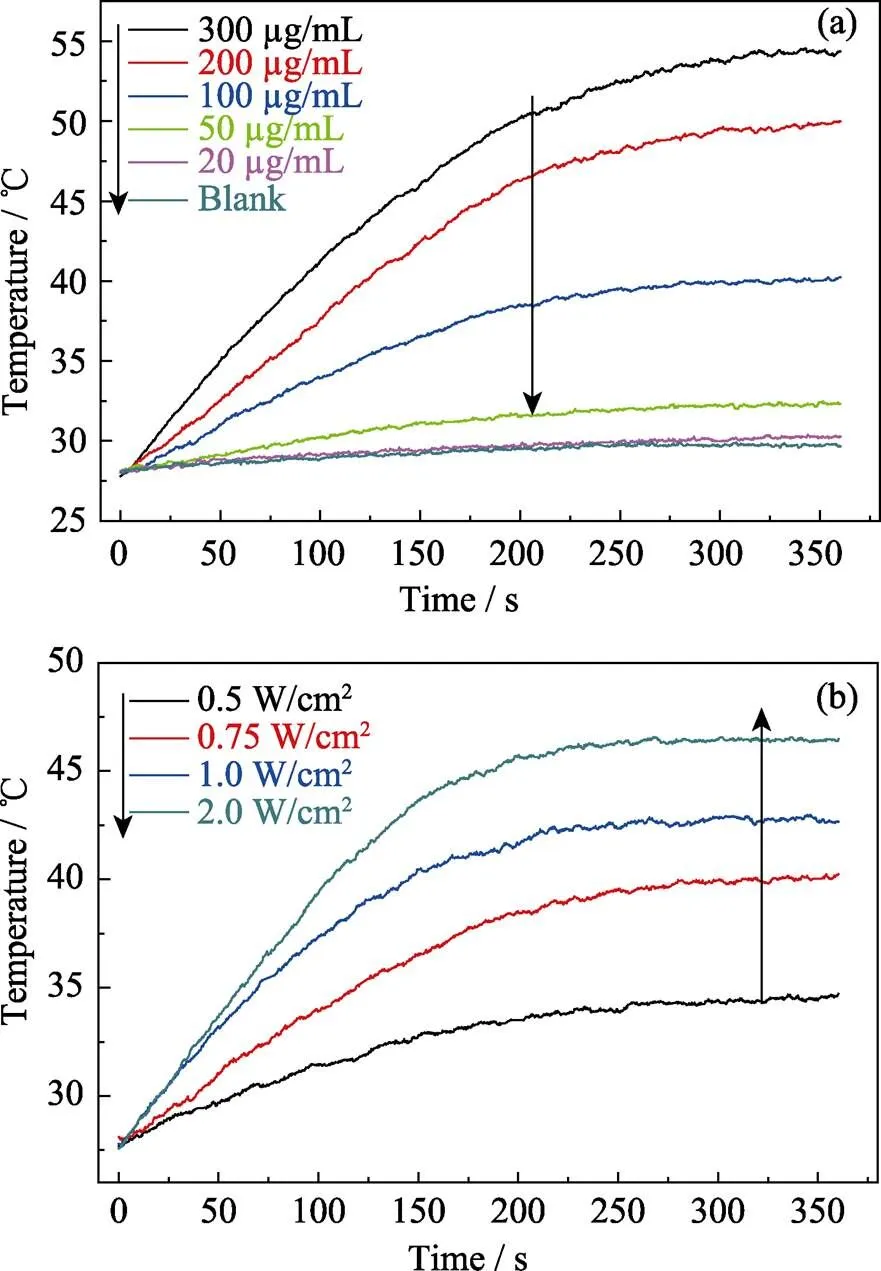
图3 (a)不同浓度ICG/DOX-MONs@DNA20悬浮液在0.75 W/cm2的近红外光照射下的光热升温曲线与(b) 100 μg/mL的ICG/DOX-MONs@DNA20悬浮液在不同功率密度的近红外光照射下的光热升温曲线
2.4 纳米递送系统的药物释放性能
图4(a,b)为ICG/DOX-MONs@DNA20纳米递送系统在37和43 ℃缓冲液中DOX和ICG的释放曲线。由图可见, 在37和43 ℃的缓冲液中释放6 h, DOX的释放量分别为12.3%和52.4%, ICG的释放量分别为26.4%和71.1%, 表明该纳米递送系统具有明显的温度控制释放性能, 即在43 ℃下可快速释放DOX和ICG, 而在37 ℃下只能非常缓慢地释放DOX和ICG。一方面, 这样的温度控制释放可一定程度上防止药物提前释放; 另一方面43 ℃也达到了热疗温度范围, 纳米递送系统的光热效应满足周围温度达到43 ℃, 因而可实现光热诱导药物控制释放。
因DNA20的5’端羧基与颗粒表面氨基以酰胺键结合, 而其余部分则通过静电作用吸附于颗粒表面, 因此小范围的温度变化可破坏较弱的静电作用, 而不影响酰胺键结合[24]。所以通过小范围的温度变化有可能控制DNA20与颗粒表面的静电作用强弱, 从而实现DNA20包封介孔孔道的“开启”和“关闭”状态。图4(c)为ICG/DOX-MONs@ DNA纳米递送系统在37~43 ℃交替温度条件下的DOX和ICG释放曲线。由图可见, 当温度从37 ℃升高到43 ℃并保持1 h, DOX和ICG都出现快速释放; 当温度从43 ℃降至37 ℃并保持10 h, DOX和ICG的释放则非常缓慢。重复升温和降温的条件, DOX和ICG的释放情况呈现相似的趋势。因此, ICG/DOX-MONs@ DNA20纳米递送系统可通过温度变化实现可逆的孔道“开启”和“关闭”状态, 更好地控制DOX和ICG的释放。
2.5 材料的细胞毒性及细胞吞噬
图5为MONs与HeLa细胞共培养24和48 h后的细胞毒性。由图可以看出, MONs与细胞共培养24 h后, HeLa细胞活性未受MONs影响, 即使颗粒浓度高达200 μg/mL, 细胞存活率仍高达98.4%。为了观察MONs在被细胞吞噬后对细胞的毒性影响, 对与MONs共培养24 h后的细胞去除未被吞噬的颗粒, 继续培养24 h后测定细胞存活率。结果显示, MONs被细胞吞噬后继续培养24 h, HeLa细胞的存活率与共培养24 h后的细胞存活率都没有显著性差异, 表明细胞在一定的颗粒浓度下吞噬MONs后不会对其细胞活性产生影响。因此, MONs具有较低的细胞毒性。
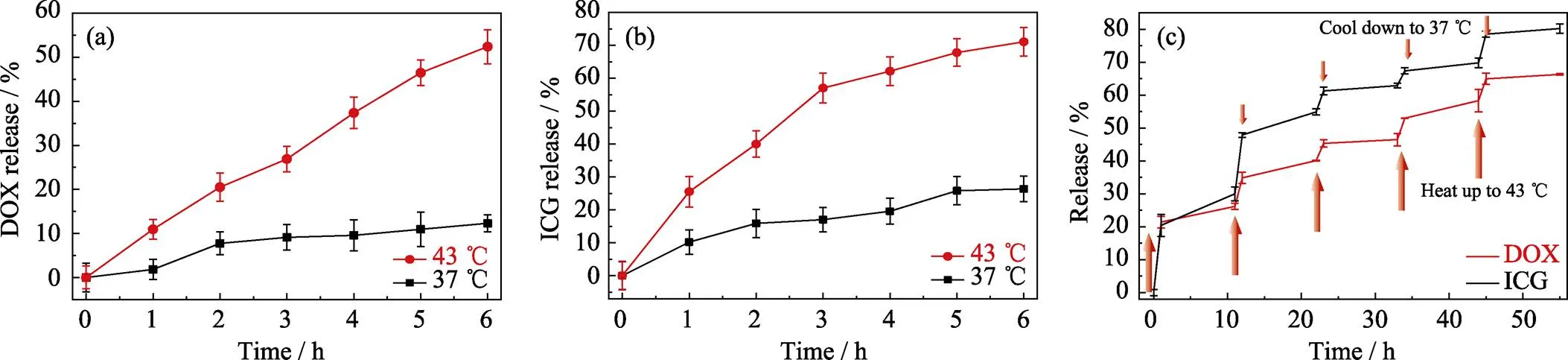
图4 ICG/DOX-MONs@DNA20在37和43 ℃条件下的(a) DOX和(b) ICG的释放曲线, 以及(c) ICG/DOX-MONs@DNA20在37和43 ℃交替变温条件下的DOX和ICG的释放曲线

图5 MONs对HeLa细胞与不同浓度MONs共培养24和48 h后的细胞活性情况
肿瘤细胞吞噬纳米递送系统会对后续治疗效果产生重要影响。本研究采用倒置荧光显微镜观察了HeLa细胞吞噬颗粒的结果。如图6所示, 在激发光照射下的细胞核因被DAPI染色而发出蓝色荧光; 因DOX在激发光照射下发红色荧光, 对于ICG/DOX-MONs和ICG/DOX-MONs@DNA20颗粒, 可观察到红色荧光紧密围绕着细胞核, 表明HeLa细胞能够吞噬ICG/DOX-MONs和ICG/DOX-MONs @DNA20颗粒, 因而使DOX和ICG的肿瘤细胞内递送成为可能, 从而提高递送效率和肿瘤治疗效果。
2.6 药物化疗–光热联合治疗
为了进一步评估ICG/DOX-MONs@DNA20纳米递送系统的近红外光照激发药物释放的药物化疗联合光热治疗的效果, 以空白组和ICG/DOX-MONs组为对照组, 分别测定纳米递送系统与HeLa细胞共培养后在不光照、一次光照和两次光照条件下HeLa细胞的存活率。
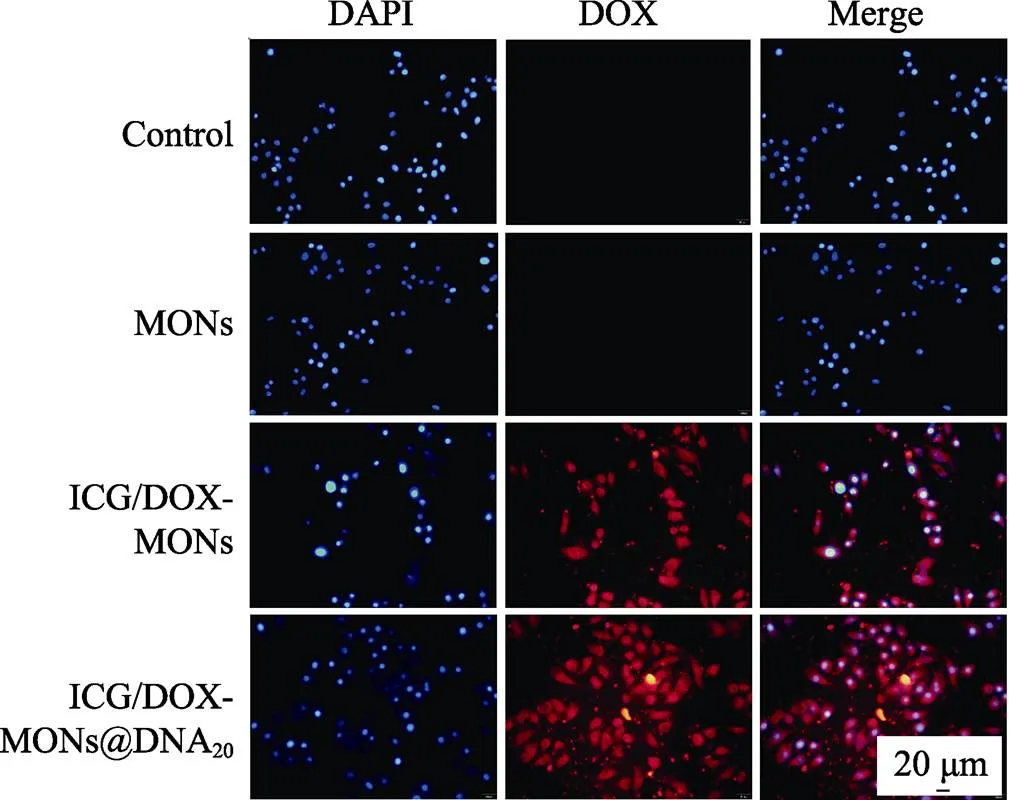
图6 HeLa细胞与不同颗粒共培养3 h后的细胞吞噬不同颗粒结果(蓝色: 细胞核; 红色: DOX)
如图7所示, 在无近红外光照条件下, ICG/DOX-MONs@DNA20组无细胞毒性, 表明纳米递送系统的DNA包封可有效防止DOX大量泄漏; ICG/DOX-MONs组则产生明显的细胞毒性, 这是由于DOX从颗粒中缓释而引起细胞死亡。经过一次近红外光照后, ICG/DOX-MONs组的细胞活性下降了25.1%, 而ICG/DOX-MONs@DNA20组的细胞活性则由94.0%下降至37.4%, 这是由于DNA20包封组在近红外光照后升高温度而释放孔道中的DOX, 从而获得药物化疗–光热联合治疗效果; 而ICG/DOX-MONs颗粒由于提前释放DOX, 近红外光照只产生光热治疗效果。经过两次近红外光照后, ICG/DOX-MONs组的细胞活性基本不再下降, 这是由于ICG的光热不稳定性而造成光热治疗失效; ICG/DOX-MONs@DNA20组的细胞活性仍下降了约17%, 这是由于第二次近红外光照将继续释放DOX, 而且ICG因MONs保护而仍然具有光热效应, 因而继续发挥药物化疗–光热联合治疗效果。以上结果表明ICG/DOX-MONs@DNA20纳米递送系统能够将药物和光热剂高效递送到肿瘤细胞, 在近红外光照射下获得药物化疗–光热联合治疗效果。

图7 HeLa细胞与ICG/DOX-MONs和ICG/DOX-MONs@ DNA20共培养后在有或无近红外光照下的细胞存活率
3 结论
本研究设计制备了以二硫键桥接的有机/无机杂化MONs为载体共装载化疗药物DOX和光热剂ICG, 并以DNA分子包封MONs表面的ICG/DOX- MONs@DNA20纳米递送系统。在近红外光照射下, ICG/DOX-MONs@DNA20纳米颗粒具有光热效应, 能够产生热量使颗粒周围温度达到光热治疗的温度要求。另一方面, ICG/DOX-MONs @DNA20纳米颗粒在37 ℃条件下仅缓慢释放DOX和ICG, 而当温度升至43 ℃时表现出DOX和ICG的快速释放, 因而具有光热诱导药物控制释放性能。细胞实验结果表明ICG/DOX-MONs@DNA20纳米递送系统能够被肿瘤细胞吞噬, 并且在近红外光照下显示出明显的药物化疗–光热联合治疗效果。因此, ICG/DOX- MONs@DNA20纳米递送系统在药物化疗–光热联合治疗肿瘤方面具有应用前景。
[1] WEN JIA,YANG KUI, LIU FENG-YU,. Diverse gatekeepers for mesoporous silica nanoparticle based drug delivery systems., 2017, 46(19): 6024–6045.
[2] ZHANG YA-RU, LIN RUN, LI HONG-JUN,. Strategies to improve tumor penetration of nano-medicines through nanoparticle design., 2019, 11(1): e1519–1–12.
[3] QIAO YI-TIAN, WAN JIAN-QIN, ZHOU LI-QIAN,. Stimuli- responsive nanotherapeutics for precision drug delivery and cancer therapy., 2019, 11(1): e1527–1–20.
[4] OVERCHUK MARTA, ZHENG GANG. Overcoming obstacles in the tumor microenvironment: recent advancements in nanoparticle delivery for cancer theranostics., 2018, 156: 217–237.
[5] VANKAYALARAVIRAJ,HWANG KUO-CHU. Near-infrared-light- activatablenanomaterial mediated phototheranostic nanomedicines: an emerging paradigm for cancer treatment., 2018, 30(23): 1706320–1–7.
[6] HAYASHIKOICHIRO,MARUHASHITAKUMA. One-pot synthesis of dual stimulus-responsive degradable hollow hybrid nanoparticles for imageguided trimodal therapy., 2016, 26(47): 8613–8622.
[7] WANG ZHENG, ZHANG FAN, SHAO DAN,. Janus nanobullets combine photodynamic therapy and magnetic hyperthermia to potentiate synergetic anti-metastatic immunotherapy., 2019, 6(22): 1901690–1–10.
[8] FAN WEN-PEI, LU NAN, HUANG PING. Glucose-responsive sequential generation of hydrogen peroxide and nitric oxide for synergistic cancer starving-like/gas therapy., 2017, 56(5): 1229–1233.
[9] FAN WEN-PEI, LU NAN, SHEN ZHE-YU. Generic synthesis of small-sized hollow mesoporous organo-silica nanoparticles for oxygen-independent X-ray-activated synergistic therapy., 2019, 10(1): 1–14.
[10] WU JIAN-RONG, BREMNER DAVID H, NIU SHI-WEI,. Chemodrug-gated biodegradable hollow mesoporous organosilica nanotheranostics for multi-modal imaging-guided low-temperature photo-thermal therapy/chemotherapy of cancer., 2018, 10(49): 42115–42126.
[11] LI ZHEN-LI, HAN JUN, YU LUO-DAN,. Synergistic sonodynamic/chemotherapeutic suppression of hepatocellular carcinoma by targeted biodegradable mesoporous nanosonosensitizers., 2018, 28(26): 1800 145–1–16.
[12] LI LING, YANG ZHEN, FAN WEN-PEI,.polymerized hollow mesoporous organosilica bio-catalysis nanoreactor for enhancing ROS-mediated anticancer therapy., 2020, 30(4):1907716–1–11.
[13] CHEN JIA-JIE, LIU JIA-XING, HU YA-PING,. Metal-organic framework-coated magnetite nano-particles for synergistic magnetic hyperthermia and chemotherapy with pH-triggered drug release., 2019, 20(1): 1043–1054.
[14] FAN WEN-PEI, YUNG BRYANT, HUANG PING. Nanotechnology for multimodal synergistic cancer therapy., 2017, 117(22): 13566–13638.
[15] PRASAD MINAKSHI, LAMBE UPENDRA P,. Nanotherapeutics: an insight into healthcare and multi-dimensional applications in medical sector of the modern world., 2018, 97: 1521–1537.
[16] KOTARO MATSUMOTO, TAN LE HOANG DOAN, NGOC XUAN DAT MAI,Anticancer drug delivery capability of biodegradable PMO in the chicken egg tumor model., 2018, 44: 103–116.
[17] AGRAWAL GARIMA, AGRAWAL RAHUL. Janus nanoparticles: recent advances in their interfacial and biomedical applications., 2019, 2(4): 1738–1757.
[18] MA BAO-YUAN, TIAN ZHENG-FANG, ZHU YU- FANG. Biodegradable silicon-based mesoporous nanoparticles for nanomedicine., 2018, 10(6): e159.
[19] TANG WEI, FAN WEN-PEI, WANG ZHAN-TONG. Acidity/ reducibility dual-responsive hollow mesoporous organosilica nanoplatforms for tumor-specific self-assembly and synergistic therapy., 2018, 12(12): 12269–12283.
[20] HUANG PING, CHEN YU, HAN LIN,Molecularly organic/ inorganic hybrid hollow mesop-orous organosilica nanocapsules with tumor-specific biodegradability and enhanced chemotherapeutic functionality., 2017, 125: 23–37.
[21] YU LUO-DAN, CHEN YU, LIN HAN,Ultra-small mesoporous organosilica nanoparticles: morphology modulations and redox-responsive bio-degradability for tumor-specific drug delivery., 2018, 161: 292–305.
[22] JONAS G CROISSANT, YEVHEN FATIEIEV, ABDULAZIZ ALMALIK,Mesoporous silica and organosilica nanoparticles: physical chemistry, biosafety, delivery strategies, and biomedical applications., 2018, 7(4): 1700831–1–75.
[23] FENTON OWEN S, OLAFSON KATY N, PILLAI PADMINI S,Advances in biomaterials for drug delivery., 2018, 30(29): 1705328–1–29.
[24] XU YI, ZHU YU-FANG, KASKEL STEFAN. A smart magnetic nanosystem with controllable drug release and hyperthermia for potential cancer therapy., 2015, 5(121): 99875–99883.
[25] HUANG PING, QIAN XIAO-QIN, CHEN YU,Metalloporphyrin-encapsulated biodegradable nano-systems for highly efficient magnetic resonance imaging-guided sonodynamic cancer therapy., 2017, 139(3): 1275–1284.
[26] TAO CUI-LIAN, ZHU YU-FANG, XU YI, ZHU MIN,. Mesoporous silica nanoparticles for enhancing the delivery efficiency of immuno-stimulatory DNA drugs., 2014, 43(13): 5142–1–50.
[27] LAI XIN, SUN DAN, HOU YI,Amino- functionalized multilayer core-shell mesoporous organo-silica nanospheres for Cr(VI) removal., 2018, 5(18),180 0630–1–11.
[28] HU LIN-LIN, MENG JIE, ZHANG DAN-DAN,Functionalization of mesoporous organosilica nano-carrier for pH/glutathione dual-responsive drug delivery and imaging of cancer therapy process., 2018, 177: 203–211.
[29] DOUSTKHAH ESMAIL, MOHTASHAM HAMED, FARAJZADEH MUSTAFA,. Organosiloxane tunability in mesoporous organosilica and punctuated Pd nanoparticles growth; theory and experiment., 2020, 293: 109832–1–8.
Preparation of Mesoporous Organosilica-based Nanosystem forSynergistic Chemo- and Photothermal Therapy
ZENG Yulin1,2, CHEN Jiajie1,3, TIAN Zhengfang2, ZHU Min1, ZHU Yufang2,3
(1. School of Materials Science and Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Hubei Key Laboratory of Processing and Application of Catalytic Materials, College of Chemical Engineering, Huanggang Normal University, Huanggang 438000, China; 3. Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China)
Organic-inorganic hybrid mesoporous organosilica has gained more attention in biomedicine due to its high surface area, mesoporous channels, functional framework, and high drug loading capacity. In this study, disulfide- bridged hybrid mesoporous organosilica nanoparticles (MONs) as nanocarriers were employed to construct a nanosystem (ICG/DOX-MONs@DNA20) for delivering drugs and photothermal agents, in which DNA molecules as “switches” were modified on the surface of MONs to control drug release.The results showed that the ICG/DOX-MONs@DNA20nanosystem could increase the temperature to above 43 ℃ for photothermal therapy with near-infrared (NIR) laser irradiation. On the other hand, the ICG/DOX-MONs@DNA20nanosystem exhibited a very slow release of DOX (12.3% in 6 h) at 37 ℃, but a rapid release of DOX (52.4% in 6 h) occurred at 43 ℃. Cell culture experiments indicated that the nanosystem can be internalized by HeLa cells, and exhibited an enhanced therapeutic efficacy of synergistic chemo- and photothermal therapy. Hence, the ICG/DOX-MONs@DNA20nanosystem might be promising for synergistic chemo- and photo-thermal tumor therapy.
mesoporous organosilica; nanocarriers; controlled release; synergistic therapy
TQ174
A
1000-324X(2020)12-1365-08
10.15541/jim20200091
2020-02-24;
2020-03-10
国家自然科学基金面上项目(51572172); 上海理工大学科技发展项目(2018KJFZ016, 2019KJFZ023)
National Natural Science Foundation of China (51572172); University of Shanghai for Science and Technology (2018KJFZ016, 2019KJFZ023)
曾雨淋(1995–), 女, 硕士研究生. E-mail: 1591422585@qq.com
ZENG Yulin (1995–), female, Master candidate. E-mail: 1591422585@qq.com
朱敏, 副教授. E-mail: mzhu@usst.edu.cn; 朱钰方, 教授. E-mail: zjf2412@163.com
ZHU Min, associate professor. E-mail: mzhu@usst.edu.cn; ZHU Yufang, professor. E-mail: zjf2412@163.com
