黄野螟化学感受基因的鉴定与分析
2021-01-04李资聪刘磊杨斌严善春王桂荣
李资聪 刘磊 杨斌 严善春 王桂荣



摘要 :昆虫的化学感受系统在昆虫的取食、交配等多种行为中发挥着重要作用。黄野螟Heortia vitessoides是一种寡食性害虫,幼虫具有聚集性、暴食性等特点,对土沉香Aquilaria sinensis危害严重。本研究使用高通量测序技术对黄野螟成虫触角和口器的转录组进行了测序,共鉴定到124个化学感受基因,包括50个气味受体(odorant receptor,OR)基因,19个离子型受体(ionotropic receptor,IR)基因,17個味觉受体(gustatory receptor,GR)基因,19个气味结合蛋白(odorant binding protein,OBP)基因,17个化学感受蛋白(chemosensory protein,CSP)基因和2个感觉神经元膜蛋白(sensory neuron membrane protein,SNMP)基因。通过系统进化和差异表达分析,对黄野螟化学感受基因的分化,以及不同性别、不同组织间的表达差异进行系统性的研究。以气味受体为例,HvitOR42、HvitOR43和HvitOR48聚在传统的性信息素受体(pheromone receptor,PR)分支,其中HvitOR42和HvitOR43在雄性成虫触角中特异性高表达,这3个气味受体可能参与识别黄野螟雌性成虫释放的性信息素。此外,HvitOR20在雌性成虫触角中特异性高表达,可能与雌性成虫交配和产卵等行为相关。本研究为进一步探究黄野螟的化学感受机制提供了分子基础,为开发以化学生态学为基础的黄野螟绿色害虫防控技术提供了理论依据。
关键词 :黄野螟; 转录组; 高通量测序; 化学感受基因
中图分类号:
S 433.4
文献标识码: A
DOI: 10.16688/j.zwbh.2021151
Identification and analysis of chemosensory genes in Heortia vitessoides
LI Zicong1, LIU Lei1, YANG Bin2*, YAN Shanchun1*, WANG Guirong2
(1.College of Forestry, Northeast Forestry University, Harbin 150040, China; 2.State Key
Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
Insect chemosensory system plays an important role in various behaviors such as feeding and mating.The yellow stem borer Heortia vitessoides is a kind of oligophagous pests against Aquilaria sinensis, causing serious damages by larval aggregation and overeating.In this study, high-throughput sequencing technology was used to obtain the transcriptomes in the antennae and mouthparts of H.vitessoides adults.As a result, 124 chemosensory genes were identified, including 50 odorant receptor (OR) genes, 19 ionotropic receptor (IR) genes, 17 gustatory receptor (GR) genes, 19 odorant binding protein (OBP) genes, 17 chemosensory protein (CSP) genes and two sensory neuron membrane protein (SNMP) genes.Phylogenetic and differential expression analyses were carried out to systematically study the gene differentiation and tissue specific expression of these chemosensory genes in H.vitessoides.Taking the odorant receptors as an example, HvitOR42, HvitOR43 and HvitOR48 clustered in the clade of traditional sex pheromone receptor, among which HvitOR42 and HvitOR43 were highly expressed in the male adult antennae, which were considered important in the recognition of sex pheromones produced by the females.In addition, HvitOR20 was highly expressed in the female antennae, which was considered to be involved in the female specific behaviors such as mating and oviposition.This study provided a molecular basis for further study of the chemosensory mechanism in H.vitessoides, and helps develop new methods for controlling H.vitessoides.
Key words
Heortia vitessoides; transcriptome; high-throughput sequencing; chemosensory genes
昆虫包括嗅觉和味觉在内的化学感受系统能识别环境中的各种化学物质,影响昆虫的取食、求偶、交配和躲避天敌等多种行为[12]。昆虫的外周化学感受神经元是识别外部环境化学物质的主要神经通路,包含嗅觉感受神经元(olfactory receptor neuron,ORNs)和味覺感受神经元(gustatory receptor neuron,GRN)[3]。嗅觉感受神经元主要分布于昆虫的触角,而味觉感受神经元主要分布于喙。除此之外,化学感受神经元也在下唇须、下颚须、足和翅等多个组织中分布[4]。在分子层面上,化学感受的过程主要由几个功能上相互关联的不同基因家族所介导,包括气味受体(odorant receptor,OR)、离子型受体(ionotropic receptors,IR)、味觉受体(gustatory receptor,GR)等3个受体蛋白家族和气味结合蛋白(odorant binding protein,OBP)、化学感受蛋白(chemosensory protein,CSP)、感觉神经元膜蛋白(sensory neuron membrane protein,SNMP)[510]等3个非受体蛋白家族。这些基因家族在昆虫化学感受过程中起到了至关重要的作用,可作为未来害虫防治的潜在靶标。
黄野螟Heortia vitessoides属鳞翅目Lepidoptera螟蛾科Pyralidae,是典型的寡食性食叶害虫,主要分布于我国热带和南亚热带气候区,其高度适生区集中在珠江流域和澜沧江流域南部,未来适生区有向北扩展的趋势[11]。该虫仅取食沉香属Aquilaria和漆树属Toxicodendron等的少数几种植物,是我国土沉香Aquilaria sinensis的主要害虫[12]。土沉香是瑞香科Thymelaeceae沉香属Aquilaria常绿乔木,为我国沉香的主要植物来源[13]。沉香是生产中药、熏香和香水的重要原料,其在国际市场上价格堪比黄金。野生土沉香已被中华人民共和国农业农村部和国家林业和草原局列为国家濒危三级保护植物、国家二级重点野生保护植物[14]。因具有较高的经济价值,土沉香人工种植面积不断扩大,病虫害问题日益凸显。黄野螟是我国土沉香种植区的重点防治对象,具有聚集性、暴食性等特点,幼虫数日内可将植株叶片取食一空,严重时可导致种植区内90%以上植株大面积受损,严重影响土沉香的生长[15]。目前,针对黄野螟的防治方法主要是化学防治[16],但化学防治专一性差,对非靶标生物尤其是天敌资源危害较大。此外,化学农药的不合理使用会影响沉香的药用及食用价值,导致一系列的食品安全问题。利用昆虫性信息素防治害虫,具有专一性强、对环境无污染等优点,是绿色无公害的新型害虫防控方法。然而,针对黄野螟性信息素及其识别机制的研究较少,识别性信息素的化学感受基因也未知,亟需深入研究。
本研究使用Illumina HiSeqTM 2000高通量测序平台对黄野螟雌、雄成虫的触角和口器进行了转录组测序,鉴定了黄野螟OR、IR、GR、OBP、CSP和SNMP 6个基因家族的化学感受基因,并通过系统进化和差异表达基因(differential expression gene,DEG)分析,对黄野螟化学感受基因的分化,以及不同性别、不同组织间的表达差异情况进行系统性研究。本研究旨在为开发黄野螟的新型防治策略奠定理论基础,为从分子层面上以受体基因为靶标筛选和设计新型高效的引诱剂和交配干扰剂提供理论依据。
1 材料与方法
1.1 供试昆虫
黄野螟幼虫采自广东省广州市天河区火炉山森林公园(113°38′E,23°19′N),带回实验室后在温度(26±1)℃、湿度(65±5)%、光周期L∥D=15 h∥9 h的人工气候箱中使用新鲜的土沉香叶片饲养。幼虫化蛹后,根据第8和第9腹节的形态差异,将雌、雄虫分别置于不同养虫笼,成虫羽化后饲喂10%蜂蜜水。选取3日龄未交配的雌、雄成虫各120头进行触角和口器(喙、下颚须和下唇须)等组织的收集,取下的组织置于-80℃保存备用。
1.2 总RNA提取和文库构建与测序
采用TRIzol法分别提取黄野螟雌、雄成虫触角和口器的RNA。使用2%琼脂糖凝胶电泳检测RNA质量。使用NanoDrop ND-2000(Thermo Scientific,USA)检测RNA的浓度和纯度,使用Agilent 2100 (Agilent Technologies,USA)检测RNA的完整性。取检测合格的RNA样品各1.5 μg,按照NEBNext Ultra RNA Library Prep Kit for Illumina(NEB,USA)的操作方法进行文库构建,并使用Agilent Bioanalyzer 2100系统对文库质量进行检查,检查合格后使用Illumina HiSeqTM 2000测序平台进行测序。
1.3 转录组测序数据的组装与注释
测序得到的原始数据通过删除接头序列、含有较高比率未知碱基的序列、长度过短的序列,最终得到clean reads。使用Trinity软件对clean reads进行组装。将组装获得的unigene分别与非冗余蛋白数据库(non-redundant protein sequence database,NR)、蛋白家族(protein family,PFAM)、SwissProt蛋白序列数据库(a manually annotated, non-redundant protein sequence database)、基因本体论(gene ontology database,GO)、直系同源基因簇(clusters of orthologous groups of proteins,KOG/COG)、直系同源蛋白分组比对(evolutionary genealogy of genes:non-supervised orthologous groups,EggNOG)和京都基因与基因组百科(Kyoto Encyclopedia of Genes and Genomes,KEGG)等7个数据库进行比对,获得相应的注释信息。
1.4 黄野螟化学感受相关基因的鉴定及基因表达量分析
黄野螟化学感受基因的鉴定有两种方法。第一,从NR、PFAM、SwissProt、GO、COG、KOG、EggNOG、KEGG数据库注释的结果中提取比对到的黄野螟化学感受基因序列。第二,从SilkDB 3.0(https:∥silkdb.bioinfotoolkits.net/)数据库中下载家蚕Bombyx mori的化学感受基因,使用本地BLAST(BLASTx、BLASTn、tBLASTn)查找这些基因在黄野螟中的同源序列(E value<1×10-2)。将上述得到的序列合并,使用NCBI在线数据库再次验证,删除错误匹配或匹配度较低的序列,最终获得每个基因家族的候选基因。使用ExPASy(expert protein analysis system)服务器(http:∥web.expasy.org/translate/)预测所有候选基因的ORF,并分别与其他物种的同源基因比对确认序列是否为全长。使用TMHMM 2.0预测候选基因的跨膜结构域(transmembrane domain,TMD)。计算所有候选基因的FPKM(fragments per kilobase of transcript per million mapped reads)值,比较候选基因在黄野螟成虫不同组织中的表达情况[17]。
1.5 系统进化分析
从GenBank数据库(https:∥www.ncbi.nlm.nih.gov/genbank/)中下载不同物种的化学感受基因用来构建系统进化树,包括家蚕、棉铃虫Helicoverpa armigera、亚洲玉米螟Ostrinia furnacalis、稻纵卷叶螟Cnaphalocrocis medinalis、桃蛀螟Conogethes punctiferalis、烟青虫Helicoverpa assulta和黑腹果蝇Drosophila melanogaster。通过MAFFT(https:∥www.ebi.ac.uk/Tools/msa/mafft/)进行氨基酸序列比对。使用RAxML 8.0通过最大似然法进行系统进化树的构建。系统进化树使用Jones-Taylor-Thornton氨基酸替代模型(JTT),快速hill-climbing算法(-fd),进行1 000次bootstrap统计学检测,对最佳的树拓扑结构在似然值对数上设置模型最佳的精确度(-e),使用默认值0.01。最终选取最优结果并使用Fig Tree v 1.4.0软件进行进化树的编辑。
2 结果与分析
2.1 黄野螟触角、口器转录组的组装和注释
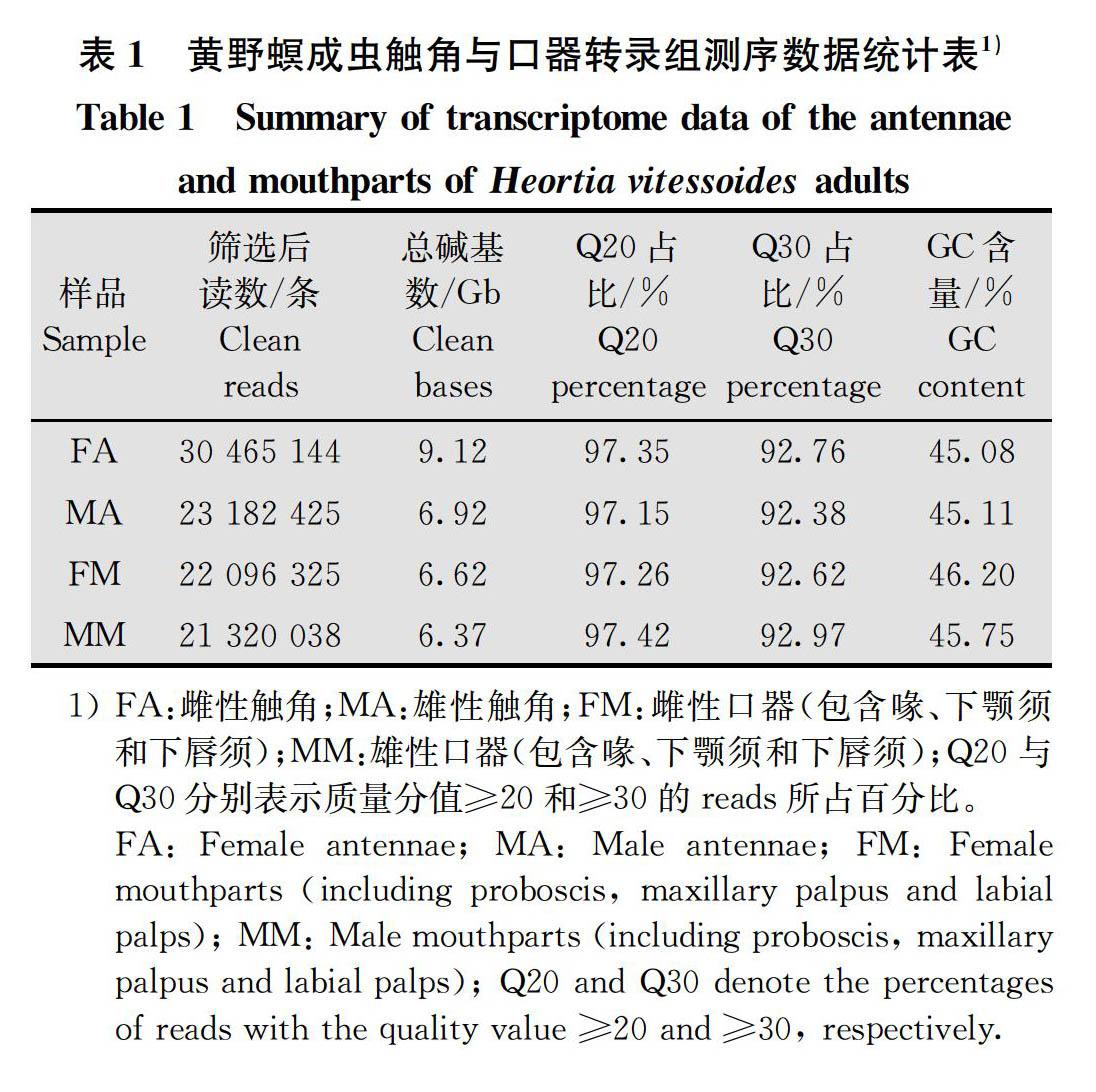
利用Illumina HiSeqTM 2000平台对黄野螟雌、雄成虫触角和口器共4个样品进行转录组测序,最终得到29.03 Gb,包含97 063 932条clean reads的转录组数据。各个样品总碱基数均达到6.37 Gb以上,测序质量分值为Q20和Q30时,质量合格的reads比例分别高于97.15%和92.38%,GC含量在45.08%~46.20%(表1)。将4个样品的测序结果合并进行组装,共获得109 943条转录本和43 058条unigenes,N50长度分别为3 372 bp和2 086 bp,平均长度分别为1 936.34 bp和1 168.64 bp,具体结果见表2。使用不同的数据库对unigene进行了注释,获得了4 360~15 044条注释结果,其中NR数据库注释到的unigene数量最多,占总基因数量的34.94%(表3)。
2.2 气味受体家族基因的鉴定及分析
通过转录组测序总共鉴定到50个OR基因,命名为HvitOR1~HvitOR50,GenBank登录号为MW717297~MW717346(表4)。其中,获得全长序列的OR基因有31个,氨基酸序列长度为370~474 aa,跨膜结构域(transmembrane domain, TMD)的数量为4~7个。系统进化分析表明(图1),黄野螟的气味受体在进化树各个分支中均有分布。其中,HvitOR2为气味受体共受体(olfactory receptor co-receptor,ORco),HvitOR42、HvitOR43、HvitOR48为性信息素受体(pheromone receptor,PR)。DEG結果表明,性信息素受体HvitOR42和HvitOR43在雄性触角中均为高表达(表达量大于雌性10倍以上),但HvitOR48在雌、雄触角中的表达量差异不大。此外,HvitOR20在雌性触角中高表达(表达量大于雄性10倍以上)。HvitOR2、HvitOR8、HvitoR14、HvitOR15、HvitOR18、HvitOR19、HvitOR22、HvitOR26、HvitOR28、HvitOR30、HvitOR32、HvitOR33、HvitOR40、HvitOR41、HvitOR45和HvitOR46在雄性口器中高表达(表达量大于雌性10倍以上)(表4)。
2.3 离子型受体家族基因的鉴定及分析
本研究共鉴定到19个IR基因,GenBank 登录号为MW717347~MW717364,其中HvitIR25a由于序列长度过短未上传(表5)。有7个IR基因获得了全长序列,氨基酸序列长度在548 aa(HvitIR76b)到912 aa(HvitIR8a)之间,TMD结构数量为3~4个。系统进化分析结果表明,黄野螟的19个IR分别聚在4个IR分支上(图2)。DEG结果表明,触角中HvitIR8a和HvitIR25a的表达量高于其他IR。此外,HvitIR2、HvitIR8a、HvitIR21a、HvitIR75p1、HvitIR87a和HvitIR93a均在雄性口器中高表达(表达量大于雌性10倍以上)(表5)。值得注意的是,黄野螟的HvitIR41a出现了特异性序列分化,且HvitIR41a.2的表达量高于HvitIR41a.1。
2.4 味觉受体家族基因的鉴定及分析
通过对黄野螟触角与口器的转录组进行分析,鉴定到了17个GR,将其命名为HvitGR1~HvitGR17,GenBank登录号为MW717365~MW717381(表6)。然而,只有1个GR(HvitGR3)获得了全长,氨基酸长度为476 aa。系统进化分析表明(图3),HvitGR1、HvitGR2、HvitGR3与家蚕、棉铃虫和烟青虫的二氧化碳受体聚为一支。HvitGR4~HvitGR8聚在糖受体分支,HvitGR9~HvitGR12聚在果糖受体分支, HvitGR13~HvitGR16聚在苦味受体分支。DEG结果表明,GR的表达量普遍较低,其中果糖受体HvitGR10在触角中表达含量最高,而二氧化碳受体HvitGR1~HvitGR3在口器中的表达量较高(表6)。
2.5 气味结合蛋白家族基因的鉴定及系统进化分析
本研究共鉴定到19个OBP,包括2个普通气味结合蛋白(general odorant binding protein,GOBP)和2个性信息素结合蛋白(pheromone binding protein,PBP),分别命名为HvitGOBP1、HvitGOBP2、HvitPBP1和HvitPBP2,其他序列命名为HvitOBP1~HvitOBP4和HvitOBP6~HvitOBP16(未鉴定到HvitOBP5),GenBank 登录号为MW717382~MW717400(表7)。其中,有14个OBP基因获得了全长,氨基酸序列长度在138~337 aa之间。根据氨基酸序列结构和进化分析(图4),HvitGOBP1、HvitGOBP2、HvitPBP1、HvitPBP2、HvitOBP2、HvitOBP9~HvitOBP11、HvitOBP13~HvitOBP15属于Classic亚家族;HvitOBP4、HvitOBP6和HvitOBP12属于Minus-C亚家族;HvitOBP1、HvitOBP3、HvitOBP7、HvitOBP8和HvitOBP16属于Plus-C亚家族。DEG结果表明,HvitGOBP2、HvitPBP1、HvitPBP2、HvitOBP2、HvitOBP10、HvitOBP11、HvitOBP13和HvitOBP15均在雄虫口器中高表达,并且表达量为雌虫口器的10倍以上(表7)。
2.6 化学感受蛋白家族基因的鉴定及系统进化分析
本研究共鉴定到17个CSP,命名为HvitCSP1~HvitCSP4和HvitCSP7~HvitCSP19(未鉴定到HvitCSP5和HvitCSP6),GenBank 登录号为MW717401~MW717416,其中HvitCSP9由于序列长度过短,未上传(表8)。共有10个CSP为全长基因序列,且均具有4个保守的半胱氨酸结构,氨基酸序列长度在109~154 aa。系统进化分析表明(图5),所有候选CSP基因都与至少一个鳞翅目同源基因聚在一支上。DEG结果表明,HvitCSP2在雌雄触角和口器中表达量最高,HvitCSP17和HvitCSP19在雌性触角中偏好表达(表达量大于雄性3倍以上)。此外,HvitCSP8、HvitCSP15和HvitCSP17在雄性口器偏好表达(表达量大于雌性3倍以上)(表8)。
2.7 感觉神经元膜蛋白家族基因的鉴定及系统进化分析
通过对黄野螟触角与口器转录组的分析,共鉴定到2个具有全长基因序列的SNMP,命名为HvitSNMP1和HvitSNMP2,氨基酸长度分别为527 aa和524 aa,GenBank 登录号为MW717417和MW717418(表9)。系统进化分析表明(图6),HvitSNMP1和HvitSNMP2与其他鳞翅目物种的SNMP基因处在不同的分支。DEG结果表明,HvitSNMP1在雄性口器中高表达(表达量大于雌性10倍以上)(表9)。
3 讨论
以性诱剂为主的新型害虫绿色防控技术具有安全、高效和环保等优点,其在林业害虫的防控中发挥了重要作用。研究害虫的化学感受基因,有利于深入了解害虫的嗅觉系统,进而开发更高效的害虫嗅觉行为调控剂。高通量测序技术的发展,极大地促进了害虫化学生态学研究[19]。本研究采用Illumina HiSeqTM 2000高通量测序平台对黄野螟成虫触角与口器中表达的化学感受基因进行了全面的鉴定与分析,共鉴定到124个化学感受基因,包括50个OR、19个IR、17个GR、19个OBP、17个CSP和2个SNMP。相对于之前的研究[18],本研究新鉴定到22个OR、7个IR、13个GR、11个OBP和9个CSP,未鉴定到HvitOBP5、HvitCSP5和HvitCSP6,但是鉴定到的基因数量和质量均优于之前的研究。本研究为进一步研究黄野螟的化学感受机制提供了分子基础,为开发以化学生态学为基础的黄野螟绿色害虫防控技术提供了理论依据。
昆虫OR是一种跨膜受体蛋白,具有7个跨膜结构域。传统气味受体(conventional odorant receptor,OrX)是一个高度分化的受体家族,需要与高度保守的气味受体共受体结合形成异源多聚体,共同完成识别气味分子的功能[5]。本研究在黄野螟中鉴定到50个OR,数量与其他鳞翅目近缘昆虫接近[20]。然而,在黄野螟的50个OR中仅鉴定到3个性信息素受体(PR),数量低于其他鳞翅目近缘物种,例如,亚洲玉米螟和桃蛀螟中均鉴定到8个PR,小菜蛾Plutella xylostella中鑒定到9个PR[2123]。在黄野螟的3个PR中,仅HvitOR42和HvitOR43在雄性触角中高表达,可能与识别雌性性信息素相关。此外,在海灰翅夜蛾Spodoptera littoralis的研究中发现,SlitOR5可以特异性识别性信息素组分(Z,E)-9,11-14∶OAc,该受体所在的分支为“新PR”分支[24]。在本研究中,虽然HvitOR8、HvitOR30、HvitOR31、HvitOR32、HvitOR38、HvitOR44聚在“新PR”分支上,但是它们并未在雄虫触角中高表达。值得注意的是,HvitOR20在雌性触角中高表达,说明其可能在雌虫产卵相关行为中发挥作用。
IR由離子型谷氨酸受体超家族(iGluRs)进化而来,主要在触角中表达,用于识别酸、胺以及温、湿度等[25]。在本研究中,我们共鉴定到19个IR,进化分析结果表明,黄野螟IR聚在4个不同分支,可能具有不同的潜在功能。在第一分支中,HvitIR8a和HvitIR25a在不同物种间相对保守,有研究表明这两种IR发挥了共受体的功能[26]。在第二分支中,HvitIR76b与HvitIR93a聚为同一分支,其中IR76b被认为可能是第二类共受体[2627]。第三分支中的IR主要与昆虫非化学感受相关,如果蝇的IR40a和IR68a参与了昆虫的湿度感受[28]。第四分支中的IR主要参与酸类化合物识别,果蝇的IR64a和IR75a与IR8a共表达可分别被乙酸和苯乙酸激活[26, 28]。值得注意的是,在第二分支中,HvitIR41a与其他物种相比发生了特异性序列分化,可能与黄野螟的特异性行为相关,但具体功能还有待进一步研究。在果蝇IR的研究中,IR41a与IR76b共表达用于识别多胺类物质,这类物质对果蝇有吸引作用[29]。
根据系统进化关系和功能研究,GR可分为4个分支:二氧化碳受体分支、糖受体分支、果糖受体分支和苦味受体分支[3032]。在果蝇和家蚕基因组中分别鉴定到56个和65个GR[3233]。在黄野螟中,我们仅鉴定出17个GR,与桃蛀螟[22]和草地螟Loxostege sticticalis[34]的GR数量相似,但数量少于果蝇和家蚕,表明GR可能存在于除成虫触角和口器之外的其他组织中。进化分析结果显示,HvitGR1~HvitGR3为CO2受体,HvitGR4~HvitGR8为糖受体,HvitGR9~HvitGR12为果糖受体,HvitGR13-HvitGR17为苦味受体。目前关于GR功能研究多集中在CO2受体、糖受体和果糖受体,而关于苦味受体的功能研究报道相对较少。在家蚕中,BmorGR66基因突变可导致家蚕丧失对桑叶的专食性[35]。在小菜蛾中,PxylGR34基因的表达介导了小菜蛾对油菜素内酯的厌恶行为反应[36]。这些研究对了解黄野螟寡食性的分子机制具有指导意义。
OBP和CSP是一类具有典型分子特征的水溶性小分子蛋白,在多个组织中均有表达且表达量较高,主要参与气味分子的运输。典型的OBP和CSP序列分别具有6个和4个保守的半胱氨酸,通过相互交叉形成二硫键影响OBP和CSP的三维结构。OBP和CSP的特异性表达一定程度上暗示了它们在昆虫生命活动中的作用。除了在触角和口器中表达以外,OBP和CSP也在生殖器和足等多种组织中表达[37]。此外,OBP和CSP也具有性别特异性高表达,这可能与雌虫或雄虫的特异性生理和行为有关。在本文中,HvitGOBP2、HvitPBP1和HvitPBP2等8个OBP在口器中均为雄性高表达(表达量大于雌性10倍以上),HvitCSP8、HvitCSP15和HvitCSP17在雄性口器中偏好表达(表达量大于雌性3倍以上),可能与性信息素的识别相关。
SNMP是一种膜蛋白,且数量较少,在大多数鳞翅目昆虫都只有2个。SNMP1主要分布在触角中,与性信息素特异性神经元有关,并参与昆虫对性信息素的识别过程[38]。SNMP2在昆虫中的功能尚不明确,具体功能有待进一步的研究。此外,最近通过基因组及转录组数据分析,在鳞翅目昆虫中鉴定出SNMP3基因,它在幼虫中肠特异性表达,具体功能尚未明确[39]。
参考文献
[1] HANSSON B, STENSMYR M C. Evolution of insect olfaction [J]. Neuron, 2011, 72(5): 698711.
[2] SATO K, TOUHARA K. Insect olfaction: receptors, signal transduction, and behavior [J]. Results and Problems in Cell Differentiation, 2009, 47: 121138.
[3] HANSSON B S. A bug’s smell-research into insect olfaction [J]. Trends in Neurosciences, 2002, 25(5): 270274.
[4] DERBY C D, KOZMA M T, SENATORE A, et al. Molecular mechanisms of reception and perireception in crustacean chemoreception: a comparative review [J]. Chemical Senses, 2016, 41(5): 381398.
[5] LEAL W S. Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes [J]. Annual Review of Entomology, 2013, 58(1): 373391.
[6] VOGT R G, MILLER N E, LITVACK R, et al. The insect SNMP gene family [J]. Insect Biochemistry and Molecular Biology, 2009, 39(7): 448456.
[7] BENTON R, VANNICE K S, VOSSHALL L B. An essential role for a CD36-related receptor in pheromone detection in Drosophila [J]. Nature, 2007, 450(7167): 289293.
[8] PELOSI P, IOVINELLA I, FELICIOLI A, et al. Soluble proteins of chemical communication: an overview across arthropods [J/OL]. Frontiers in Physiology, 2014, 5: 320. DOI: 10.3389/fphys.2014.00320.
[9] PELOSI P, ZHOU J J, BAN L P, et al. Soluble proteins in insect chemical communication [J]. Cellular and Molecular Life Sciences, 2006, 63(14): 16581676.
[10]BENTON R, VANNICE K S, GOMEZ-DIAZ C, et al. Variant ionotropic glutamate receptors as chemosensory receptors in Drosophila [J]. Cell, 2009, 136(1): 149162.
[11]XU Danping, LI Xinyang, JIN Yawen, et al. Influence of climatic factors on the potential distribution of pest Heortia vitessoides Moore in China [J/OL]. Global Ecology and Conservation, 2020, 23: e01107. DOI:10.1016/j.gecco.2020.e01107.
[12]蘇跃平. 白木香黄野螟生物学特性[J]. 中药材, 1994(12):79.
[13]LIU Yangyang, CHEN Huaiqiong, YANG Yun, et al.Whole-tree agarwood-inducing technique: an efficient novel technique for producing high-quality agarwood in cultivated Aquilaria sinensis trees [J]. Molecules, 2013, 18(3): 30863106.
[14]于永福. 中国野生植物保护工作的里程碑——《国家重点保护野生植物名录(第一批)》出台[J]. 植物杂志, 1999(5):3.
[15]乔海莉, 陆鹏飞, 陈君, 等. 黄野螟生物学特性及发生规律研究[J]. 应用昆虫学报, 2013,50(5): 12441252.
[16]邱琼,杨德军,刘际梅,等. 5种药剂对黄野螟幼虫的林间防治试验[J]. 四川林业科技, 2019, 40(1): 5960.
[17]DEWEY C N, LI Bo. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome [J/OL]. BMC Bioinformatics, 2011, 12(1): 323. DOI: 10.1186/1471-2105-12-323.
[18]CHENG Jie, WANG Chunyan, LYU Zihao, et al. Candidate olfactory genes identified in Heortia vitessoides (Lepidoptera: Crambidae) by antennal transcriptome analysis [J]. Comparative Biochemistry and Physiology, Part D: Genomics and Proteomics, 2019, 29: 117130.
[19]WALKER W B, ROY A, ANDERSON P, et al. Transcriptome analysis of gene families involved in chemosensory function in Spodoptera littoralis (Lepidoptera: Noctuidae) [J/OL]. BMC Genomics, 2019, 20: 428. DOI: 10.1186/s12864-019-5815-x.
[20]SATO K, PELLEGRINO M, NAKAGAWA T, et al. Insect olfactory receptors are heteromeric ligand-gated ion channels [J]. Nature, 2008, 452(7190): 10021006.
[21]YANG Bin, OZAKI K, ISHIKAWA Y, et al. Identification of candidate odorant receptors in asian corn borer Ostrinia furnacalis [J/OL]. PLoS ONE, 2015, 10(3): e121261. DOI: 10.1371/journal.pone.0121261.
[22]GE Xing, ZHANG Tiantao, WANG Zhenying, et al. Identification of putative chemosensory receptor genes from yellow peach moth Conogethes punctiferalis (Guenée) antennae transcriptome [J/OL]. Scientific Reports, 2016, 6(1): 32636. DOI: 10.1038/srep32636.
[23]YANG Shiyong, CAO Depan, WANG Guirong, et al. Identification of genes involved in chemoreception in Plutella xylostella by antennal transcriptome analysis [J/OL]. Scientific Reports, 2017, 7(1): 11941. DOI: 10.1038/s41598-017-11646-7.
[24]BASTIN-HLINE L, FOUCHIER A D, CAO Song, et al. A novel lineage of candidate pheromone receptors for sex communication in moths [J/OL]. eLife, 2019, 8: e49826. DOI: 10.7554/eLife.49826.
[25]DIETER W, FABIO M. Functional properties of insect olfactory receptors: ionotropic receptors and odorant receptors [J]. Cell and Tissue Research, 2021, 383(1):719.
[26]LILIANE A, BENOTE B, MAXIMILIAN H U, et al. Functional architecture of olfactory ionotropic glutamate receptors [J]. Neuron, 2010, 69(1): 4460.
[27]RIMAL S, LEE Y. The multidimensional ionotropic receptors of Drosophila melanogaster [J]. Insect Molecular Biology, 2018, 27(1): 17.
[28]AI Minrong, MIN S, GROSJEAN Y, et al. Acid sensing by the Drosophila olfactory system [J]. Nature, 2010, 468(7324): 691695.
[29]HUSSAIN A, ZHANG Mo, PUNAR H K, et al. Ionotropic chemosensory receptors mediate the taste and smell of polyamines [J/OL]. PLoS Biology, 2016, 14(5): e1002454. DOI: 10.1371/journal.pbio.1002454
[30]ROBERTSON H M, KENT L B. Evolution of the gene lineage encoding the carbon dioxide receptor in insects [J/OL]. Journal of Insect Science, 2009, 9(1): 19. DOI:10.1673/031.009.1901
[31]SATO K, TANAKA K, TOUHARA K. Sugar-regulated cation channel formed by an insect gustatory receptor [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(28): 1168011685.
[32]WANNER K W, ROBERTSON H M. The gustatory receptor family in the silkworm moth Bombyx mori is characterized by a large expansion of a single lineage of putative bitter receptors [J]. Insect Molecular Biology, 2010, 17(6): 621629.
[33]SCOTT K, BRADY R, CRAVCHIK A, et al. A chemosensory gene family encoding candidate gustatory and olfactory receptors in Drosophila [J]. Cell, 2001, 104(5): 661673.
[34]WEI Hongshuang, LI Kebin, ZHANG Shuai, et al. Identification of candidate chemosensory genes by transcriptome analysis in Loxostege sticticalis Linnaeus [J/OL]. PLoS ONE, 2017, 12(4): e174036. DOI: 10.1371/journal.pone.0174036.
[35]ZHANG Zhongjie, ZHANG Shuaishuai, NIU Baolong, et al. A determining factor for insect feeding preference in the silkworm, Bombyx mori [J/OL]. PLoS Biology, 2019, 17(2): e3000162. DOI: 10.1371/journal.pbio.3000162.
[36]YANG Ke, GONG Xinlin, LI Guocheng, et al. A gustatory receptor tuned to the steroid plant hormone brassinolide in Plutella xylostella (Lepidoptera: Plutellidae) [J]. eLife, 2020, 9: e64114. DOI: 10.7554/eLife.64114.
[37]ANGELI S, CERON F, SCALONI A, et al. Purification, structural characterization, cloning and immunocytochemical localization of chemoreception proteins from Schistocerca gregaria [J]. European Journal of Biochemistry, 1999, 262(3): 745754.
[38]BLANKENBURG S, CASSAU S, KRIEGER J, et al. The expression patterns of SNMP1 and SNMP2 underline distinct functions of two CD36-related proteins in the olfactory system of the tobacco budworm Heliothis virescens [J]. Cell and Tissue Research, 2019, 378(3): 485497.
[39]ZHANG Huijie, XU Wei, CHEN Quanmei, et al. A phylogenomics approach to characterizing sensory neuron membrane proteins (SNMPs) in Lepidoptera [J/OL]. Insect Biochemistry and Molecular Biology, 2020, 118: 103313. DOI: 10.1016/j.ibmb.2020.103313.
(責任编辑:杨明丽)
