江西省番茄绵疫病菌的交配型及对甲霜灵敏感性测定
2021-01-04何烈干邹芬周云峰李湘民黄瑞荣马辉刚
何烈干 邹芬 周云峰 李湘民 黄瑞荣 马辉刚



摘要 :为明确江西番茄绵疫病菌的类别和抗药性水平,采用单孢菌落直接配对法和菌落生长量法,测定2018年-2019年江西番茄主产区绵疫病菌的交配型及其对甲霜灵的敏感性。结果表明,江西番茄绵疫病菌存在A 2和A 0交配型,发生频率分别为86.2%和13.8%,未检测到其他交配型,且A 2交配型在各个产区均有分布。58株番茄绵疫病菌株对甲霜灵的EC 50范围为0.602 9~3.313 3 μg/mL,平均EC 50为1.372 7 μg/mL,最不敏感菌株EC 50值为最敏感菌株的5.5倍,差异较为明显。3个菌株对甲霜灵达到中抗水平,占供试菌株的5.17%,病原菌对甲霜灵的抗性水平上升,亟须加强药剂的轮换或替代。
关键词 :番茄; 绵疫病菌; 交配型; 甲霜灵; 敏感性
中图分类号:
S 436.412
文献标识码: B
DOI: 10.16688/j.zwbh.2020451
Mating type of Phytophthora capsici and its sensitivity to metalaxylin Jiangxi province
HE Liegan1, ZOU Fen1, ZHOU Yunfeng2, LI Xiangmin1, HUANG Ruirong1, MA Huigang1*
(1.Plant Protection Institute, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China;
2.Poyang Agro-Tech Extension Center, Shangrao 333100, China)
Abstract
In order to clarify category of Phytophthora capsici and resistance level to metalaxyl, the mating type and sensitivity to metalaxyl of P.capsici collected from the main tomato producing areas of Jiangxi in 2018 and 2019 were determined by the methods of matching pairs with standard isolates and determination of colony growth.The results showed that there were two mating types, A 2 and A 0, in the isolates with frequency of 86.2% and 13.8% respectively, while no other mating types were detected, and A 2 was distributed in all sampling regions.The EC 50values of 58 isolates to metalaxyl ranged 0.602 9-3.313 3 μg/mL, with anaverage EC 50value 1.372 7 μg/mL.The EC 50 value of the most insensitive strain was 5.5 times that of the most sensitive strain, and sensitivity of isolates from different regions have a greater difference.There were three isolates with moderate resistance to metalaxyl, accounting for 5.17% of the tested strains.The resistance level increased, so it is urgent to strengthen the rotation or substitution of pesticides.
Key words
tomato; Phytophthora capsici; mating type; metalaxyl; sensitivity
番茄綿疫病是番茄生产上的一种毁灭性病害,其病原菌主要为寄生疫霉Phytophthora parasitica Dast.、辣椒疫霉P.capsici Leonian和茄疫霉P.melongenae Sawada[12]。许多疫霉的有性生殖过程为异宗配合,即需要有两个不同交配型的菌株交配才能进行有性生殖,交配后在藏卵器中形成卵孢子,可以度过外部不良环境,从而得以延续物种[34]。同时,菌株在进行有性生殖时可能进行基因重组,其后代可能具有更强的致病力、生存能力和更广泛的寄主范围。国内外有关番茄绵疫病菌的交配型的报道较少,而有关江西省番茄绵疫病菌的交配型的研究还未见报道,为此,笔者对江西番茄绵疫病菌的交配型进行测定,了解该病害的发生规律,以期为江西番茄绵疫病的防治和抗病育种提供理论依据。
甲霜灵属苯酰胺类杀菌剂[5],广泛应用于霜霉、疫霉和腐霉等引起的卵菌病害的防治。但由于其作用位点单一,极易诱发病原菌产生抗药性,导致防效大幅降低。近年来,有关疫霉对甲霜灵产生抗药性的报道日益增多[611],江西从20世纪90年代起一直使用甲霜灵防治番茄卵菌病害,因此,有必要测定本地区番茄绵疫病菌对甲霜灵的敏感性,明确抗药性程度和地理分布,为杀菌剂的选择和抗药性治理提供科学依据。
1 材料和方法
1.1 材料
1.1.1 供试培养基
10% V8培养基:100 mL V8蔬菜汁,0.2 g CaCO 3,900 mL去离子水,18 g琼脂粉,混合置于三角瓶中摇匀,在121℃高压蒸汽灭菌锅中灭菌20 min,待冷却至60℃时倒入90 mm培养皿中即制得10% V8培养基。
选择性培养基:待上述基础培养基冷却至50℃左右时,加入20 mg/L利福平、200 mg/L氨芐青霉素和100 mg/L制霉菌素,混匀,倒平皿即制得。
1.1.2 供试病原菌
2018年-2019年分别从永新、于都、安义、万载、瑞昌、余江、贵溪、乐平等番茄主产区的绵疫病重发田块采集典型病果,用冰袋装好迅速带回实验室进行分离。先将病果在自来水下冲洗3 min,再用灭菌水冲洗,然后在病果表面病健交界处切取0.5 cm×0.5 cm方形小块,经75%乙醇和3%次氯酸钠消毒后置于选择性培养基平板上。待形成微小菌落后在边缘切取菌丝块移入不含抗菌素的10% V8培养基中培养,如此重复3次后得到纯培养物,共分离纯化得到58株菌株,根据形态学特征和ITS测序结果鉴定为辣椒疫霉P.capsici。将菌株转接至试管中10% V8斜面培养基上,加入灭菌石蜡油覆盖菌面,在10℃条件下避光保存备用,菌株命名采用地名汉语拼音首字母+序号,如YX1表示永新地区1号菌株。
标准交配型菌株A 1和A 2由安徽省农业科学院植物保护研究所提供。
1.1.3 供试药剂
97%甲霜灵原药由江苏宝灵化工有限公司提供,原药溶于丙酮中,配制10 mg/mL母液,保存于4℃冰箱中备用。
1.2 方法
1.2.1 交配型测定
在10% V8培养基上测定辣椒疫霉的交配型,测定方法采用郑小波的直接配对法[12]:将供试菌株及标准交配型菌株活化后,转接于10% V8培养基上培养5 d后用直径6 mm打孔器从菌落边缘打取菌饼,置于培养基平板,两块菌饼之间距离4 cm。将培养基置于培养箱中25℃黑暗培养14 d后,在两个菌落的交界处直接挑取少许菌丝镜检是否有雄器、藏卵器和卵孢子产生。各供试菌株均分别与标准菌株A 1、A 2配对,并与自身相配對为对照,试验设3个重复。
菌株交配型的确定参照郑小波的方法[12]:仅与A 1菌株配对能产生卵孢子的为A 2交配型;仅与A 2菌株配对能产生卵孢子的为A 1交配型;与A 1和A 2菌株配对均不能产生卵孢子的为A 0交配型;与A 1和A 2菌株配对均能产生卵孢子,但单株培养不产生卵孢子的为A 1,A 2交配型;单株培养能产生卵孢子为A 1A 2交配型。
1.2.2 病原菌对甲霜灵的敏感性测定
辣椒疫霉对甲霜灵的敏感性测定参照Misra等[7]的方法。将所有供试菌株活化后转接到含甲霜灵0、5、100 μg/mL 的10% V8培养基中,设3个重复,置于26℃下黑暗培养7 d后,测量各菌落的生长量,根据生长量确定菌株的抗性:5 μg/mL甲霜灵平板上菌落生长量≤40%对照(甲霜灵浓度0 μg/mL)生长量的为敏感;100 μg/mL甲霜灵平板上的菌落生长量≥40%对照生长量的为抗性;100 μg/mL甲霜灵平板上的菌落生长量<40%对照生长量<5 μg/mL甲霜灵平板上的菌落生长量为中抗。
根据上述菌落的生长情况设定两组含甲霜灵浓度梯度,敏感菌株甲霜灵浓度梯度设置为0、0.05、0.15、0.50、1.50、4.50、10.0 μg/mL,中抗菌株甲霜灵浓度梯度设置为0、0.5、1.0、2.0、5.0、10.0、20.0 μg/mL。用直径为6 mm的打孔器在培养好的菌落边缘打取菌饼,置于含上述浓度甲霜灵的10% V8培养基平板中央,共设3次重复,在培养箱中25℃黑暗培养,当对照(0 μg/mL甲霜灵)组菌落直径达到7~8 cm时,用垂直十字交叉法测量各处理的菌落直径,计算抑制率,抑制率=[(对照菌落直径-处理菌落直径)/(对照菌落直径-6)]×100%。将抑制率转化成几率值,采用DPS软件对数据进行统计分析,求出毒力回归方程的斜率、有效抑制中浓度(EC 50)及95%置信限并进行卡方检验。
2 结果与分析
2.1 交配型测定结果
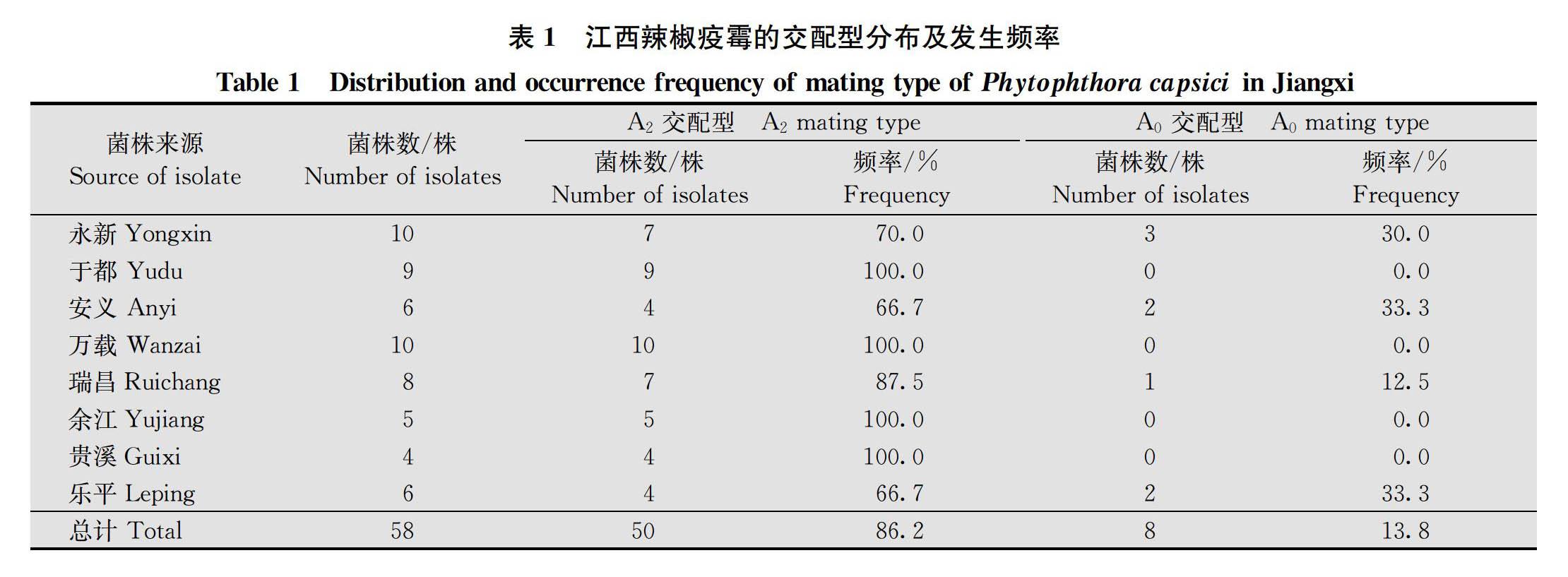
将58株菌株分别与标准菌株进行交配型测定,结果显示(表1),50株为A 2交配型,发生频率为86.2%,8株为A 0交配型,发生频率为13.8%,未检测到其他交配型,表明江西省的辣椒疫霉以A 2交配型为主。
进一步分析交配型的地理分布可知,A 2交配型在全部8个采集地区均有分布,A 0交配型主要分布在永新、安义、乐平和瑞昌,且各地均以A 2交配型为主。此次试验中未检测到A 1、A 1A 2和A 1,A 2等交配型,表明这3种交配型在江西省可能没有或者比例很小。
2.2 番茄绵疫病菌对甲霜灵的敏感性测定
对江西省内8个县市番茄主产区分离到的58个番茄绵疫病菌株进行了甲霜灵敏感性测定。结果表明(表2),所有菌株在含100 μg/mL甲霜灵的培养基上均未长出菌丝,未见抗性菌株,YD2、YD8和RC7等3株菌株在含5 μg/mL甲霜灵的培养基上的生长量超过对照组上生长量的40%,达到中抗水平,占供试菌株的5.17%,其余55株菌株均为敏感菌株,占供试菌株的94.83%。
58株辣椒疫霉菌株对甲霜灵的EC 50范围0.602 9~3.313 3 μg/mL,平均EC 50为1.372 7 μg/mL,最不敏感菌株EC 50为最敏感菌株的5.5倍,差异较为明显。
2.3 不同地理分布的菌株的敏感性区别
对江西不同地理分布菌株进行敏感性分析,从表3可见,不同地区菌株对甲霜灵的敏感性有较大差异,来自于都的菌株其平均EC 50最高,为1.723 0 μg/mL,来自贵溪的菌株其平均EC 50最低,为1.145 9 μg/mL。同一地区的菌株对甲霜灵敏感性差异较大,如瑞昌的菌株其最不敏感菌株EC 50为最敏感菌株的3.54倍,于都的为3.06倍,贵溪的为2.64倍。
3 讨论
辣椒疫霉为异宗配合卵菌,需与A 1 和A 2两种不同交配型进行有性生殖产生卵孢子,而在有性生殖过程中,将会产生新的致病小种、强毒力或抗药性后代群体,对病害的防控造成严重威胁。明确菌株的交配型及分布,对番茄绵疫病防治、抗绵疫病育种和了解病原菌的起源、衍化和迁徙具有重要意义。李萍等[13]和戚仁德等[3]研究发现,安徽省辣椒疫霉存在A 1和A 2两种交配型,其中以A 2占优;刘永刚等[14]测定了甘肃省辣椒疫霉存在A 1、A 2和A 03种交配型,以A 1和A 0占优势;付迎坤等[15]研究表明青海省辣椒疫霉出现A 1、A 2和A 03种交配型,以A 1和A 0占优势;Silvar等[16]研究认为西班牙西北部辣椒疫霉均为A 1型;Gevens等[17]发现美国食用豆上的辣椒疫霉以A 1型为主;本研究结果表明,江西番茄绵疫病辣椒疫霉为A 2 和A 0两种,未发现A 1型,意味着病原菌在田间不能完成有性生殖,因此发生遗传变异的可能性较低,从而可能降低了病害的防治难度。
甲霜灵是由瑞士Ciba-Geigy公司研发的一种苯酰胺类杀菌剂,能有效防治由卵菌引起的病害,但长期单一使用易导致病原菌对其产生抗性。Deahl等[18]和毕朝位等[6]报道了致病疫霉对甲霜灵已产生较重抗药性,Misra等[7]研究发现芋疫霉已开始对甲霜灵产生抗药性,曹继芬等[5]、朱桂宁等[10]和孟建玉等[11]研究表明寄生疫霉对甲霜灵中抗和抗性群体比例上升明显。张海良等[19]2010年测定江西省辣椒疫霉均为敏感菌株,本研究测定有3株菌株对甲霜灵表现为中抗,占供试菌株的5.17%,表明在江西境内已出现抗甲霜灵菌株,因此,建议甲霜灵与其他无交互抗性药剂交替使用,以克服或延缓抗药性的产生。
参考文献
[1] 吕佩珂, 李明远, 吴钜文, 等. 中国蔬菜病虫原色图谱[M]. 北京: 农业出版社, 1992: 64.
[2] 殷洁, 范倩, 黄建国. 撕裂蜡孔菌的新功能—防治茄子绵疫病及促生效应[J]. 中国农业科学, 2018, 51(12): 23002310.
[3] 戚仁德, 汪涛, 李萍, 等. 安徽省辣椒疫霉交配型的分布及在无性后代的遗传[J]. 植物病理学报, 2012, 42(1): 4550.
[4] CAVALIER S T. The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial megaclassification [J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(1): 776.
[5] 曹繼芬, 霍超, 户艳霞, 等. 云南省大理州烟草疫霉交配型及甲霜灵敏感性研究[J]. 中国烟草科学, 2019, 40(6): 4954.
[6] 毕朝位, 车兴壁, 马金成, 等. 致病疫霉对甲霜灵抗性及抗性水平测定[J]. 西南农业大学学报, 2002, 24(4): 307309.
[7] MISRA R S, MISHRA A K, SHARMA K, et al. Characterisation of Phytophthora colocasiae isolates associated with leaf blight of taro in India [J]. Archives of Phytopathology & Plant Protection, 2011, 44(6): 581591.
[8] GISI U, COHEN Y. Resistance to phenylamide fungicides: A case study with Phytophthora infestans involving mating type and race structure[J]. Annual Review of Phytopathology, 1996, 34 (1): 549572.
[9] 汪汉成, 李文红, 冯勇刚, 等. 烟草黑胫病化学防治的历史与现状[J]. 中国烟草学报, 2011, 17(5): 96102.
[10]朱桂宁, 贤小勇, 黄福新, 等. 广西烟草黑胫病菌对甲霜灵的敏感性检测[J]. 南方农业学报, 2011, 42(6): 623626.
[11]孟建玉, 汪汉成, 贾蒙骜, 等. 贵州省烟草黑胫病菌对甲霜灵的抗药性[J]. 植物保护, 2014, 40(5): 168171.
[12]郑小波. 疫霉菌及其研究技术[M]. 北京: 中国农业出版社, 1997.
[13]李萍, 戚仁德, 杨光红, 等. 辣椒疫霉交配型及其对辣椒致病力的关系初步研究[J]安徽农业大学学报, 2011, 38(3): 319322.
[14]刘永刚, 张海英, 郭建国, 等. 甘肃省辣椒疫霉菌的交配型分布及其致病力差异[J]. 植物保护学报, 2008, 35(5): 448452.
[15]付迎坤, 田晓丽, 李屹, 等. 青海省辣椒疫霉菌交配型分析及分布特征[J]. 北方园艺, 2014(18): 139141.
[16]SILVAR C, MERINO F, DIAZ J. Diversity of Phytophthora capsici in northwest Spain: analysis of virulence, metalaxyl response, and molecular characterization[J]. Plant Disease, 2006, 90(9): 11351142.
[17]GEVENS A, DONAHOO R, LAMOUR K, et al. Characterization of Phytophthora capsici causing foliar and pod blight of snap bean in Michigan[J]. Plant Disease, 2008, 92(2): 201209.
[18]DEAHL K L, INGLIS D A, DEMUTH S P. Testing for resistance to metalaxyl in Phytophthora infestans isolates from Northwestern Washington[J]. American Potato Journal, 1993, 70(11): 779795.
[19]张海良, 马辉刚, 李湘民, 等. 辣椒疫霉菌对甲霜灵的敏感性测定[J]. 江西农业大学学报, 2011, 33(2): 270274.
(责任编辑:田 喆)
