宁东煤气化细渣固相碱熔制备单一相A型沸石
2021-01-04赵鹏德吉文欣张世越张莎莎马玉龙
赵鹏德, 吉文欣,, 张世越, 张莎莎, 马玉龙
(1.宁夏大学 省部共建煤炭高效利用与绿色化工国家重点实验室,宁夏 银川 750021;2.宁夏大学 化学化工学院,宁夏 银川 750021)
中国宁东煤化工基地拥有全世界单体产能最大的煤气化装置,其产能的不断增加,带来了巨大的环境压力。煤气化渣产生量近10 Mt/a,其中细渣约占50%;细渣碳含量较高(质量分数20%~30%),无法作为建材使用[1-4]。目前宁东煤气化细渣(CGS)全部填埋,地面作高规格防渗处理,处理成本高昂,占用宝贵的土地资源。因此,研究煤气化细渣的组成及结构特性,针对性地解决宁东煤气化细渣的资源化利用问题迫在眉睫。将煤气化细渣转化为沸石应用于重金属污染的吸附、污水处理、催化等领域,实现“以废制废”[5-6],缓解环境污染的同时达到废物的资源化利用,具有潜在的经济效益。
关于粉煤灰制备沸石的研究很多[7-13],但是宁东煤气化细渣是在1700~1800 K下还原氛围(CO、H2)中产生的飞灰经洗气、絮凝、抽滤后得到的,其组成、结构完全不同于普通粉煤灰[14-16],目前关于煤气化细渣制备沸石的报道极少。固体废弃物的资源化利用,应该选择简单易行、合成产物纯度高的方法,否则难以实现应用。传统的固体废弃物水热合成以及微波辅助合成等方法,几乎没有大规模合成沸石的潜力[17-19]。研究表明[20-21],在水热合成反应之前与NaOH碱熔,可以显著提高沸石的合成效率,并且改善合成沸石的结晶度。而水热反应温度、NaOH/CGS比、水热反应时间、液/固比等会影响合成沸石的类型、结晶程度、阳离子交换性能、比表面积等,而其中NaOH/CGS比是影响合成沸石结晶的重要因素。在煤气化细渣中,Si和Al在石英和莫来石晶体相中占很高的比例,难溶于水,由于Si和Al组分的溶解在沸石成核和结晶过程中起着至关重要的作用[19,22],因此煤气化细渣中Si、Al的活化是制备沸石的重要环节。通过与碱性氢氧化物的固相碱熔,煤气化细渣中的Si、Al组分可以转化为大量的硅酸盐和铝硅酸盐[19]。这些新物种在碱性溶液中极易溶解,产生高含量的Si和Al,促进了沸石的形成,并在随后的水热反应中参与沸石的结晶[23-25]。笔者发现,在固相NaOH碱熔活化煤气化细渣的同时,Na+对沸石合成过程中的结晶和成核过程具有良好的促进作用;适量的Na+可使活化的Si和Al达到最高程度的结晶成核,并且能够减少能源和水资源的消耗[26],使得煤气化细渣固相、更环保地工业合成沸石成为可能。
笔者采用煤气化细渣固相碱熔制备单一相的A型沸石,采用X射线粉末衍射(XRD)、扫描电镜(SEM)、傅里叶变换红外光谱(FT-IR)、比表面积分析(BET)等原位技术对合成A型沸石样品进行表征,分析了影响固相、绿色合成方法的主要因素。针对煤气化细渣的特点,通过对合成条件的优化考察,提出了一种简单易行、合成高纯度A型沸石的方法。以煤气化细渣固相碱熔制备单一相A型沸石,可为煤化工固体废弃物的绿色、资源化利用提供一条具有应用前景的途径。
1 实验部分
1.1 原料及试剂
实验用煤气化细渣(CGS)原料取自中国宁东煤化工基地;煤气化细渣的主要组成及含量见表1。煤气化细渣中SiO2和Al2O3的总质量分数达到70%,所对应的n(SiO2)/n(Al2O3)约为5。铝酸钠盐(NaAlO2)、Na2SiO3均为分析纯,购于上海阿拉丁生化科技股份有限公司;NaOH、NH4Cl均为分析纯,购于国药集团化学试剂有限公司;Nessler reagent(纳氏试剂)购于上海麦克林生化科技有限公司。去离子水由实验室自制。

表1 煤气化细渣(CGS)中的主要组成及质量分数Table 1 Main components and mass fraction of coal gasification slag (CGS) w/%
1.2 A型沸石的制备
采用宁东煤气化细渣作为合成A型沸石的原料,将煤气化细渣在恒温干燥箱中378 K下干燥 24 h,研磨后保存备用。以NaOH作为碱性活化剂,活化煤气化细渣中的Si源、Al源;以NaAlO2作为Al源,调整反应混合物的n(SiO2)/n(Al2O3)以制备目的产物A型沸石。其化学反应方程式如式(1)和式(2):
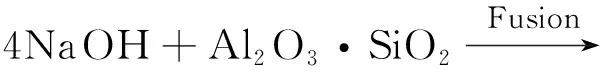
(1)
12Na2SiO3+12NaAlO2+39H2O→
Na12Al12Si12O48·27H2O+24NaOH
(2)
称取干燥后的煤气化细渣3.5 g于研钵中,按m(NaOH)/m(CGS)为1.0~1.6加入NaOH研磨10 min后装入镍舟中,在马弗炉中673~823 K下固相碱熔90 min后冷却降温。在碱熔后的产物中加入NaAlO2以调节混合物的n(SiO2)/n(Al2O3)=1,之后研磨混合物5 min放入100 mL的聚四氟乙烯反应釜内衬中并加入去离子水(去离子水体积与起始反应混合物质量之比(液/固比)为2.5~6.5 mL/g),充分搅拌后装入水热反应釜,在恒温干燥箱中 343~373 K 恒温6~30 h。热反应结束后,经冷却、洗涤、过滤,调节pH值至10左右,将抽滤后的固体产物在378 K下干燥12 h,得到A型沸石样品。
1.3 A型沸石的表征
采用日本理学公司D/max 2200 PC型X射线衍射仪(XRD)表征煤气化细渣和制备得到的A型沸石的物相组成。操作条件:管电压40 kV,管电流40 mA,使用Cu靶,扫描范围为5°~60°。
采用日本电子株式会社JSM-7500型场发射扫描电子显微镜(SEM)对煤气化细渣和制备的A型沸石进行表征,观察其外观形貌特征。
采用美国PerkinElmer公司生产的Spectrum Two型傅里叶变换红外光谱仪(FT-IR)对A型沸石进行FT-IR分析,采用KBr为背景,扫描范围400~4000 cm-1。通过红外吸附峰的位置可判断A型沸石表面特征官能团及键的结构, A型沸石中Si—O键和Al—O键在红外谱图中有特殊的伸缩振动峰。
采用美国Micromeritics公司生产的ASAP2020物理吸附分析仪在77 K获得N2吸附-脱附等温线。通过BET方程确定比表面积,并通过N2-DFT模型计算孔径分布。
采用纳氏分光光度法测定A型沸石产物的阳离子交换容量(CEC,mmol/100 g)。将A型沸石产物于378 K条件下烘干,并准确配置质量浓度为 0.0187 mol/L 的NH4Cl标准溶液备用。将A型沸石样品与NH4Cl标准溶液按比例为10 g/L混合均匀,在298 K恒温摇床中匀速振荡24 h后,用紫外分光光度计在420 nm处用纳氏试剂分光光度法测定NH4+浓度[10],每组实验平行重复3次。沸石的阳离子交换容量(CEC)计算公式如式(3):
(3)
式(3)中:C0为溶液中NH4+离子的初始浓度,mol/L;Ct为t时刻溶液中NH4+离子的浓度,mol/L;V为溶液体积,L;m为A型沸石的质量,此处m取值100 g。
A型沸石的相对结晶度(D)计算公式如式(4)[10,12,27]:
(4)
式(4)中:P为合成A型沸石产物中纯A型沸石的XRD衍射峰面积之和;PS为合成A型沸石产物的XRD衍射峰总面积。
2 结果与讨论
2.1 煤气化细渣特性
煤气化细渣、固相碱熔产物和合成A型沸石产物的XRD谱图如图1所示。可以看出,图1曲线(3)中出现的主要衍射峰为石英,其中的“馒头峰”说明该煤气化细渣中多数物质以玻璃态形式存在。在m(NaOH)/m(CGS)=1.2、固相碱熔温度823 K条件下所得固相碱熔产物的XRD谱图(见图1曲线(2))表明,固相碱熔除去煤气化细渣中残余未燃碳的同时,在碱的作用下煤气化细渣中的石英相转化为NaAlO2、Na2SiO3等可溶性的硅、铝酸盐,证明了固相碱熔可使煤气化细渣中的Si、Al得到活化。

图1 煤气化细渣(CGS)、固相碱熔产物和合成A型沸石样品的X射线衍射谱图Fig.1 X-ray diffraction patterns of coal gasificationfine slag (CGS), solid phase alkali fusion product,and synthetic zeolite A sample(1) Zeolite A; (2) Solid phase alkali fusion product; (3) CGS
2.2 A型沸石合成条件的优化
2.2.1 固相碱熔温度对合成A型沸石的影响
图2为不同固相碱熔温度下合成A型沸石样品的XRD谱图。可以看出,不同的固相碱熔温度,合成A型沸石的XRD衍射峰强度不同。在673 K下石英相的转化不完全,合成A型沸石的相对结晶度仅为30.03%。这可能是由于在较低反应温度下生成NaAlO2和Na2SiO3的量降低而形成的晶核位置更少。随着温度的升高,合成A型沸石的衍射峰强度增大,但在823 K与873 K时差异不大,说明温度的进一步升高,合成A型沸石的结晶度不会再发生显著变化。因此,选择823 K为合适的固相碱熔温度。
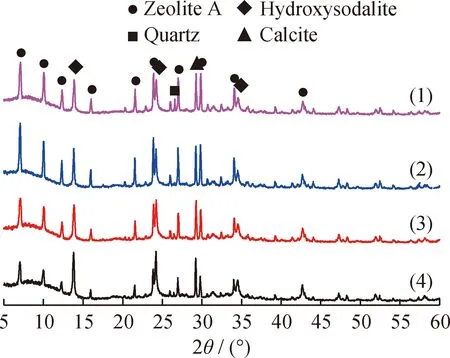
图2 不同固相碱熔温度下合成A型沸石样品的X射线衍射谱图Fig.2 X-ray diffraction patterns of zeolite A synthesizedat different solid phase alkali fusion temperaturesm(NaOH)/m(CGS)=1.2; liquid/solid ratio 5.5 mL/g;Hydrothermal reaction temperature 373 K;Hydrothermal reaction time 24 hSolid phase alkali fusion temperature/K: (1) 873; (2) 823;(3)773; (4)673
2.2.2 水热反应温度对合成A型沸石的影响
图3为不同水热反应温度下合成A型沸石样品的XRD谱图。由图3可见,343 K时合成A型沸石的特征衍射峰强度低,相对结晶度最小。由于水热反应是在封闭的高压釜中进行的,当温度升高到 353 K 时,气体膨胀,增加了聚四氟乙烯衬里的压力,加剧了热运动和有效碰撞,从而提高了水热反应的溶解和结晶速率。随着水热反应温度的再升高,合成A型沸石的衍射峰强度减弱,同时方钠石(Hydroxysodalite)的特征衍射峰明显增强。由于方钠石是较为稳定的结晶相, A型沸石相开始溶解形成方钠石相,因此说明较高温度不利于A型沸石的生成[25,28-29]。在353 K下得到的沸石衍射峰峰型尖锐,且杂晶最少,有利于单一相A型沸石的合成。实验结果说明,不同水热反应温度对A型沸石的合成有较大影响,水热反应温度过高或者过低均不利于A型沸石的生成,本实验选择353 K作为适宜的水热反应温度。
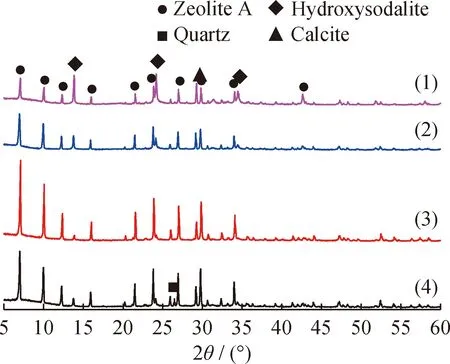
图3 不同水热反应温度下合成A型沸石样品的X射线衍射谱图Fig.3 X-ray diffraction patterns of zeolite A synthesized atdifferent hydrothermal reaction temperaturesm(NaOH)/m(CGS)=1.2; Solid phase alkali fusion temperature 823 K;Liquid/solid ratio 5.5 mL/g; Hydrothermal reaction time 24 hHydrothermal reaction temperature/K: (1) 373; (2) 363;(3) 353; (4) 343
2.2.3m(NaOH)/m(CGS) 对合成A型沸石的影响
m(NaOH)/m(CGS)是固相碱熔过程中影响Si、Al活化的重要因素,通过与碱性氢氧化物的固相碱熔,煤气化细渣中的Si、Al组分可以转化为大量的硅酸盐和铝酸盐。这些新物种在碱性溶液中极易溶解,产生高含量的Si、Al化合物,促进了沸石的形成,并在随后的水热反应中参与沸石的结晶。反应混合物在固相碱熔过程中,NaOH起到活化剂的作用,不同的m(NaOH)/m(CGS)会影响煤气化细渣中Si、Al的活化程度,进而影响水热合成沸石的结晶度。Na+在水热合成沸石过程中也起着重要作用,可以作为稳定沸石骨架的亚结构单元(特别是六分子环)[23-26]。图4为不同m(NaOH)/m(CGS)下合成A型沸石样品的XRD谱图。可以看出,合成A型沸石的结晶度随着NaOH含量的增加而提高,而在m(NaOH)/m(CGS)大于1.2时,方钠石衍射峰强度逐渐增强,方钠石结晶度增加,导致沸石结晶度降低。因此,在本实验中选择适宜条件为m(NaOH)/m(CGS)=1.2。

图4 固相碱熔时不同m(NaOH)/m(CGS)所合成A型沸石的X射线衍射谱图Fig.4 X-ray diffraction patterns of zeolite A synthesized bydifferent m(NaOH)/m(CGS) in solid phase alkali fusionSolid phase alkali fusion temperature 823 K;Liquid/solid ratio 5.5 mL/g; Hydrothermal reactionTemperature 353 K; Hydrothermal reaction time 24 hm(NaOH)/m(CGS): (1) 1.6; (2) 1.5; (3) 1.2; (4) 1.0
2.2.4 水热反应时间对合成A型沸石的影响
图5为不同水热反应时间下合成A型沸石的XRD谱图。由图5可见,在水热反应时间为6 h时出现A型沸石的特征衍射峰,但此时衍射峰强度较弱,A型沸石相对结晶度较低;随着水热反应时间的增加,合成产物主要为A型沸石,且特征衍射峰强度不断增加,杂峰较少;但是,当水热反应时间增加到18 h后,合成产物中有明显的方钠石特征衍射峰出现,并逐渐成为主要产物;而当水热反应时间超过24 h时,A型沸石的特征衍射峰消失,晶体转化成更为稳定的方钠石晶体。结果表明,水热反应时间不足,沸石晶体无法生长完全,水热反应时间过长,增加成本的同时沸石也会转化为其他晶体,降低合成A型沸石样品的结晶度。该XRD表征结果与文献[30]报道相一致。因此,合成A型沸石的水热反应时间以12 h为宜,此时产物衍射峰较强、相对结晶度最好。
2.2.5 不同液/固比对合成A型沸石的影响
不同的液/固比意味着消耗水量的多少,固相碱熔活化后,为了符合固相合成的目标,应该尽量降低水耗和能耗,需要找到所需水量更少、结晶度更高的合成单一相A型沸石的条件,这是规模生产的必然要求。图6为不同液/固比下合成A型沸石样品的XRD谱图。可以看出,在水热反应过程中,实验所选择的液/固比条件下均有A型沸石衍射峰出现。所不同的是,液/固比为2.5和3.5 mL/g时,合成A型沸石样品的衍射峰的强度偏低,并且还有方钠石的杂峰出现;而在液/固比达到4.5 mL/g左右时,合成A型沸石样品中出现的A型沸石特征峰与标准卡片(PDF#73-2340)吻合较好,并且相对结晶度在所选择的液/固比范围内更好。因此,本实验选择适宜的液/固比为4.5 mL/g。
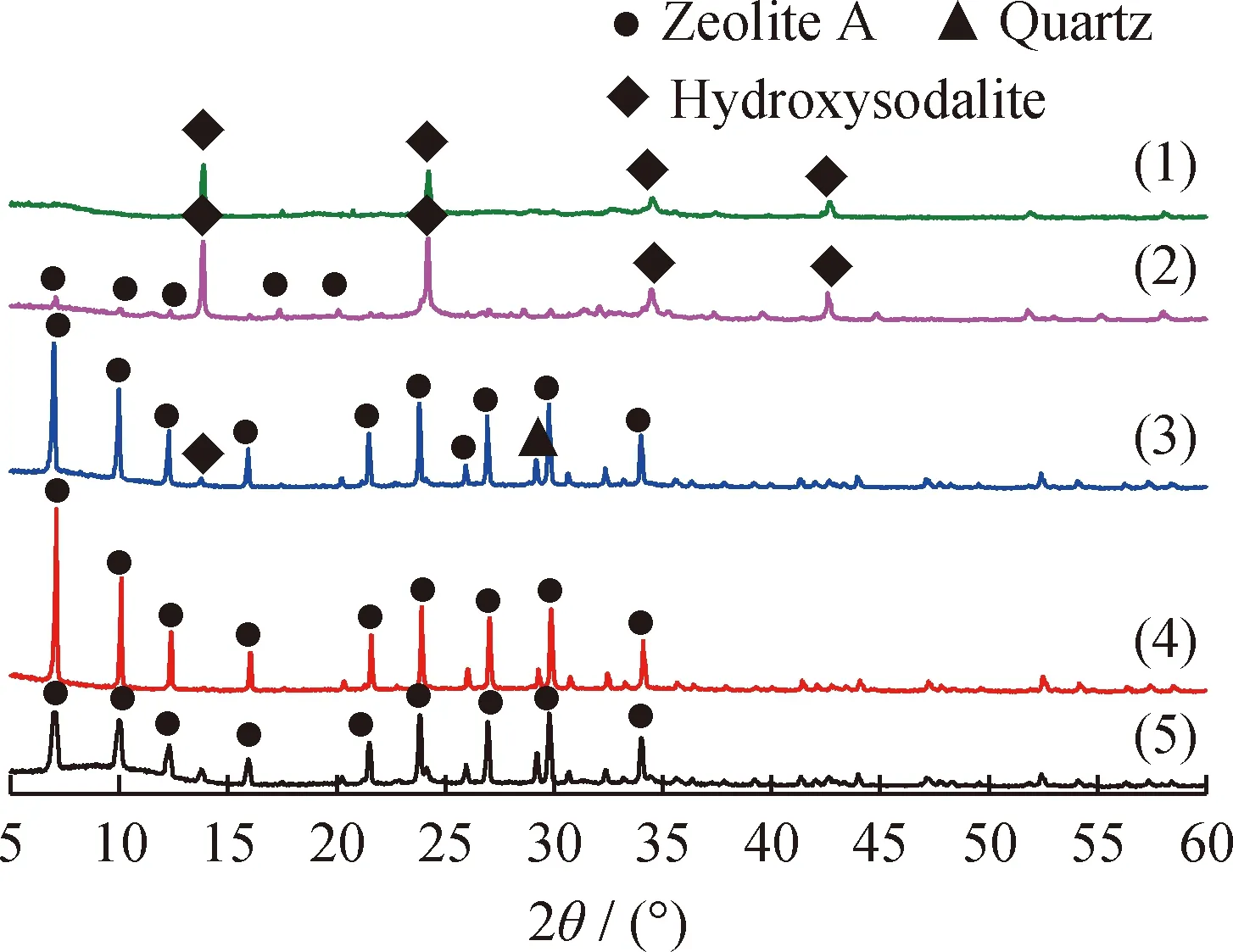
图5 不同水热反应时间下合成A型沸石的X射线衍射谱图Fig.5 X-ray diffraction patterns of zeolite A synthesizedat different hydrothermal reaction timem(NaOH)/m(CGS)=1.2; Solid phase alkali fusion temperature 823 K;Liquid/solid ratio 5.5 mL/g; Hydrothermal reaction temperature 353 KHydrothermal reaction time/h: (1) 30; (2) 24;(3) 18; (4) 12; (5) 6

图6 不同液/固比下合成A型沸石样品的X射线衍射谱图Fig.6 X-ray diffraction patterns of zeolites A synthesizedat different liquid/solid ratiosm(NaOH)/m(CGS)=1.2; Solid phase alkali fusion temperature 823 K;Hydrothermal reaction temperature 353 K;Hydrothermal reaction time 12 hLiquid/solid ratio/(mL·g-1): (1) 6.5; (2) 5.5;(3) 4.5; (4) 3.5; (5) 2.5
通过上述合成条件的优化,得到利用宁东煤气化细渣为原料固相碱熔制备A型沸石的最佳条件,即m(NaOH)/m(CGS)为1.2、固相碱熔温度823 K、水热反应温度353 K、水热反应时间12 h、液/固比4.5 mL/g。通过相对结晶度公式计算,得到该条件下合成A型沸石的相对结晶度高达93.1%。
2.3 合成沸石的特性表征结果
2.3.1 FT-IR表征结果
在m(NaOH)/m(CGS)=1.2、固相碱熔温度为823 K、液/固比为4.5 mL/g、水热反应温度353 K、水热反应时间12 h条件下,固相碱熔合成A型沸石样品的红外光谱图如图7所示。可以看出,在465和562 cm-1处出现的吸收峰为Al—O—Al伸缩振动,668 cm-1处出现的吸收峰为Si—O—Si或 Al—O—Si 伸缩振动。在1004 cm-1处出现的特征峰为Si—O—Si或Al—O—Si非对称伸缩振动,另外,在3422和1657 cm-1处有很强的—OH伸缩振动和—OH弯曲振动。FT-IR表征结果与XRD结果相一致,表明煤气化细渣中的硅铝酸盐矿物转化为A型沸石的特定矿物相。通过FT-IR分析,每个FT-IR谱带均与文献报道A型沸石谱的相一致[31-33],证实了A型沸石结构单元的存在。
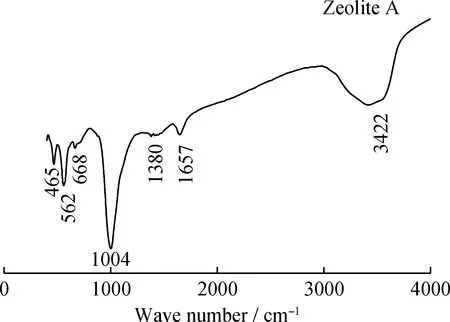
图7 固相碱熔合成A型沸石样品的红外谱图Fig.7 Infrared spectrum of zeolite A synthesizedby solid phase alkali fusionm(NaOH)/m(CGS)=1.2; Solid phase alkali fusion temperature 823 K;Liquid/solid ratio 4.5 mL/g; Hydrothermal reaction temperature 353 K;Hydrothermal reaction time 12 h
2.3.2 比表面积及扫描电镜结果
通过与文献[8-9]报道中合成A型沸石进行对比,笔者所采用的固相碱熔制备的单一相A型沸石的阳离子交换能力和BET比表面积均更高(见表2)。图8为固相碱熔合成A型沸石样品的吸附-脱附等温线及孔径分布,通过测定得到A型沸石的比表面积和总孔体积分别为61.10 m2/g、0.09 cm3/g,平均吸附孔径为6.02 nm。图9为煤气化细渣和固相碱熔合成A型沸石样品的扫描电镜照片。可以看出,煤气化细渣的晶体颗粒大小范围为1.0~2.0 μm,以表面光滑的球形颗粒和团聚的多孔玻璃质小颗粒为主。图9(a)、(b)、(c)证实了固相碱熔合成单一相A型沸石的特殊立方形貌,固相碱熔制备的A型沸石主要由规则的立方晶粒组成,结晶产物分布良好,呈现规则的立方结构和完整的晶体平面。通过对离子交换能力的测定,得到固相碱熔制备的A型沸石阳离子交换能力CEC=268.4 mmol/100 g。
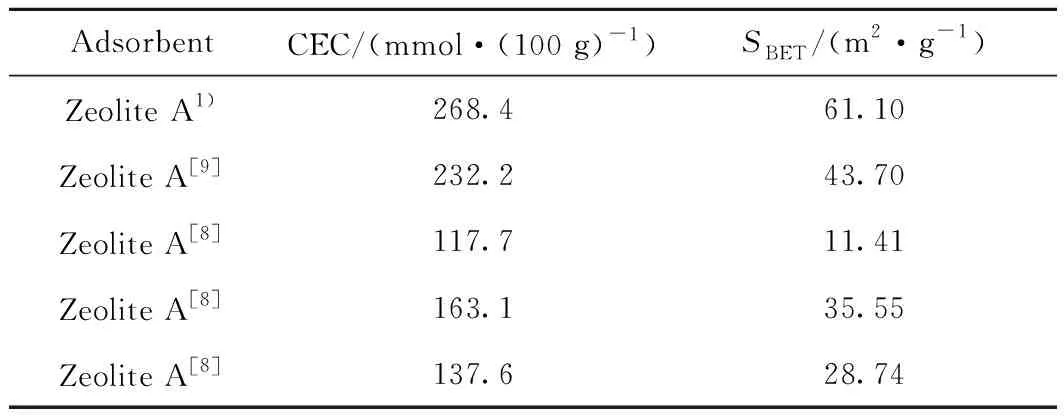
表2 不同A型沸石的阳离子交换能力(CEC)及比表面积(SBET)比较Table 2 Comparison of cationic exchange capacity (CEC) andspecific surface area (SBET) of different zeolite A

图8 固相碱熔合成A型沸石样品的吸附-脱附等温线及孔径分布Fig.8 Adsorption-desorption profiles and pore diameterdistribution of zeolite A synthesized by solid phase alkali fusionm(NaOH)/m(CGS)=1.2; Solid phase alkali fusion temperature 823 K;Liquid/solid ratio 4.5 mL/g; Hydrothermal reaction temperature 353 K;Hydrothermal reaction time 12 h Adsorption; Desorption
3 结 论
(1)煤气化细渣固相碱熔制备A型沸石反应中m(NaOH)/m(CGS)是影响合成单一相A型沸石的重要因素,Na+对沸石合成中结晶和成核过程具有良好的促进作用,适当的固相碱熔m(NaOH)/m(CGS)可使煤气化细渣活化程度更高,硅铝酸盐更好地结晶成核,并且消耗较低的能源和水。

图9 煤气化细渣及固相碱熔合成A型沸石的扫描电镜照片Fig.9 SEM images of fine coal gasification slag andzeolite A synthesized by solid phase alkali fusionm(NaOH)/m(CGS)=1.2; Solid phase alkali fusion temperature 823 K;Liquid/solid ratio 4.5 mL/g; Hydrothermal reaction temperature 353 K;Hydrothermal reaction time 12 h(a), (b), (c) Zeolite A; (d) CGS
(2)煤气化细渣固相碱熔制备单一相A型沸石的最佳条件为:m(NaOH)/m(CGS)=1.2;固相碱熔温度823 K;液/固比为4.5 mL/g;水热反应温度353 K,水热反应时间12 h。
(3)通过对固相碱熔合成A型沸石样品进行SEM、XRD、BET、FT-IR等表征分析,在无模板剂的条件下,利用固相碱熔方法制备得到的A型沸石,相对结晶度达到93.1%,产物为单一相A型沸石,无须二次分离,其比表面积达到61.1 m2/g,阳离子交换能力(CEC)达到268.4 mmol/100 g。
