广灵驴ADD1基因的克隆和序列分析与组织表达
2021-01-04李武峰孙瑜彤赵婧微李树军
李武峰,孙瑜彤,赵婧微,李树军
广灵驴基因的克隆和序列分析与组织表达
李武峰1,孙瑜彤1,赵婧微1,李树军2
(1.山西农业大学生命科学院,山西 太谷 030801;2.繁峙县动物疫病预防控制中心,山西 繁峙 034300)
运用RT-PCR方法,克隆广灵驴的基因的CDS区,对其进行序列分析,并通过qRT-PCR技术鉴定基因在广灵驴心脏、肝脏、脾脏、肺脏、肾脏和背最长肌中的相对表达水平。结果表明:广灵驴基因完整的CDS序列全长为2 223 bp,可编码740个氨基酸,序列已提交到NCBI,登录号为MN_166472,其核苷酸序列与马的核苷酸序列的同源性最高,达99.6%;生物信息学预测ADD1蛋白为结构稳定的亲水性蛋白,理论等电点为5.58,二级结构主要以α-螺旋和无规则卷曲为主,存在1个Ⅱ类醛缩酶和内收蛋白N端超家族结构域,该蛋白没有信号肽及跨膜区域,主要定位在细胞核中,序列中共存在88个磷酸化位点,69个O-糖基化位点和3个N-糖基化位点;实时荧光定量检测结果表明,基因在广灵驴的6种组织中均有表达,但存在差异,在背最长肌中表达量最丰富,在肝脏中表达量最低。
广灵驴;基因;克隆;生物信息学分析;差异表达
内收蛋白(adducin,ADD)是由α、β和γ 3个不同亚基组成的异二聚体或异四聚体蛋白[1-2],是构成血影蛋白的膜骨架的重要部分,可以介导各种细胞生理过程中的信号转导。内收蛋白家族包括3个密切相关的成员,分别是α-内收蛋白(ADD1)、β-内收蛋白(ADD2)及γ-内收蛋白(ADD3)[3-4],其中ADD1和ADD3在大多数组织中表达,而ADD2的表达受到了限制,主要在脑和造血组织(骨髓、脾)中大量表达[5-6]。3种内收蛋白在结构上相似,都包含有一个N末端球状头部结构、一个颈部结构和一个C末端蛋白酶敏感性尾部结构[7-8]。ADD1是内收蛋白家族的重要成员,在细胞的增殖、连接、信号转导、迁移和离子转运等方面具有重要作用,是细胞发生作用的信号传递因子[9-12]。基因可以通过调节肌动蛋白和肾小管细胞基底外侧钠-钾ATP酶的表达来影响钠平衡,从而对盐敏感性高血压有影响[13-14];在利尿剂的作用下,基因多态性也可能会引发糖尿病[15]。另外,基因在有丝分裂和减数分裂中也发挥了重要的作用[16-17]。研究[18]发现,ADD1和α2-Na/K ATP酶的蛋白复合体在星形胶质细胞中富集,会导致家族性肌萎缩侧索硬化症,从而对肌肉发育产生一定的影响。栾德琴[19]的研究表明,基因在皋黄鸡幼龄时的肌肉生长发育中发挥了积极的作用。基因多态性也能够影响肉牛的生长性状和肌肉发育[20],可用于肉牛育种计划的标记辅助选择。
广灵驴是中国优良的地方品种,主要分布于山西省东北部广灵、灵邱及其周围各县的边缘地带。广灵驴肉质鲜嫩、营养丰富。目前,国内外有关肉驴基因的克隆及其在不同组织中的差异表达却鲜有报道。本研究中,选取基因作为目的基因,利用RTPCR技术对广灵驴基因CDS编码区进行克隆,并对其核酸序列和蛋白结构进行分析,检测基因在广灵驴各个组织中的表达水平,旨在为今后探索基因所参与的生理功能提供依据。
1 材料与方法
1.1 材料
1.1.1试验动物
供试广灵驴由山西省忻州市繁峙县田源毛驴养殖科技发展有限公司提供。用无菌方式采集10头3岁饲养方式相同、健康公驴的心脏、肝脏、脾脏、肺脏、肾脏和背最长肌组织作为试验样本,分别放入2 mL冻存管中,并立即冻于液氮里,随后带回实验室后放于-80 ℃超低温冰箱保存,备用。
1.1.2主要试剂
大肠埃希菌DH5α感受态细胞、pGM-T克隆试剂盒、DNA胶回收纯化试剂盒均购于天根生化科技(北京)有限公司;DL2000 DNA Marker、2×PCR Master Mix均购于中科瑞泰(北京)生物科技有限公司;反转录试剂盒(M5 Super qPCR RT kit with gDNA remove)、荧光定量试剂盒(2×Realtime PCR Super mix)购于北京聚合美生物科技有限公司;Trizol试剂盒、氨苄青霉素、胰蛋白胨、酵母提取物及琼脂糖均购于北京索莱宝生物科技有限公司。
1.2 方法
1.2.1引物的设计与合成
参考NCBI中公布的驴基因序列(登录号为XM_014832815),利用Primer 3.0和GenScript Primer Design分别设计用于扩增广灵驴基因CDS区序列的4对扩增引物和1对荧光定量PCR的特异性引物,并将作为内参基因,引物序列见表1。引物由生工生物工程(上海)有限公司合成。

表1 用于扩增ADD1基因的引物信息
1.2.2总RNA提取和cDNA合成
采用Trizol法提取广灵驴心脏、肝脏、脾脏、肺脏、肾脏和背最长肌的总RNA,并使用核酸测定仪检测RNA的浓度和质量,之后按照M5 Super qPCR RT kit with gDNA remove反转录试剂盒说明书将其合成cDNA第一链。反应结束获得的cDNA模板于-20 ℃保存。
1.2.3PCR扩增与克隆测序
以cDNA第一条链为模板,扩增基因全长CDS区。PCR扩增反应体系(20 μL)为:cDNA模板2 μL,2×Taq PCR Master Mix 10 μL,上、下游引物各0.8 μL,ddH2O 6.4 μL。反应条件为:94 ℃预变性5 min,94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸1 min,共35个循环,72 ℃延伸5 min,4 ℃保存。PCR扩增后,经琼脂糖凝胶电泳检测后得到4段长度不同、可重叠的扩增产物;确定产物后,对目的条带进行回收;连接pGM-T载体,过夜后转化到大肠埃希菌DH5α感受态细胞中,经过涂板、挑取单克隆、扩大培养后,再利用PCR筛选阳性质粒,最后交由上海美吉生物医药科技有限公司测序。
1.2.4序列分析
运用NCBI和DNAMMAN 6.0对测序结果进行比对,拼接,并进行开放阅读框预测;采用Clustalx和DNASTAR中的MegAlign程序对广灵驴与马、人、猪、山羊、绵羊、家牛、小鼠的基因核苷酸序列和蛋白序列进行多重比对、同源性分析,并使用MEGA 7.0构建基因系统进化树;运用ExPASy ProtParam、ProtScal分别对ADD1蛋白的氨基酸组成、不稳定系数等基本理化性质和亲/疏水性进行分析;采用NPS@SOPMA、SWISS-MODEL和NCBI中的CDD(Conserved domain database)对ADD1蛋白序列的二级结构、三级结构和蛋白保守结构域进行检测分析;运用SignaIP 5.0、TMHMM 2.0和PSORT II Prediction分别对ADD1蛋白的信号肽、蛋白跨膜结构及ADD1蛋白的亚细胞定位情况进行检测分析;运用NetPhos 3.1 Server、NetNGlyc 1.0及NetOGlyc 1.0 Server分别对ADD1蛋白潜在磷酸化位点和糖基化位点进行鉴别分析。
1.2.5实时荧光定量PCR扩增
以1.2.2中合成的cDNA为模板,并把背最长肌组织的表达量作为对照,利用实时荧光定量PCR检测基因在广灵驴6种组织中的相对表达情况。每个样品3个重复并有相应内参组。扩增完成后,利用2-△△Ct法计算试验结果。运用SPSS 24.0对所获得的数据进行单因素方差分析,并利用Excel绘图。
2 结果与分析
2.1 广灵驴ADD1基因的序列
将广灵驴基因的CDS区按表1中的所列引物分为4段扩增,分别获得长度为584、779、922、692 bp的4个片段,用1%琼脂糖凝胶电泳检测。如图1所示,4段PCR扩增产物无杂带,条带明亮,电泳片段大小与预期估计的片段大小相符。将扩增产物测序拼接后得到一段长度为2 223 bp的mRNA序列,将序列提交至NCBI(GenBank登录号为MN_166472),可编码740个氨基酸(图2)。

M DNA Marker;1~4分别为引物ADD1-1、ADD1-2、ADD1-3和ADD1-4的PCR扩增产物。

图2 广灵驴ADD1基因的测序结果
2.2 广灵驴ADD1基因及其编码蛋白序列的同源性比对分析结果
运用MegAlign软件将广灵驴基因与GenBank中已提交的核苷酸序列进行同源性比对,发现广灵驴基因与马(XM_014738607.2)、人(NM_001119.5)、猪(XM_013978492.2)、山羊(XM_018049844.1)、绵羊(XM_027971285.1)、家牛(XM_005208231.3)、小鼠(NM_001331084.1)的同源性分别为99.5%、91.6%、88.1%、89.3%、88.8%、85.1%和84.4%。
使用MegAlign软件将广灵驴ADD1蛋白序列与GenBank中已提交的蛋白序列进行同源性比对,发现广灵驴ADD1蛋白与马(XP_014594093.1)、人(NP_001110.2)、猪(XP_013833946.2)、山羊(XP_017905333.1)、绵羊(XP_027827086.1)、家牛(XP_005208289.1)、小鼠(NP_001019629.2)的同源性分别为99.6%、93.7%、92.1%、94.3%、93.6%、94.0%和91.7%。
2.3 ADD1基因的系统进化树分析结果
采用MEGA 7.0中N-J法构建广灵驴的基因核苷酸序列与马、人、猪、山羊、绵羊、家牛、小鼠的基因核苷酸序列的系统进化树(图3)。从图3可知,广灵驴与马聚为1类,说明广灵驴与马的亲缘关系最近,同时又与绵羊、山羊、家牛和猪聚为1大类,与人和小鼠的亲缘关系比较远。

图3 ADD1基因核苷酸的系统进化树
2.4 广灵驴ADD1蛋白分子特征的预测结果
2.4.1氨基酸序列的理化性质和亲/疏水性
广灵驴基因编码的蛋白质ADD1蛋白分子式为C3556H5628N994O1132S22,理论相对分子质量为8.112×104,理论等电点(pI)为5.58,不稳定指数为54.69。可见,此蛋白是酸性不稳定的,其编码的740个氨基酸中谷氨酸含量(8.9%)和脯氨酸含量(8.8%)较多,色氨酸含量(0.5%)最低,消光系数为53 665,脂溶指数为69.85。如图4所示,广灵驴ADD1蛋白的部分序列有强亲水性,ADD1多肽链的第184位脯氨酸(P)具有最大疏水性(2.633),第443位精氨酸(R)具有最大亲水性(-3.500),亲水性的总平均值为-0.649,该蛋白为可溶性蛋白。

图4 ADD1蛋白亲/疏水性分析结果
2.4.2ADD1蛋白的二级结构和三级结构
如图5所示,ADD1蛋白的二级结构中α-螺旋占33.11%,延伸链占14.32%,β-转角占4.73%,无规则卷曲占47.84%。

h a-螺旋;c 无规则卷曲;t β-转角;e 延伸链。
如图6所示,ADD1蛋白的三级结构主要由α-螺旋、无规则卷曲和延伸链构成,与二级结构的预测结果相一致。

图6 ADD1蛋白的三级结构预测结果
2.4.3ADD1蛋白的保守域
如图7所示,ADD1蛋白只含有1个Ⅱ类醛缩酶和内收蛋白N端超家族结构域(Aldolase_Ⅱ superfamily),位于第145~392残基上。

图7 ADD1蛋白的保守域预测结果
2.4.4ADD1蛋白的跨膜结构和信号肽及亚细胞定位
如图8所示,ADD1蛋白在膜外的可能性高于膜内,并且整条序列没有明显的跨膜区域,说明该蛋白为膜外蛋白。
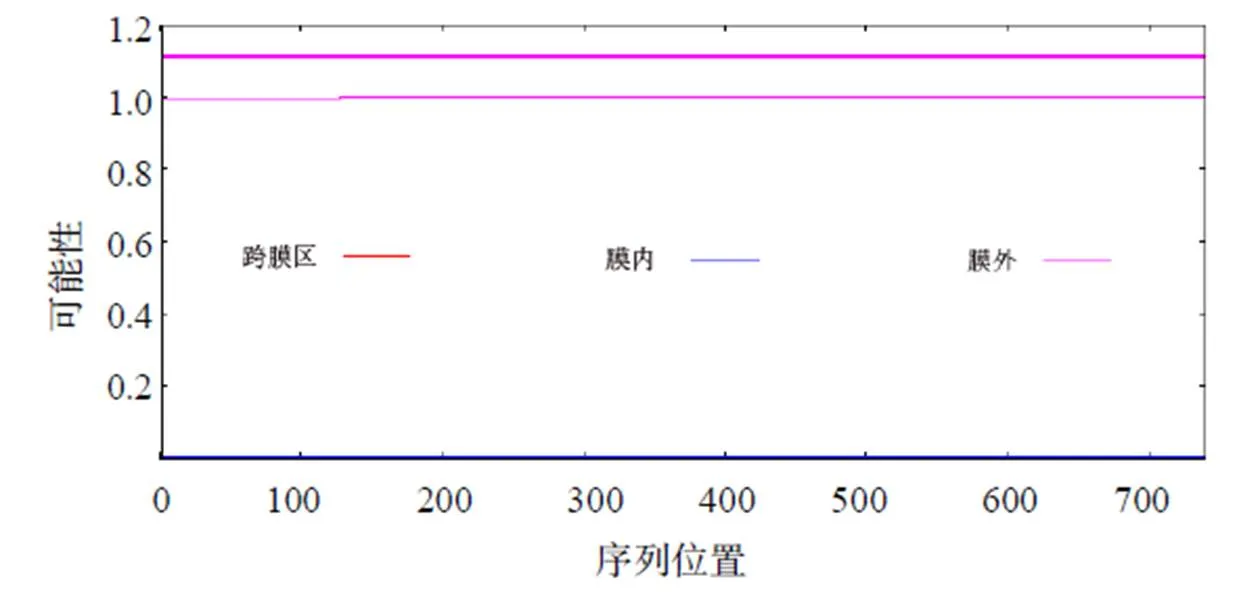
图8 ADD1蛋白的跨膜区域分析结果
如图9所示,值、值及值的最大值均小于阈值0.5,表明ADD1蛋白没有信号肽的剪切位点,属于非分泌蛋白。

C值、S值、Y值分别示C切割位点评分、S信号肽评分和Y联合切割位点评分。
亚细胞定位预测显示,ADD1蛋白分布于液泡和细胞质的可能性都为4.3%,分布于细胞核的可能性为91.3%,预测可信度为89%,该蛋白有可能存在于细胞核中。
2.4.5ADD1蛋白的修饰结构
如图10所示,ADD1蛋白共存在88个潜在的磷酸化位点,包含54个丝氨酸(Ser)位点、23个苏氨酸(Thr)位点、11个酪氨酸(Tyr)位点(图10-a);ADD1蛋白中存在69个O-糖基化位点和3个N-糖基化位点,其中,3个N-糖基化位点分别位于氨基酸序列的84、118和463处(图10-b)。
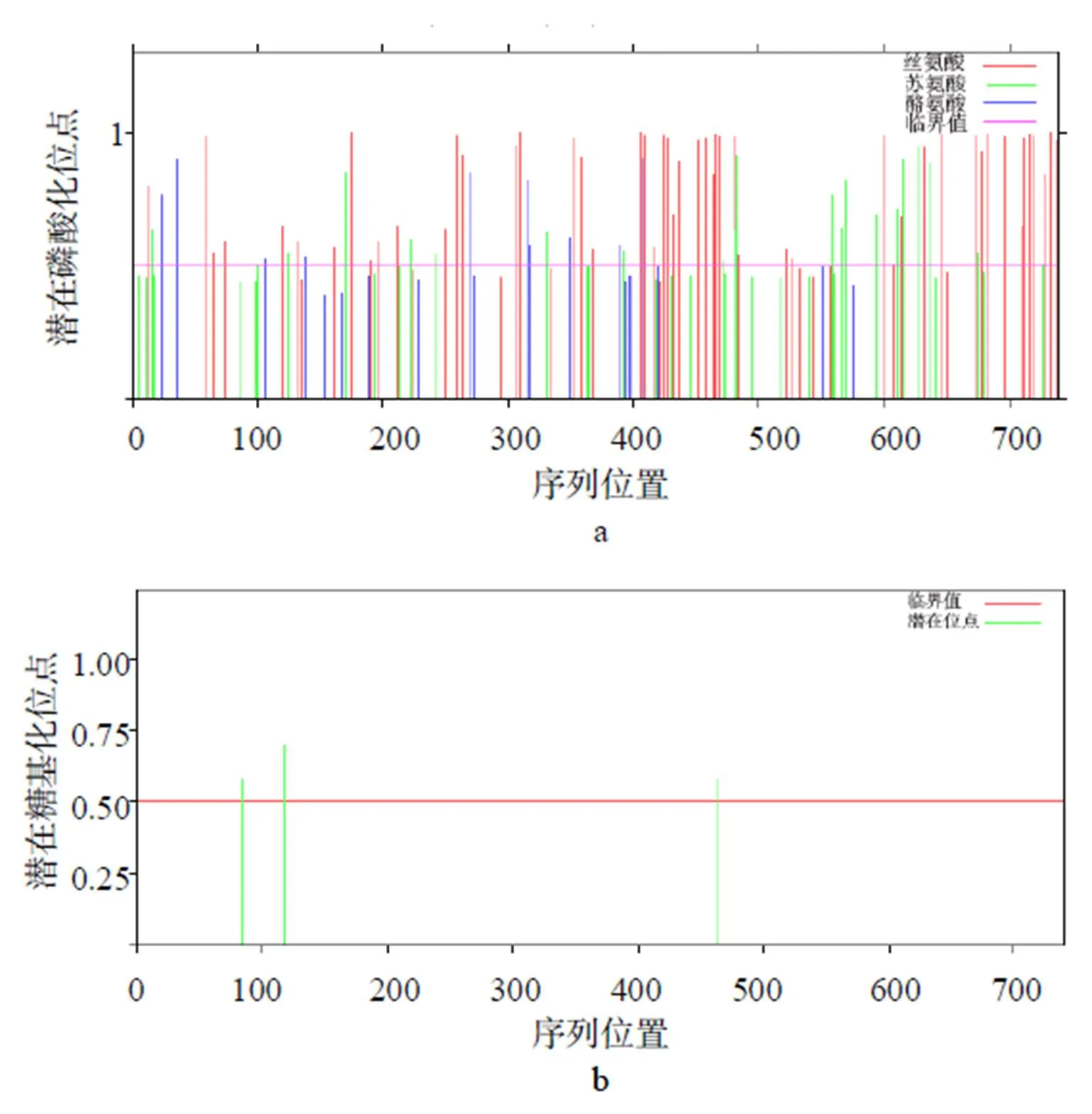
图10 ADD1蛋白的磷酸化位点(a)和N-糖基化位点(b)的预测结果
2.5 ADD1基因在广灵驴不同组织中的表达情况
如图11所示,基因在广灵驴6种组织中均有表达,但存在差异;在背最长肌中的表达最丰富,其表达量极显著高于其他5种组织的(< 0.01);在心脏的表达量极显著高于肺脏、肾脏和脾脏中的(< 0.01);在肝脏中的表达量最低,其表达量极显著低于其他5种组织的(<0.01)。
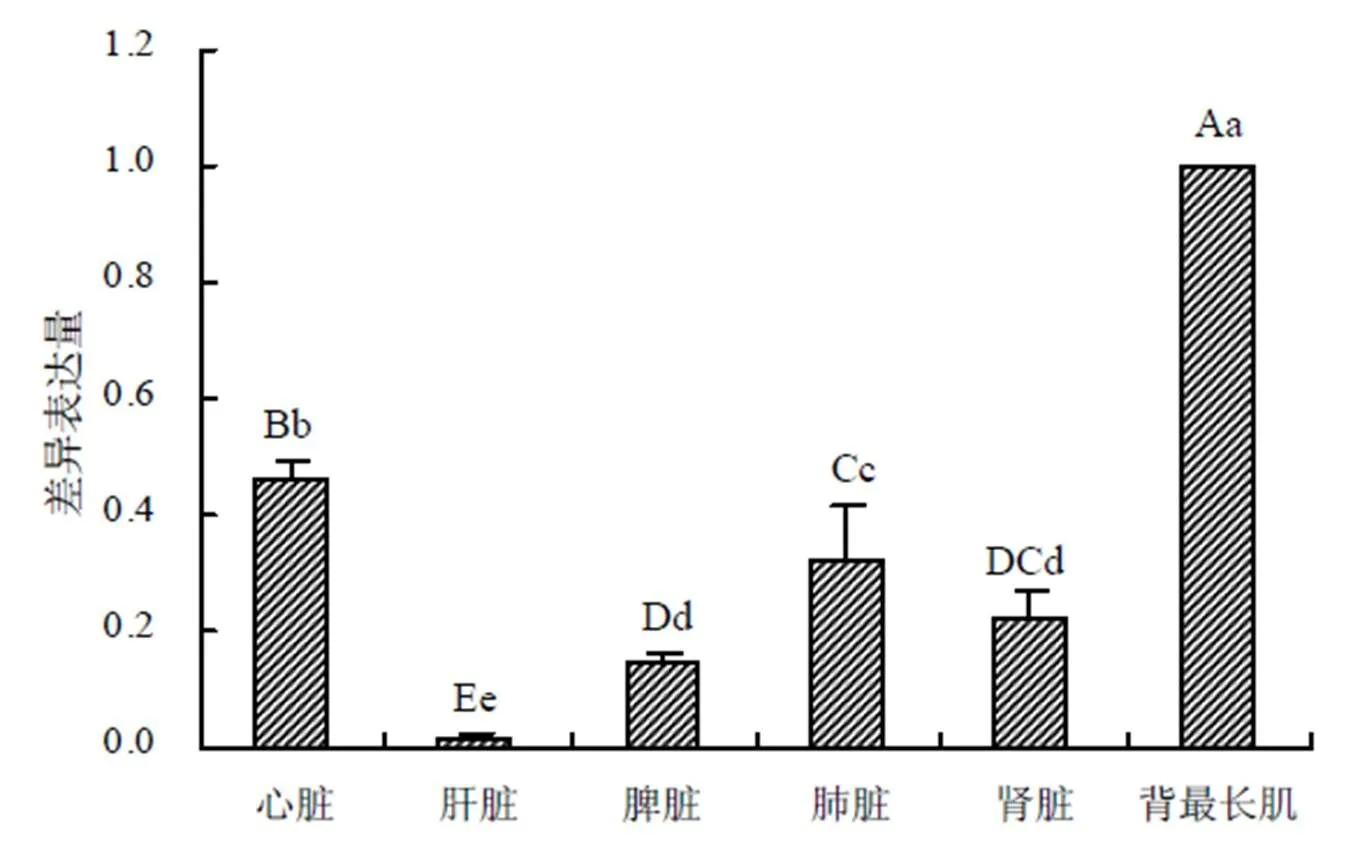
不同小写字母示组织间差异显著(P<0.05);不同大写字母示组织间差异极显著(P<0.01)。
3 结论与讨论
本研究成功克隆了广灵驴基因完整的CDS编码区,并对序列进行了生物信息学分析,同时对基因在广灵驴不同组织中的表达情况进行了检测。广灵驴基因CDS编码区全长为2 223 bp,可编码740个氨基酸,序列已提交至NCBI(GenBank登录号为MN_166472)。通过对广灵驴基因核苷酸序列和蛋白序列与其他物种相关序列进行同源性比对发现,广灵驴基因核苷酸序列与其他物种的同源性在84%以上,蛋白序列与其他物种的同源性在91%以上,说明基因不仅在不同物种之间的进化比较保守,而且在不同物种中能够保持结构和功能的一致性。基因系统进化树结果显示,广灵驴与马的亲缘关系最近,同处于一个遗传进化分支上,与人、小鼠的亲缘关系最远,说明在某些核苷酸序列上广灵驴与马的属性更接近,这符合生物进化的特征。
蛋白质的理化性质分析显示,广灵驴ADD1蛋白为不稳定酸性蛋白,部分序列有强亲水性,且整体表现为亲水性。在蛋白质中,疏水性残基一般位于蛋白质的内部,而亲水残基一般位于蛋白质的表面[21],预测结果说明了ADD1蛋白质表面的亲水性残基要多于蛋白质内部的疏水性残基。蛋白质二级结构预测发现,ADD1蛋白中无规则卷曲的比例最高,约占47.84%,进一步说明ADD1蛋白为不稳定蛋白。无规则卷曲是蛋白质肽链中构成配体/受体结合的活性部位,易受侧链相互影响而改变空间构象[22];因此,ADD1蛋白二级结构中大量的无规则卷曲可能与蛋白质的构象和功能密切相关。ADD1蛋白的三级结构主要由α-螺旋、无规则卷曲和延伸链构成,与该蛋白的二级结构预测结果相一致。蛋白保守功能域预测发现,ADD1蛋白中存在着1个Ⅱ类醛缩酶和内收蛋白N端超家族结构域,N端结构域具有寡聚化位点,有助于ADD1形成异二聚体和异四聚体结构[23]。
信号肽预测发现,ADD1蛋白没有信号肽区域,表明ADD1不属于分泌蛋白,不能够在细胞外起作用。跨膜预测发现,ADD1无跨膜蛋白,不能发生跨膜现象,说明该蛋白不能作为膜受体来发挥作用。亚细胞定位预测发现,有91.3%的ADD1蛋白存在于细胞核中,预测该蛋白可能在核内发挥了至关重要的作用。有研究[24-25]发现,ADD1在失去细胞与细胞间的粘附后会移位至细胞核中,因而ADD1可能存在核特异性功能,这与预测的结果相符合。蛋白质在翻译后经过适当的修饰,才会形成成熟蛋白质,其中磷酸化修饰和糖基化修饰是非常重要的翻译后修饰,蛋白质磷酸化修饰是控制酶活性的关键,在细胞信号转导等生理过程中也起非常重要的作用[26]。蛋白修饰结构预测显示,ADD1蛋白存在88个磷酸化位点,可以判断ADD1蛋白在参与生物学功能的过程中或与其他蛋白发生相互作用的时候可能会被磷酸化。此外,ADD1蛋白还存在多个糖基化位点,这也为其参与多种细胞机制,包括蛋白质折叠、受体激活和信号转导等生物过程打下了基础[27]。
JOSHI等[3]研究表明,基因在人类肾脏和脑中的表达量要高于肝脏和脾脏;杨娟娟[28]研究表明,基因在肉鸡的心脏、大脑、垂体、下丘脑、肾脏和腿肌等组织中有较高的表达量,但是有关基因在背最长肌组织中的表达情况却鲜有报道。本研究中,广灵驴基因在心脏、肝脏、脾脏、肺脏、肾脏和背最长肌中均有表达,但存在差异,在背最长肌中的表达最丰富,在肝脏中的表达量最低,推测基因与广灵驴的肌肉发育具有一定的相关性,这与杨娟娟[28]的结果并不冲突,表明基因在不同物种中的表达可能具有差异性。关于基因与广灵驴肌肉发育之间的关系以及其具体的功能尚不清楚,需要进一步深入研究。
[1] CITTERIO L,AZZANI T,DUGA S,et al.Genomic organization of the human γ adducin gene[J].Biochemical & Biophysical Research Communications,1999,266(1):110-114.
[2] MATSUOKA Y,LI X,BENNETT V.Adducin:structure,function and regulation[J].Cellular & Molecular Life Sciences,2000,57(6):884-895.
[3] JOSHI R,GILLIGAN D M,OTTO E,et al.Primary structure and domain organization of human alpha and beta adducin[J].The Journal of Cell Biology,1991,115(3):665-675.
[4] DONG L,CHAPLINE C,MOUSSEAU B,et al.35H,a sequence isolated as a protein kinase C binding protein,is a novel member of the adducin family[J].Journal of Biological Chemistry,1995,270(43):25534-25540.
[5] BENNETT V,BAINES A J.Spectrin and ankyrin-based pathways:metazoan inventions for integrating cells into tissues[J].Physiological Reviews,2001,81(3):1353-1392.
[6] MATSUOKA Y,HUGHES C A,BENNETT V.Adducin regulation[J]. Journal of Biological Chemistry,1996,271(41):25157-25166.
[7] HUGHES C A,BENNETT V.Adducin:a physical model with implications for function in assembly of spectrin- actin complexes[J].The Journal of Biological Chemistry,1995,270(32):18990-18996.
[8] GARDNER K,BENNETT V.Modulation of spectrin- actin assembly by erythrocyte adducin[J].Nature,1987,328:359-362.
[9] GARDNER K,BENNETT V.A new erythrocyte membrane-associated protein with calmodulin binding activity. Identification and purification[J].The Journal of Biological Chemistry,1986,261(3):1339-1348.
[10] LECHUGA S,AMIN P H,WOLEN A R,et al.Adducins inhibit lung cancer cell migration through mechanisms involving regulation of cell-matrix adhesion and cadherin-11 expression[J].Biochimica et Biophysica Acta Molecular Cell Research,2019,1866(3):395-408.
[11] CHAN P C,HSU R Y C,LIU C W,et al.Adducin-1 is essential for mitotic spindle assembly through its interaction with myosin-X[J].The Journal of Cell Biology,2014,204(1):19-28.
[12] NADYDENOV N G,IVANOV A I.Adducins regulate remodeling of apical junctions in human epithelial cells [J].Molecular Biology of the Cell,2010,21(20):3506-3517.
[13] CUSI D,BARLASSINA C,AZZANI T,et al. Polymorphisms of α-adducin and salt sensitivity in patients with essential hypertension[J].The Lancet,1997,349:1353-1357.
[14] TRIPODI G,VALTORTA F,TORIELLI L,et al. Hypertension-associated point mutations in the adducin alpha and beta subunits affect actin cytoskeleton and ion transport[J]. The Journal of Clinical Investigation,1996,97(12):2815-2822.
[15] GUPTA S,JHAWAT V,AGARWAL B K,et al.Alpha adducin() gene polymorphism and new onset of diabetes under the influence of selective antihypertensive therapy in essential hypertension[J].Current Hypertension Reviews,2019,15(2):123-134.
[16] HSU W H,WANG W J,LIN W Y,et al.Adducin-1 is essential for spindle pole integrity through its interaction with TPX2[J].EMBO Reports,2018,19(8):e45607.
[17] BRIEÑO-ENRÍQUEZ M A,MOAK S L,HOLLOWAY J K,et al.NIMA-related kinase 1(NEK1) regulates meiosis I spindle assembly by altering the balance between α-Adducin and Myosin X[J].PLoS One,2017,12(10):e0185780.
[18] GALLARDO G,BAROWSKI J,RAVITS J,et al.An α2- Na/K ATPase/α-adducin complex in astrocytes triggers non-cell autonomous neurodegeneration[J]. Nature Neuroscience,2014,17(12):1710-1719.
[19] 栾德琴.鸡肌肉生长相关基因的表达与肌苷酸关键酶基因网络调控的构建[D].扬州:扬州大学,2012. LUAN D Q.Analysis of gene expression profiles and construction of network for key genes associated with inosine monophosphate in chicken muscles[D]. Yangzhou,China:Yangzhou University,2012.
[20] HUANG Y Z,QIAN L N,WANG J,et al.Genetic variants ingene and their associations with growth traits in cattle[J].Animal Biotechnology,2019,30(1):7-12.
[21] 贾杏林,邹亚文,刘思远,等.猪附红细胞体基因的克隆与生物信息学分析[J].湖南农业大学学报(自然科学版),2016,42(5):524-527.JIA X L,ZOU Y W,LIU S Y,et al.Clone and bioinformatics analysis ofprotein gene of[J]. Journal of Hunan Agricultural University(Natural Sciences),2016,42(5):524-527.
[22] 郑海军,朱荣,葛春蕾,等.人白细胞介素-29的生物信息学分析[J].中国生物制品学杂志,2013,26(2):209-212. ZHENG H J,ZHU R,GE C L,et al.Bioinformatics of human interleukin-29[J].Chinese Journal of Biologicals,2013,26(2):209-212.
[23] FRANCO T,LOW P S.Erythrocyte adducin:a structural regulator of the red blood cell membrane[J].Transfusion Clinique et Biologique,2010,17(3):87-94.
[24] CHEN C L,LIN Y P,LAI Y C,et al.α-adducin translocates to the nucleus upon loss of cell-cell adhesions[J]. Traffic,2011,12(10):1327-1340.
[25] LIU C M,HSU W H,LIN W Y,et al.Adducin family proteins possess different nuclear export potentials[J]. Journal of Biomedical Science,2017,24(1):30.
[26] 王京兰,钱小红.磷酸化蛋白质分析技术在蛋白质组研究中的应用[J].分析化学,2005,33(7):1029-1035. WANG J L,QIAN X H.Analytical methods on phosphoproteins and their application in phosphopro- teomics[J]. Chinese Journal of Analytical Chemistry,2005,33(7):1029-1035.
[27] OHTSUBO K,MARTH J D.Glycosylation in cellular mechanisms of health and disease[J].Cell,2006,126(5):855-867.
[28] 杨娟娟.肉鸡和基因的遗传多态性及其组织表达谱分析[D].南京:南京农业大学,2011. YANG J J.Genetic polymorphisms and tissue expression profile ofandgenes in chicken[D]. Nanjing:Nanjing Agricultural University,2011.
Cloning, sequence analysis and tissue expression ofgene of Guangling donkey
LI Wufeng1, SUN Yutong1, ZHAO Jingwei1, LI Shujun2
(1.School of Life Sciences, Shanxi Agricultural University, Taigu, Shanxi 030801, China; 2.Fanshi County Animal Epidemic Prevention and Control Center, Fansi, Shanxi 034300, China)
The CDS region ofgene of Guangling donkey was cloned by RT-PCR method, and followed with sequence analysis. qRT-PCR was used to identify the relative expression level ofgene in heart, liver, spleen, lung, kidney and longissimus dorsi muscle. The results showed that the complete CDS sequence of Guangling donkeygene was 2 223 bp in length and could encode 740 amino acids. The sequence was submitted to NCBI with the login number MN_166472, and its nucleotide sequence had the highest homology with the horse nucleotide sequence, up to 99.6%. Bioinformatics prediction ADD1 protein had stable hydrophilic protein structure, theory of isoelectric point was 5.58, the secondary structure was mainly α-helix and random coils, and there was a Aldolase_Ⅱsuperfamily domain in the protein sequence. The protein had no signal peptide and transmembrane region, and was mainly located in the cell nucleus. There were 88 phosphorylation sites, 69 O-glycosylation sites and 3 N-glycosylation sites in the sequence. The results of real-time fluorescence quantitative detection showed thatgene was expressed in all studied 6 tissues, but there were differences in expression. The expression ofgene was the most abundant in longissimus dorsi muscle and the lowest in liver.
Guangling donkey;gene; cloning; bioinformatics analysis; differential expression
S822.2
A
1007-1032(2020)05-0733-09
李武峰,孙瑜彤,赵婧微,李树军.广灵驴基因的克隆和序列分析与组织表达[J].湖南农业大学学报(自然科学版),2020,46(6):733-741.
LI W F, SUN Y T, ZHAO J W, LI S J. Cloning, sequence analysis and tissue expression ofgene of Guangling donkey[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(6): 733-741.
http://xb.hunau.edu.cn

2019-10-24
2019-11-07
山西省重点研发计划(指南)项目(201803D421022)
李武峰(1967—),男,博士,副教授,主要从事动物遗传育种与繁殖研究,leewf1967@163.com
10.13331/j.cnki.jhau.2020.0 .015
责任编辑:邹慧玲
英文编辑:柳正
