基于SSR分子标记数据构建割手密核心种质库
2021-01-04徐超华刘新龙毛钧刘洪博林秀琴陆鑫苏火生
徐超华,刘新龙,毛钧,刘洪博,林秀琴,陆鑫*,苏火生*
基于SSR分子标记数据构建割手密核心种质库
徐超华1,2,刘新龙1,2,毛钧1,2,刘洪博1,2,林秀琴1,2,陆鑫1,2*,苏火生1,2*
(1.云南省农业科学院甘蔗研究所,云南 开远 661699;2.云南省甘蔗遗传改良重点实验室,云南 开远 661699)
以92份割手密初级核心种质为研究对象,利用SSR分子标记数据,依据Jaccard、SM和Nei & Li 3种遗传相似性系数逐步进行UPGMA聚类、多次抽样构建割手密核心种质库。结果显示:92份样本在15个SSR 位点上呈现出丰富的多态性,共获得331个多态性条带,平均多态性条带比例达100%;利用3种遗传相似性系数和随机取样共获得5个核心种质库;Shannon-Wiener多样性指数、总条带数和多态性条带数3个指标在核心种质库代表性检验中呈现出较高的检测效率,其他6个指标检测效率相对较低;5个核心库中依据SM遗传相似性系数逐步构建的核心种质库质量最优,该库由80份样本组成,Nei’s多样性指数和Shannon-Wiener多样性指数分别为0.984 1和4.259 8,在<0.05概率条件下与原库(分别为0.985 6和4.358 3)无显著差异,而且与原库的农艺性状均值差异百分率为0(<20.00%),极差符合率为99.16%(>80.00%)。研究认为,依据SM相似性系数,通过UPGMA聚类构建的80份割手密核心种质较好地代表了基础原始种质的分子水平和表型遗传多样性,可为后续割手密种质资源的精准鉴定、优异抗性基因发掘和种质资源杂交利用提供依据。
割手密;聚类;多样性指数;分子标记;核心种质
割手密(L.)即甘蔗细茎野生种,具有分蘖力强、抗性强等特点,分布于N18°15ʹ ~33°20ʹ、E97°~122°,涵盖中国广东、广西、云南、福建、海南和台湾等17个省份[1]。目前,现代甘蔗品种血缘主要来自热带种、割手密、印度种的种间杂交后代,尤其是印度割手密、爪哇割手密和崖城割手密的成功应用推动了世界甘蔗产业的发展[2-3]。中国是“甘蔗属复合群”中大部分资源的起源地和多样性中心,分布有大量甘蔗野生种质资源。自1995年建圃以来,国家甘蔗种质资源圃收集、保存了6个属15个种共3 000余份的甘蔗种质资源,位居世界第二。丰富的种质资源同时给资源保育工作者带来了巨大的工作量与挑战,如何从庞大的种质资源中迅速发掘优异资源,将中国的资源优势迅速转化为产业优势,对提高甘蔗良种选育效率具有重要意义。
自FRANKEL[4]首次提出核心种质的概念以来,国内外学者先后构建了水稻[5-6]、玉米[7]、小麦[8]、大豆[9]核心种质库,在甘蔗属及其近缘属核心库构建上也做了大量的前期研究。刘新龙等[10]以国家甘蔗种质资源圃保育的1 202份甘蔗杂交种为材料,依托表型性状,采用10%总体取样量、总体聚类分组和对数比例聚类,构建了161份初级核心种质。在此基础上,进一步使用SSR分子标记数据,依据Jaccard、SM和Dice 3种相似性系数,采用UPGMA逐步聚类法构建了107份甘蔗杂交品种核心种质。BALAKRISHNAN等[11]以印度坎纳诺尔甘蔗育种研究中心保育的713份热带种质为材料,基于27个质量性状和10个数量性状,构建了185份热带种(L.)核心种质库。在割手密种质构建方面,TAI等[12]以美国农业部佛州运河点甘蔗研究所保育的342份甘蔗细茎野生种质为材料,基于数量性状和环境因子的11种取样方法,构建了包含75份种质的甘蔗细茎野生种核心种质库。齐永文等[13]以海南甘蔗育种场保育的540份甘蔗细茎野生种质为材料,利用分子标记数据和表型性状,构建了包含60份种质的甘蔗细茎野生种核心库。
齐永文等[13]应用分子标记数据构建了甘蔗细茎野生种核心种质库,但分子标记数据主要用于探讨不同取样比例的确定和核心种质库质量的检测,未用于样本间聚类、等位变异数量等分析,未充分发挥分子标记数据的优势。近年来,国家甘蔗种质资源圃收集并保存了约600份割手密种质资源,极大地丰富了国家甘蔗种质资源。前期,苏火生等[14]以国家甘蔗种质资源圃保育的596份割手密种质为试验材料,依据27个表型性状,采用15%总体取样量,以茎径分组,按多样性比例构建了92份初级核心种质库。在此基础上,课题组进一步使用SSR分子标记数据,通过比较2种取样策略和3种遗传距离(Nei & Li、Jaccard、SM)相似系数,进一步缩减92份割手密初级核心库,结合农艺性状数据评价不同核心种质库的质量,以筛选出最优核心种质库,旨在为后续割手密种质资源的精准鉴定、优异抗性基因的发掘和种质资源的杂交利用提供依据。
1 材料与方法
1.1 材料
以前期苏火生等[14]构建的92份割手密初级核心种质为研究对象。92份割手密无性系均保育在云南省农业科学院甘蔗研究所国家甘蔗种质资源圃。
1.2 方法
1.2.1叶片基因组总DNA提取与PCR扩增
采用CTAB法[15]进行甘蔗幼叶基因组DNA的提取和纯化。依据前人[16-18]的研究方法,筛选出15对多态性较高的SSR引物,用于核心种质的遗传多样性研究。参照刘新龙等[10]的方法设计SSR反应体系和PCR扩增条件。参照刘新龙等[19]的银染方法快速银染。
1.2.2分子标记数据统计
在相同迁移位置上,利用人工读带的方式,统计扩增条带,无扩增条带记为“0”,有扩增条带记为“1”。利用NTSYSpc2.1,计算参试材料3种不同相似系数(Jaccard、SM和Nei & Li)。采用位点的基因型频率计算Nei’s遗传多样性(He)[20]和Shannon-Weier多样性指数()[21]。


式中,p为SSR标记第个基因位点的基因型频率。
1.2.3取样策略
根据相似性系数,应用NTSYSpc2.1软件对所有参试材料进行UPGMA系统聚类,参照HU等[22]、WANG等[23]提出的多次聚类最小距离取样方法构建核心种质。根据每次聚类结果,找出最相似的2个样本,剔除1份,剩余材料组成1个核心库,计算每次形成的核心库(新库)的Nei’s遗传多样性、Shannon-Weiner多样性指数,应用检验评价新库与原库之间的遗传多样性是否存在显著差异。当存在显著差异时,终止多次聚类取样,上一个新库为该相似性系数条件下取得的最佳核心种质库。为了确保所构建的核心种质具有最大的适用性,2个样本的选择依据以下4种原则:1)若样本来源地点特殊且保存数量很少,可以直接保留;2)若2个样本都具有抗性且抗性不同,保留抗性更优异的样本;3)若2个样本都具有抗性且抗性相同,保留具备较多等位基因数的样本;4)若2个样本遗传背景不清,保留具备较多等位基因数的样本。
为了比较3种核心种质库的质量,以相同样本数量的2个随机核心库为对照,应用4个分子标记指标(Nei’s遗传多样性、Shannon-Weiner多样性指数、总条带数和多态性条带数)和4个数量性状指标(极差符合率、变异系数符合率、均值差异百分率和方差差异百分率)综合评价核心库构建质量的好坏。其中,4个数量性状指标计算公式同文献[22]。在均值差异百分率小于20%,同时极差符合率大于80%的情况下,可以认为该核心库较好地代表了原始种质群体的遗传多样性水平[22]。
2 结果与分析
2.1 初级核心种质的遗传多样性
依据前人研究报道和云南省甘蔗遗传改良重点实验室研究结果[16-18],筛选出15对多态性较高的SSR引物,用于核心种质的遗传多样性研究。标记数据分析(表1)显示,15对SSR引物共获得331个扩增条带,平均每对SSR引物获得22.1个扩增条带,多态性条带比例为100%。其中,SMC278CS引物获得36个多态性扩增条带,SMC1047HA获得32个多态性扩增条带。15对SSR引物平均Nei’s遗传多样性指数为0.985 6,平均Shannon-Weiner多样性指数为4.358 3。说明割手密初级核心种质库在15个SSR位点上遗传多样性十分丰富。

表1 15对SSR引物在92份割手密初级核心种质间的多态性分析结果
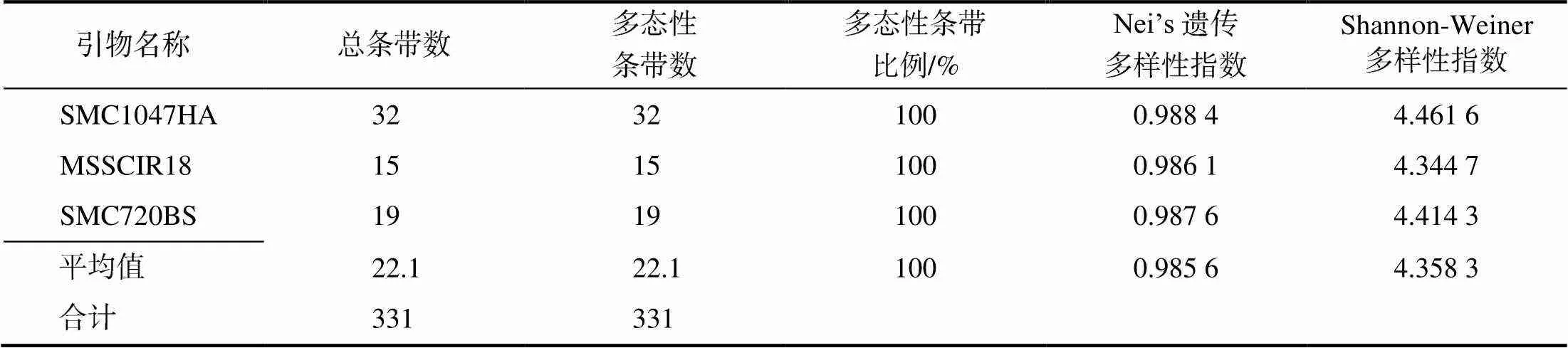
表1(续)
2.2 核心种质的取样策略
依据Jaccard、Nei & Li和SM 3种遗传相似性系数,采用UPGMA系统聚类法构建割手密核心种质库,随着剔除材料的逐渐增多,多次聚类取样建立的核心种质遗传多样性呈下降趋势。当样本剔除到第13个材料时,剩余的79份材料所组成的核心种质Nei’s遗传多样性指数与原库检验没有显著差异,但Shannon-Wiener多样性指数与原库呈显著差异;当剔除12份材料时,剩余80份材料形成的核心种质库与原库之间的Nei’s遗传多样性和Shannon-Wiener多样性指数均不存在显著差异,Jaccard、Nei & Li和SM 3种遗传相似性系数逐步聚类的结果基本一致。据此,可以认为剩余的80份材料构成的核心种质库为该相似性系数下最优核心库,分别编号为J-80、NL-80和SM-80。
2.3 核心种质的代表性检测
为比较依托3种遗传相似性系数构建的割手密核心种质库的质量,随机取样,构建编号为RS-80-1和RS-80-2的2个随机核心种质库。根据5个核心种质库与原库的检验结果(表2),5个核心库均与原库的Nei’s遗传多样性没有显著差异;随机核心种质库RS-80-1和RS-80-2的Shannon-Wiener多样性指数与原库在<0.05的概率水平下呈显著差异,核心种质库SM-80、J-80、NL-80与原库均无显著差异,说明随机核心种质库RS-80-1和RS-80-2不能完全代表原库的遗传多样性水平。

表2 核心种质库与原库多样性指数差值的t检验结果
“SM-66”示SM核心库与原库差异显著时样本的数量为66。“*”示在0.05水平差异显著。
从5个核心种质库保留的总条带数、多态性条带数(表3)来看,核心库SM-80保留了原库的全部条带数和多态性条带数,核心库J-80和NL-80丢失总条带和多态性条带各1个。根据不同核心库27个数量性状差异情况来看,5个核心种质库的均值差异百分率都为0,极差符合率为97.04%~100.00%,变异系数符合率为97.97%~103.45%,说明5个核心种质库与原库数量性状均没有太大的差异,即新构建的5个核心种质库较好地代表了原库的表型遗传多样性水平。

表3 不同核心种质库在总条带、多态性条带和农艺性状相关检测指标上的评价结果
Shannon-Wiener多样性指数、总条带数和多态性条带数3个指标能够有效地评价5个核心种质库的质量好坏。笔者最终从分子遗传多样性、保留的总条带数、保留的多态性条带数和表型性状差异情况,确定核心种质库SM-80作为最佳核心库。该库由80份材料组成(表4),占初级核心种质库的86.96%,占原始种质(596)的13.42%。SM-80核心种质Nei’s多样性指数和Shannon-Wiener多样性指数分别为0.984 1和4.259 8,在<0.05概率条件下与原库(分别为0.985 6和4.358 3)无显著差异,而且与原库的农艺性状均值差异百分率为0(<20.00%),极差符合率为99.16%(>80.00%)。以上数据综合表明,核心库SM-80较好地代表了原始种质群体的农艺性状水平。

表4 入选核心种质库的80种材料
3 结论与讨论
齐永文等[13]研究了SSR引物数量和种质鉴别能力间的关系,结果表明,当使用5对引物时,鉴别出的种质数量可达到所有种质的90%;当使用9对引物时,可鉴别出所有种质,说明9对引物已经能够鉴别所有种质。本研究中,15对SSR引物产生331个多态性条带,平均每对引物产生22.1个条带;而齐永文等[13]应用20对SSR引物产生454个多态性条带,平均每对引物产生22.7个条带。2个研究中,平均每对引物产生的条带数相差不大,间接证明15对SSR引物多态性丰富。总的多态性条带数(331)仅为齐永文等[13]的72.9%,说明在核心库构建过程中,SSR引物数量越多,更能够准确反映群体的遗传多样性,建议在以后的核心库构建过程中要保证足够的SSR引物数量。
董玉琛等[24]认为核心库构建可以分2步:首先依托表型数据(数量性状和质量性状)构建初级核心种质库;在此基础上,利用分子标记数据进行DNA水平的遗传冗余压缩,从而筛选到既在分子层面又在表型层面具有代表性的核心种质库,此方法在甘蔗[10]、大豆[25]、柿子[26]等植物上得到了应用。本研究以国家甘蔗种质资源圃保育的596份割手密为原始种质群体,基于表型和SSR分子标记数据,构建了割手密初级核心种质92份(占总资源的15.4%)和核心种质80份(占总资源的13.4%),并应用4个分子标记指标和4个数量性状指标进行验证。结果表明,依托SM遗传相似系数构建的核心库质量最优,在<0.05概率条件下,SM-80的多样性指数与原库的无显著差异,与原库的农艺性状均值差异百分率为0(<20.00%),极差符合率为99.16%(>80.00%),说明SM-80对原库表型性状和分子遗传多样性都具有较好的代表性。该库由80 份割手密无性系组成,占原初级核心种质库的86.9%,占原始种质群体(=596)的13.4%。2个随机核心种质库,虽然在表型水平对原库具有较好的代表性,但在分子水平上,Shannon-Wiener多样性指数与原库存在显著差异,而依据SM遗传相似性系数构建的核心种质库在表型和分子水平的遗传多样性都具有较好的代表性。可见,依据相似性系数构建的核心种质库质量要优于同等数量的随机核心种质库。
综上所述,本研究构建的割手密核心种质数量少且较好地代表了596份原始种质群体的遗传多样性水平,有利于针对性地开展鉴定评价,大幅缩短工作时间和节省工作量,为后续割手密种质资源的精准鉴定、优异抗性基因发掘和种质资源杂交利用提供依据。
[1] CHANG D,YANG F Y,YAN J J,et al.SRAP analysis of genetic diversity of nine native populations of wild sugarcane,,from Sichuan,China[J].Genetics and Molecular Research,2012,11(2):1245-1253.
[2] BERDING N,ROACH B T.Germplasm collection,maintenance,and use[M]//Developments in Crop Science.Amsterdam:Elsevier,1987:143-210.
[3] HENRY R J,KOLE C.Genetics,Genomics and Breeding of Sugarcane[M].Boca Raton:CRC Press,2010.
[4] FRANKEL O H.Genetic perspectives of germplasm conservation[M].Cambridge:Cambridge University Press,1984.
[5] 魏兴华,汤圣祥,余汉勇,等.中国粳稻地方种资源核心样品的构建方法研究[J].中国水稻科学,2000,14(4):237-240. WEI X H,TANG S X,YU H Y,et al.Studies on methods of developing a core collection for China traditional japonica rice germplasm[J].Chinese Journal of Rice Science,2000,14(4):237-240.
[6] 李自超,张洪亮,曹永生,等.中国地方稻种资源初级核心种质取样策略研究[J].作物学报,2003,29(1):20-24. LI Z C,ZHANG H L,CAO Y S,et al.Studies on the sampling strategy for primary core collection of Chinese ingenious rice[J].Acta Agronomica Sinica,2003,29(1):20-24.
[7] LI Y,SHI Y S,CAO Y S,et al.Establishment of a core collection for maize germplasm preserved in Chinese national genebank using geographic distribution and characterization data[J].Genetic Resources and Crop Evolution,2005,51(8):845-852.
[8] 郝晨阳,董玉琛,王兰芬,等.我国普通小麦核心种质的构建及遗传多样性分析[J].科学通报,2008,53(8):908-915. HAO C Y,DONG Y C,WANG L F,et al.Genetic diversity and construction of core collection in Chinese wheat genetic resources[J].Chinese Science Bulletin,2008,53(8):908-915.
[9] 邱丽娟,曹永生,常汝镇,等.中国大豆()核心种质构建I.取样方法研究[J].中国农业科学,2003,36(12):1442-1449. QIU L J,CAO Y S,CHANG R Z,et al.Establishment of Chinese soybean () core collection I.sampling strategy[J].Scientia Agricultura Sinica,2003,36(12):1442-1449.
[10] 刘新龙,刘洪博,马丽,等.利用分子标记数据逐步聚类取样构建甘蔗杂交品种核心种质库[J].作物学报,2014,40(11):1885-1894. LIU X L,LIU H B,MA L,et al.Construction of sugarcane hybrids core collection by using stepwise clus-tering sampling approach with molecular marker data[J]. Acta Agronomica Sinica,2014,40(11):1885-1894.
[11] BALAKRISHNAN R,NAIR N V,SREENIVASAN T V. A method for establishing a core collection ofL. germplasm based on quantitative- morphological data[J]. Genetic Resources and Crop Evolution,2000,47(1): 1-9.
[12] TAI P Y P,MILLER J D.A core collection forL.from the world collection of sugarcane[J]. Crop Science,2001,41(3):879-885.
[13] 齐永文,樊丽娜,罗青文,等.甘蔗细茎野生种核心种质构建[J].作物学报,2013,39(4):649-656. QI Y W,FAN L N,LUO Q W,et al.Establishment ofL.core collections[J].Acta Agronomica Sinica,2013,39(4):649-656.
[14] 苏火生,刘新龙,毛钧,等.割手密初级核心种质取样策略研究[J].湖南农业大学学报(自然科学版),2011,37(3):253-259.SU H S,LIU X L,MAO J,et al.Sampling strategy of pre- core collection for[J]. Journal of Hunan Agricultural University (Natural Sciences),2011,37(3):253-259.
[15] 蔡青,范源洪,AITKEN K,等.利用AFLP进行“甘蔗属复合体”系统演化和亲缘关系研究[J].作物学报,2005,31(5):551-559. CAI Q,FAN Y H,AITKEN K,et al.Assessment of the phylogenetic relationships within the “complex” using AFLP markers[J].Acta Agronomica Sinica,2005,31(5):551-559.
[16] AITKEN K S,JACKSON P A,MCINTYRE C L.A combination of AFLP and SSR markers provides extensive map coverage and identification of homo(eo) logous linkage groups in a sugarcane cultivar[J]. Theoretical and Applied Genetics,2005,110(5):789-801.
[17] PAN Y B. Highly polymorphic microsatellite DNA markers for sugarcane germplasm evaluation and variety identity testing[J]. Sugar Tech,2006,8(4): 246-256.
[18] 刘新龙,毛钧,陆鑫,等.甘蔗SSR和AFLP分子遗传连锁图谱构建[J].作物学报,2010,36(1):177-183. LIU X L,MAO J,LU X,et al.Construction of molecular genetic linkage map of sugarcane based on SSR and AFLP markers[J].Acta Agronomica Sinica,2010,36(1):177-183.
[19] 刘新龙,蔡青,毕燕,等.甘蔗AFLP标记和SSR标记的PAGE胶快速银染检测方法[J].江苏农业学报,2009,25(2):433-435. LIU X L,CAI Q,BI Y,et al.A rapid silver staining method for PAGE used in sugarcane AFLP and SSR molecular markers[J].Jiangsu Journal of Agricultural Sciences,2009,25(2):433-435.
[20] NEI M.Analysis of gene diversity in subdivided populations[J].Proceedings of the National Academy of Sciences of the United States of America,1973,70(12):3321-3323.
[21] PEET R K.The measurement of species diversity[J]. Annual Review of Ecology and Systematics,1974,5(1):285-307.
[22] HU J,ZHU J,XU H M.Methods of constructing core collections by stepwise clustering with three sampling strategies based on the genotypic values of crops[J]. Theoretical and Applied Genetics,2000,101(1/2):264-268.
[23] WANG J C,HU J,XU H M,et al.A strategy on constructing core collections by least distance stepwise sampling[J].Theoretical and Applied Genetics,2007,115(1):1-8.
[24] 董玉琛,曹永生,张学勇,等.中国普通小麦初选核心种质的产生[J].植物遗传资源学报,2003,4(1):1-8. DONG Y C,CAO Y S,ZHANG X Y,et al. Establishment of candidate core collections in Chinese common wheat germplasm[J].Journal of Plant Genetic Resources,2003,4(1):1-8.
[25] 王丽侠,李英慧,李伟,等.长江春大豆核心种质构建及分析[J].生物多样性,2004,12(6):578-585. WANG L X,LI Y H,LI W,et al.Establishment of a core collection of Changjiang spring sowing soybean[J]. Biodiversity Science,2004,12(6):578-585.
[26] ZHANG Y F,ZHANG Q L,YANG Y,et al. Development of Japanese persimmon core collection by genetic distance sampling based on SSR markers[J]. Biotechnology & Biotechnological Equipment,2009,23(4):1474-1478.
Construction of a core-collection ofbased on SSR molecular markers
XU Chaohua1,2, LIU Xinlong1,2, MAO Jun1,2, LIU Hongbo1,2, LIN Xiuqin1,2, LU Xin1,2*, SU Huosheng1,2*
(1.Sugarcane Research Institute, Yunnan Academy of Agricultural Sciences, Kaiyuan, Yunnan 661699, China; 2.Yunnan Key Laboratory of Sugarcane Genetic Improvement, Kaiyuan, Yunnan 661699, China)
A stepwise UPGMA cluster sampling approach with three different genetic similarity coefficients(Jaccard, SM, and Nei & Li) was applied to a SSR molecular data of 92-genotype primary core collection. Results showed that 92 genotypes possessed abundant genetic diversity at 15 SSR loci, which produced 331 polymorphic bands in amplification, constituting a mean of 100% of total bands. The genetic similarity coefficients were constructed with three approaches and two random samplings, which produced five putative core collections. To evaluate the quality of putative core collections, three indices, Shannon-Wiener diversity index, polymorphic band number and percentage of polymorphic bands, using core collections had the highest identification efficiency, while others were less efficient. The putative core collection constructed using SM genetic similarity coefficient had higher quality than others. The putative core collection consisted of 80genotypes shaving a 0.984 1 Nei’s diversity index and 4.259 8 Shannon-Wiener diversity index, and did not differ significantly(<0.05) in molecular diversity from the primary core. Further, MD was 0%(<20.00%) and CR 99.16%(>80.00%).The putative core collection of 80genotypes based on SM genetic similarity coefficient did not differ significantly from the genetic diversity of the primary core regarding to the agronomic traits or molecular markers. The putative core will facilitate the evaluation and utilization of the germplasm in developing elite sugarcane hybrids, and mining elite genes.
; clustering; diversity index; molecular marker; core collection
S566.102.4
A
1007-1032(2020)06-0657-07
徐超华,刘新龙,毛钧,刘洪博,林秀琴,陆鑫,苏火生.基于SSR分子标记数据构建割手密核心种质库[J].湖南农业大学学报(自然科学版),2020,46(6):657-663.
XU C H, LIU X L, MAO J, LIU H B, LIN X Q, LU X, SU H S. Construction of a core-collection ofbased on SSR molecular markers[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(6): 657-663.
http://xb.hunau.edu.cn

2019-11-28
2019-12-19
云南省农业基础研究联合专项(2018FG001-017);国家农作物种质资源共享服务平台项目(NICGR-2019-44);农业农村部政府购买服务项目(19190167)
徐超华(1986—),男,湖北洪湖人,硕士,助理研究员,主要从事甘蔗种质资源的研究与利用,xuchaohua_0435@sina.com;*通信作者,陆鑫,硕士,副研究员,主要从事甘蔗种质资源的研究与利用,xinlu_ky@126.com;*通信作者,苏火生,硕士,副研究员,主要从事甘蔗种质资源的研究与利用,shs304@163.com
10.13331/j.cnki.jhau.2020.06.004
责任编辑:毛友纯
英文编辑:柳正
