玉米大斑病菌Septin基因家族的鉴定与表达模式分析
2021-01-04龙凤王擎朱行王建霞申珅刘宁郝志敏董金皋
龙凤,王擎,朱行,王建霞,申珅,刘宁,郝志敏,董金皋,2
玉米大斑病菌基因家族的鉴定与表达模式分析
龙凤1,王擎1,朱行1,王建霞1,申珅1,刘宁1,郝志敏1,董金皋1,2
(1河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室,河北保定 071001;2河北农业大学植物保护学院,河北保定 071001)
隔膜蛋白Septin广泛存在于除植物以外所有真核生物中,是高度保守的GTP结合蛋白家族,被认为是继微管、微丝和中间纤维之后的第4种细胞骨架蛋白。病原真菌的Septin蛋白参与细胞极性的确定、形态塑造及与致病相关的形态转换。【】鉴定玉米大斑病菌()基因家族,并进一步分析其在不同发育时期的表达模式,为明确隔膜蛋白Septin与真菌侵染结构发育之间的关系打下基础。以玉米小斑病菌()中6个Septin蛋白的氨基酸序列为探针,在玉米大斑病菌数据库在线Blastp比对和关键词搜索,获得大斑病菌的候选,对其基因结构、理化性质以及跨膜区结构等方面进行生物信息学分析。收集人造疏水介质诱导下侵染结构发育不同时期以及侵染感病寄主叶片不同时间的玉米大斑病菌材料,利用实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)技术系统分析基因家族在玉米大斑病菌侵染结构形成不同阶段的转录水平。获得了玉米大斑病菌6个候选,其中4个核心,均含有G1、G3、G4基序,分别将其命名为、、、。在人造疏水介质诱导下,表达水平均呈上升趋势。在芽管形成后期表达最活跃,其表达量达到分生孢子时期的25.69倍(<0.01),的表达水平在附着胞发育后期到达高峰,随后表达逐渐下调。该基因家族在病菌侵染寄主叶片过程中的转录水平变化趋势与其在人造疏水介质诱导下的表现趋于一致。在接种后6 h转录水平极显著上调(<0.01),随着时间延长,表达水平下降,在附着胞形成阶段表达活跃,表达量在接种后18 h达到高峰值,之后表达下调,但仍高于萌发初期。、在接种后18 h和24 h表达活跃,高于萌发初期。玉米大斑病菌基因组中含有4个核心,和分别在芽管和附着胞形成时期活跃表达,结果可为进一步明确 Septin的功能及玉米大斑病菌的侵染调控机制提供依据。
玉米大斑病菌;基因家族;实时荧光定量PCR;基因表达
0 引言
【研究意义】玉米大斑病是严重威胁玉米安全生产的真菌性病害之一[1],其病原玉米大斑病菌()主要侵害玉米叶片、叶鞘和苞叶,以叶片受害最重,严重影响玉米的产量和质量。但由于该病菌具有明显的生理分化现象,且变异频繁,使主要依赖抗病品种的病害防控工作面临极大威胁,因此,充分解析病原菌致病性的调控机制将成为寻找病害防控新策略的重要突破口[2]。【前人研究进展】隔膜蛋白Septin广泛存在于除植物以外所有真核生物中,是高度保守的GTP结合蛋白家族[3],Septin被认为是继微管、微丝和中间纤维之后的第4种细胞骨架蛋白[4]。迄今为止,已鉴定了酿酒酵母()中基因家族具有7个成员,其中5个(、、、和)在有丝分裂期间表达并参与胞质分裂,在芽颈处形成环形结构[5]。它们参与芽位置的选择、有丝分裂纺锤体的定位、极化生长和胞质分裂[6],而和是孢子形成时期所特有的[7]。值得注意的是,Septin环结构是伴随细胞周期的发生而出现的,只有在G2/M转变期子芽形成到细胞分裂结束时,Septin环结构才能被检测到,在其他时期,Septin以一种无序状态存在,在细胞中很难被检测到[8-9]。Septin以蛋白复合体的形式参与Septin环的构建,任何主要的基因、、或的突变都会阻止Septin环的发育,从而导致有丝分裂延迟和芽伸长[10]。动植物真菌病原体存在酿酒酵母中未发现的Septin形式,并在动力学和功能上表现出复杂性,使真菌病原体成为揭示Septin行为多样性的重要模型。稻瘟病菌()中,位于附着胞孔内环形的F-肌动蛋白网络由4个Septin鸟苷三磷酸酶(Sep3、Sep4、Sep5和Sep6)组装,并聚合成一个动态的异寡聚环,从而支撑F-肌动蛋白形成细胞骨架,以形成侵入钉破坏叶片表面[11-12]。因此,Septin对依赖附着胞侵染寄主的病原微生物至关重要。在大多数病原真菌中,的缺失导致极性生长的增加和毒力的降低。在构巢曲霉()中,Δ突变体形成多个异常、发育不良的菌丝分支以及多个胚芽管,而野生型菌株只形成一个胚芽管[13]。在灰葡萄孢()中,Δ突变体芽管增长,不能形成附着胞和侵染垫,致病力完全丧失[14]。在棉阿舒囊霉()中,或缺失菌株其菌丝具有额外极性生长一个弯曲菌丝[15]。Septin蛋白以细胞周期蛋白/Cdk依赖性方式直接控制菌丝形态发生,在白色念珠菌()中,Cdk Cdc28通过调控细胞周期蛋白Ccn1和Hgc1,从而快速建立并维持细胞骨架蛋白Cdc11的磷酸化,以促进菌丝发育,这些磷酸化位点的诱变会导致异常的菌丝形态[16],其中Δ和Δ突变体与野生型白色念珠菌相比,其生长速度正常但产生弯曲菌丝的频率更高,细胞壁沉积的轻微不一致,并且在感染小鼠模型中毒力减弱[17-18]。【本研究切入点】大量研究表明,Septin蛋白缺失严重影响对宿主的致病力,特定Septin蛋白的功能丧失伴随的后果在不同物种间有较大差异。目前,对于玉米大斑病菌Septin蛋白功能,尤其是在病菌侵染结构发育过程中发挥的作用尚未进行过系统研究。【拟解决的关键问题】利用生物信息学手段明确玉米大斑病菌家族的组成,及其成员基因和编码产物的结构特征、理化性质;分别将病原菌接种于人造疏水介质及感病寄主叶片,检测家族各基因的表达水平,揭示在病菌侵染结构发育过程中的表达模式,为深入阐明家族不同成员在病菌致病过程中的功能打下基础。
1 材料与方法
试验于2019年在河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室完成。
1.1 供试菌株及寄主
玉米大斑病菌野生型菌株01-23和玉米品种B73自交系均由河北农业大学真菌毒素与植物分子病理学实验室保存。
1.2 主要培养基及试剂
PDA培养基、1.2% Agar培养基,RNA提取Trizol试剂盒购于北京索莱宝科技有限公司。Prime Script ® RT reagent Kit试剂盒购自TaKaRa(大连)公司,UEIrisII RT-PCR system for First-Strand cDNASynthesis(with dsDNase)反转录试剂盒和Super EvaGreen® qPCR Master Mix试剂盒购自US Everbright® Inc(江苏),引物在生工生物工程(上海)股份有限公司合成。
1.3 病菌样本收集
采用气生菌丝涂断法收集在PDA培养基上25℃培养13 d的玉米大斑病菌分生孢子,配制浓度为20个/μL的玉米大斑病菌孢子悬浮液,用移液枪吸取2 mL孢子悬浮液点在铺有玻璃纸的水琼脂平板上,25℃保湿孵育,诱导分生孢子萌发。参考申珅等的方法分别于接种后6 h(分生孢子萌发形成芽管)、12 h(芽管末端膨大形成附着胞)、24 h(附着胞基部产生纤细的侵入钉)[19-20]收集菌体材料,湿重约0.5 g,分别提取其RNA。将相同浓度的玉米大斑病菌孢子悬浮液接种于感病寄主B73玉米叶片表面,于接种后1 h(分生孢子萌发早期)、6 h(芽管形成后期)、12 h(附着孢发育早期)、18 h(附着孢形成后期)、24 h(侵入钉形成后期)从叶片上收集病菌材料[19-20],置于50 mL管中,分别提取其RNA。
1.4 RNA的提取
参考申珅等的方法用Trizol试剂盒分别提取人造疏水介质诱导下玉米大斑病菌不同发育阶段菌体和接种感病寄主叶片不同时间后菌体的总RNA[19-20],采用UEIrisII RT-PCR system for First-Strand cDNA Synthesis(with dsDNase)反转录试剂盒合成cDNA,用于RT-qPCR检测的转录水平。所有试验均设3次生物学重复。
1.5 Septin基因及编码产物的生物信息学分析
利用MEGA7.0软件邻接法对已报道的其他真菌物种的Septin序列与玉米大斑病菌Septin序列进行多重序列比对,构建系统发育树,重复次数设置为1 000。
利用GSDS2.0(http://gsds.cbi.pku.edu.cn/)分析家族的基因结构[21]。ProtParam(https://web. expasy.org/protparam/)分析Septin蛋白的理化性质[19]。NCBI-CDD(conserved domain database)数据库和SMART数据库在线分析Septin保守结构域。Psipred4.0(http://bioinf.cs.ucl.ac.uk/psipred/)预测Septin的蛋白二级结构。通过ProtCompv9.0(http://linux1.softberry. com/berry.phtml?group=programs&subgroup=proloc&topic=protcomppl)在线预测Septin亚细胞定位[22]。通过Singal IP3.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽[22],利用THMM Server v2.0(http://www. cbs.dtu.dk/services/TMHMM/)在线预测Septin蛋白跨膜区结构。
1.6 Septin表达水平的RT-qRCR分析
利用Primer 5设计各基因特异性引物(表1),以为内参基因,以各时期cDNA为模板,Super EvaGreen® qPCR Master Mix试剂盒进行RT-qPCR扩增,采用美国Bio-Rad CFX96 TouchTM型荧光定量PCR系统进行试验(表2)。
RT-qPCR程序:95℃ 3 min;95℃ 15 s,60℃ 60 s(收集荧光),45个循环;每个样品均设3个生物学重复。以分生孢子时期的基因表达水平为对照,采用基因相对表达量分析方法2-ΔΔCt和Origin软件,对试验数据进行差异显著性分析,GraphPad Prism6绘制图表。
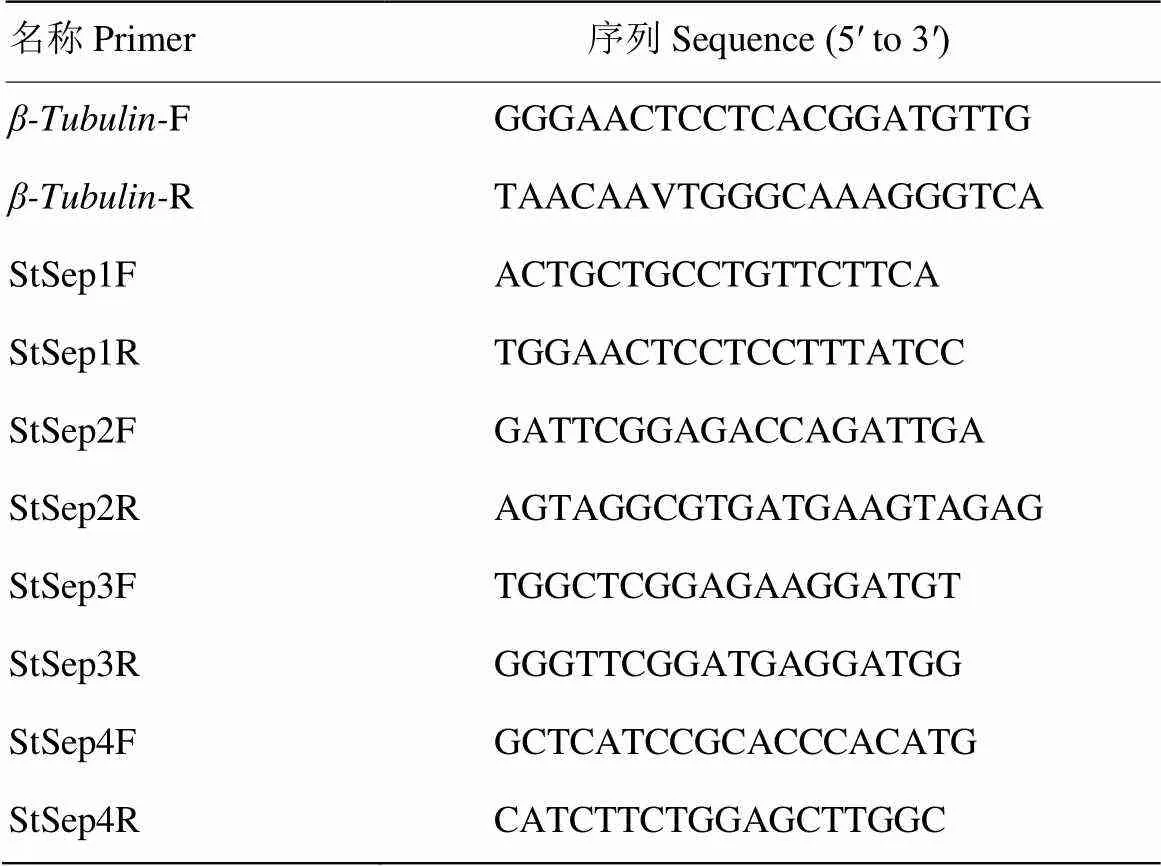
表1 RT-qPCR试验所用引物
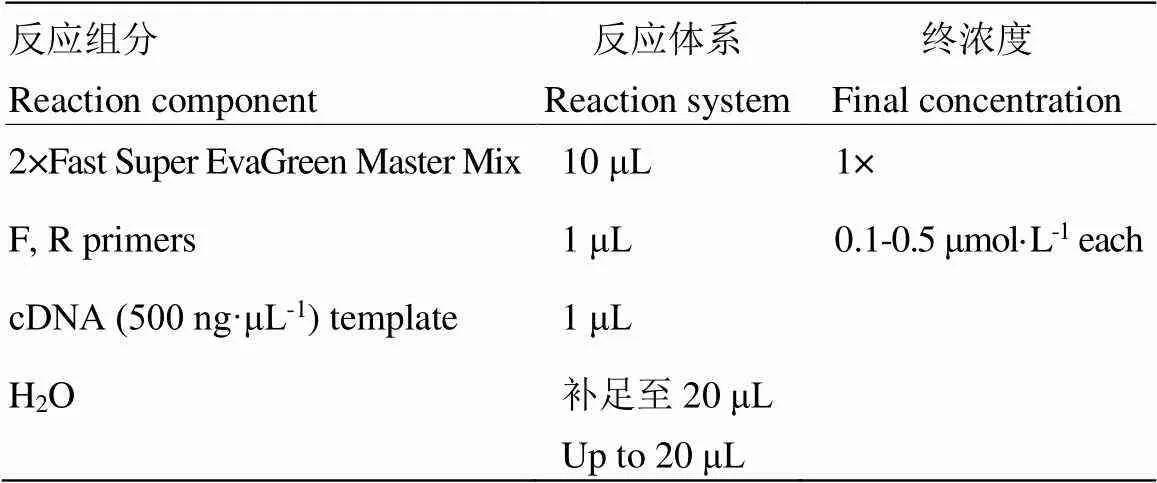
表2 RT-qPCR反应体系
2 结果
2.1 玉米大斑病菌候选Septin的获取
以玉米小斑病菌()中的6个Septin(ChCdc3、ChCdc10、ChCdc11、ChCdc12、ChCdc100和ChCdc100)的氨基酸序列为探针,对玉米大斑病菌数据库(https://mycocosm.jgi.doe.gov/ pages/search-for-genes.jsf?organism=Settu3)在线Blastp比对,获得玉米大斑病菌基因组中6个候选(表3)。6个基因随机分布于基因组中,不存在连锁关系。基因中分别包含2—6个外显子(图1)。
2.2 Septin的系统进化分析
不同植物病原真菌Septin同源基因在氨基酸水平上呈现高度的相似性,系统发育树分成两个大的进化支,玉米大斑病菌的StSep1、StSep2、StSep3、StSep4与不同病原真菌的核心Septin(Cdc3、Cdc10、Cdc11和Cdc12)聚于同一进化支,而StSep5、StSep6分别与玉米小斑病菌的Septin同源,构成另一个进化支(图2)。玉米大斑病菌中没有与酿酒酵母SPR3、SHS1、SPR28同源的Septin。
表3 玉米大斑病菌Septin的信息

图1 玉米大斑病菌Septin基因结构

图2 Septin的系统发育分析
2.3 Septin的结构特征分析
NCBI-CDD(conserved domain database)数据库在线比对结果表明,StSep1、StSep2、StSep3、StSep4为CDC/Septin GTPase家族成员,StSep5、StSep6主要为P-loop-NTPase域的成员,用于结合核苷酸的-磷酸部分(通常为ATP或GTP)和Mg2+。通过DNAMAN对4个候选Septin的氨基酸序列进一步进行比对分析,结果表明,候选Septin均具有GTP-CDC结合域(G1、G3、G4 motif)[22],构成保守序列PFAxvGs特征的3个残基vGs已映射到保守域CDC-Septin上的G5 motif。PAN等[23]使用Weblogo程序分析Septin基序发现序列WgxEV、YexYR中的ExxxxR和基序WG中度保守。在G3 motif与G4 motif之间的氨基酸序列FIxPtGHxL和在G4 motif的氨基酸序列ExDD[22],尚无功能注释(图3),这些保守结构域在希金斯炭疽菌()的Septin中也存在,但具体的生物学功能,有待今后进一步的探究与解析。
2.4 核心Septin的生物信息学分析
2.4.1 理化性质 总体而言,相对分子质量最大的是StSep4,相对分子质量最小的是StSep1。StSep1的PI为7.20,属于中性蛋白质;StSep2、StSep4的PI分别为5.07、6.56,属于酸性蛋白质;StSep3的PI为8.54,属于碱性蛋白质(表4)。4个Septin的脂肪族氨基酸指数范围为78.87—86.53,总平均亲水性均为负值,因此玉米大斑病菌中的4个核心Septin均属于亲水性蛋白。
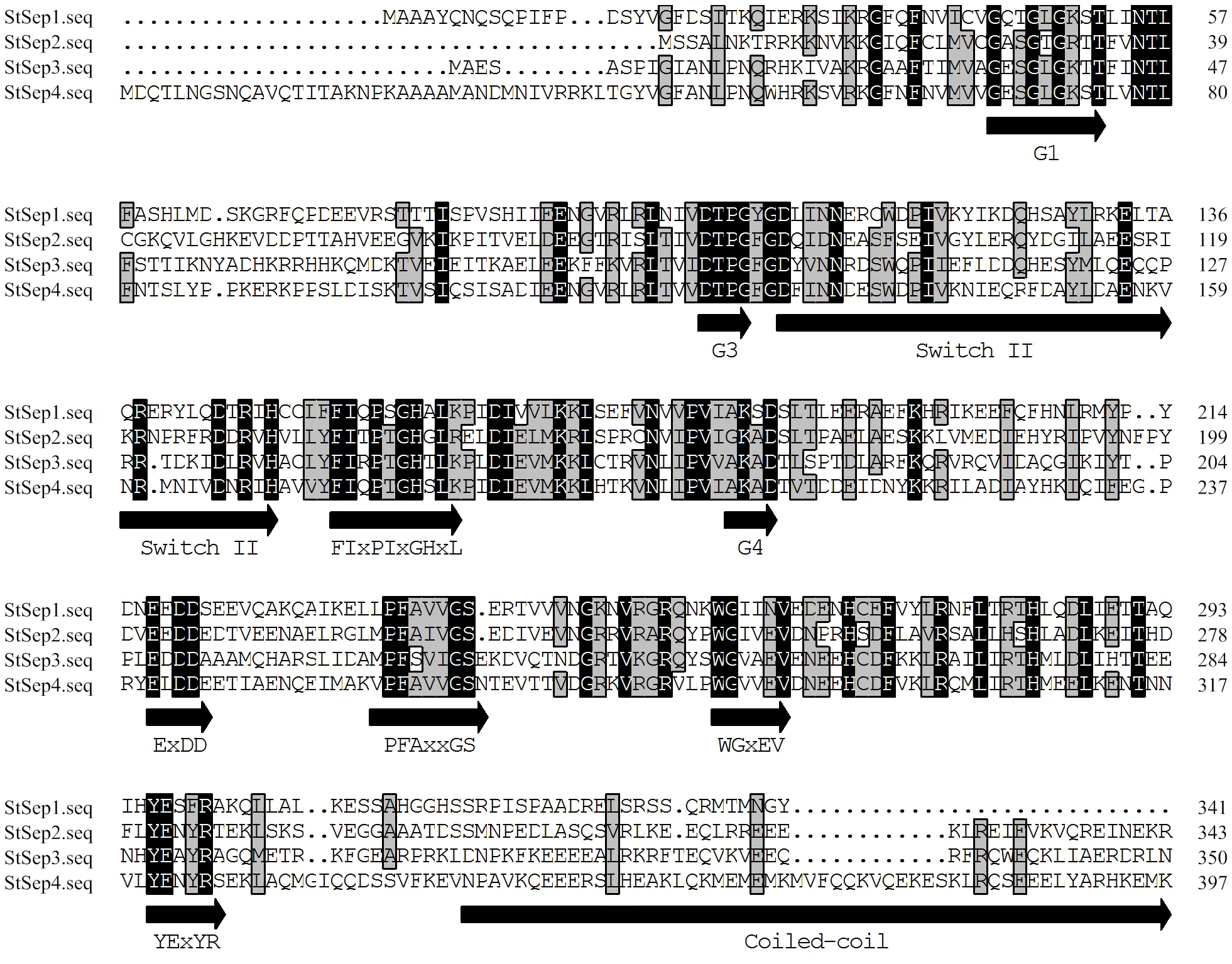
图3 Septin的保守结构域分析
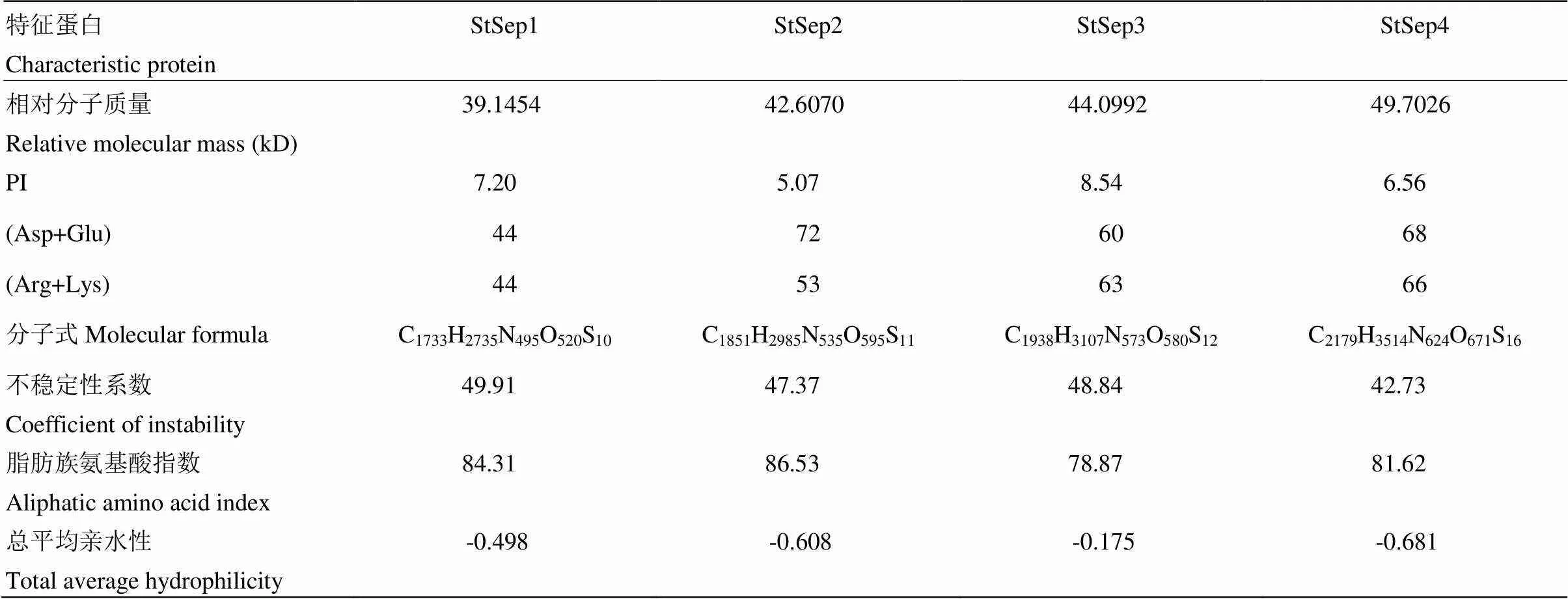
表4 Septin的基本理化性质
2.4.2 二级结构 Septin二级结构由折叠、螺旋、转角以及无规则卷曲4种结构组成,以Stsep1所含折叠比例最高,为15.84%;StSep3所含无规则卷曲的比例最高,为49.87%;StSep4所含螺旋的比例最高为51.16%(图4)。
2.4.3 亚细胞定位、跨膜区结构预测和信号肽预测Septin均定位于细胞质中,无跨膜区结构,不具有信号肽位点,为非分泌蛋白。
2.5 Septin表达模式分析
以人造疏水介质为诱导,模拟病菌侵染结构的发育过程,以分生孢子时期的基因表达水平为对照。在芽管形成后期表达活跃(<0.01),其表达量是分生孢子时期的25.69倍,在附着胞形成后期活跃表达(<0.01),其表达量是分生孢子时期的15.22倍,随后侵入钉形成,表达水平下调,但其表达量仍高于分生孢子时期。、随诱导时间延长,表达水平持续上调,在侵染丝时期其表达量分别达到分生孢子时期的6.21和7.32倍。由此推测可能主要参与病菌孢子萌发过程,、可能主要参与病菌侵染结构形成过程,而可能主要在病菌的附着胞发育及侵染丝的形成中发挥调控作用。
分析基因家族在病菌侵染感病寄主叶片过程中的转录水平,以接种初期1 h的基因表达水平为对照。结果表明,和的转录水平均呈现先上调后下调的变化趋势。在接种后6 h转录水平极显著上调(<0.01),随后迅速下降,至接种后18 h和24 h基本下调至与起始阶段相当的水平,在附着胞形成阶段表达活跃,随着时间延长,继续上调至18 h达到高峰,之后表达量下调,至24 h后仍高于萌发初期。、在接种后18 h和24 h表达活跃,表达量略有上调,无显著性差异。
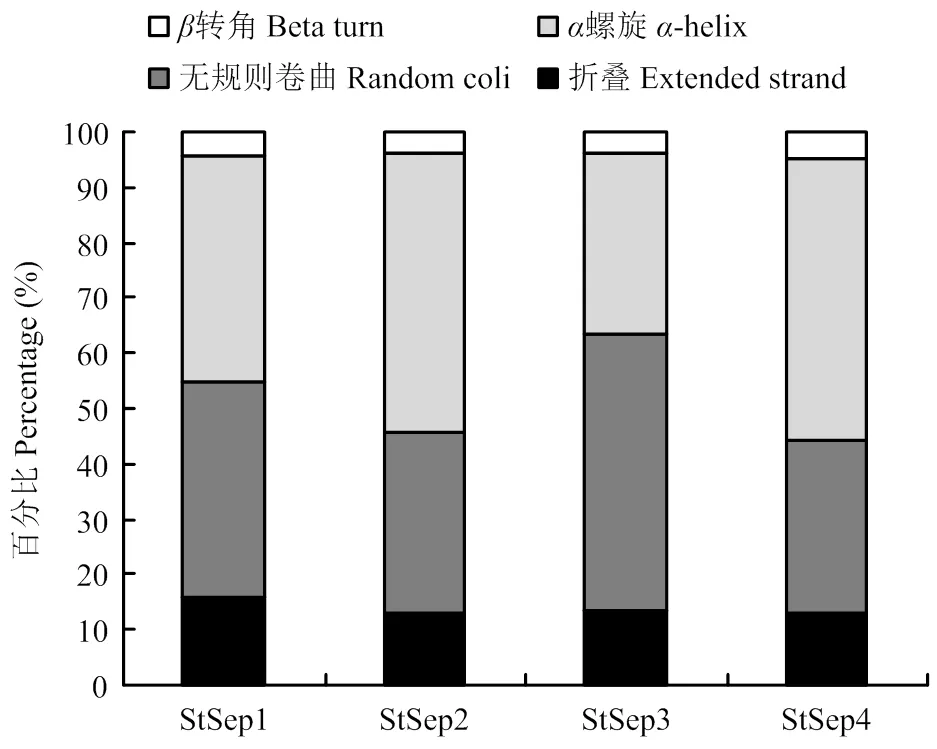
图4 玉米大斑病菌Septin的二级结构特征

A:疏水介质诱导下玉米大斑病菌不同发育时期的表达量 Expression at different developmental stages induced on hydrophobic medium;B:接种后不同时间的表达量 Expression in different times after inoculation of maize leaves。*:0.01<P<0.05;**:P<0.01
3 讨论
20世纪80年代末,由HARTWELL首次在酿酒酵母的胞质分裂缺陷(CDC)突变体中发现Septin,最近在绿藻、褐藻及纤毛虫中也发现了Septin,而在高等绿色植物中尚未发现Septin的存在[24]。在对Septin系统发育和进化起源的研究中发现,Septin家族在进化上相对保守,各家族成员之间其N端和C端稍有不同,位于中央的鸟苷三磷酸(GTP)结合结构域和多碱性氨基酸结构域都是高度保守的[9,25]。大量研究表明,Septin是从酵母到人类高度保守的真核细胞骨架蛋白家族,所有真菌均具有4种核心Septin:Cdc3、Cdc10、Cdc11及Cdc12[14]。在哺乳动物中Septin家族有很多变异剪接本,翻译后修饰保守性差,使得该家族基因功能更为复杂。
相对于其他细胞骨架GTP酶、真核生物的Tubulin蛋白及细菌中的FtsZ蛋白,Septin家族的这些保守序列与Ras家族更为相近[26]。典型Septin具有以下结构特征:(1)所编码的蛋白质分子量约30—65 kD;(2)包含GTP酶域所特有的3个保守序列:G1、G3、G4基序(motif)。Septin蛋白G1基序(Gxxxx GK[S/T])高度保守,G3基序(Dxx G)中度保守,其共有序列为DTPG,G4基序(xKxD)严谨保守[27];(3)N端为多元区域,C端为螺旋卷曲结构,这一结构被认为可能与Septin家族成员的同源与异源聚合有关[28]。不同亚型的Septin可聚合形成隔膜丝,隔膜丝进一步可形成纤维束、环状、网格状、笼状和沙漏状等复杂的高级结构[27]。
大量研究表明,Septin在真菌病原体中起着重要的作用。在稻瘟病菌中,MoSEP3-GFP定位于附着胞孔处,缺失后导致侵染钉不能形成,致病力完全丧失,并且囊外复合体(Exocyst)在附着胞孔处的组装依赖于隔膜蛋白,表达和Septin环形成之前,Exocyst在附着胞孔处不会发生积累[12,29]。在禾谷镰孢()中、或的靶向缺失导致菌丝体生长速度减慢,分生孢子形成减少且形态异常,其敲除突变体毒力降低,而Δ突变体与野生型的生长形态和毒性无明显差别[30]。在禾谷镰孢中正常的成熟子囊孢子由4个细胞簇组成,具有4个单核区室,而Δ和Δ突变体的子囊孢子形态缺陷,大多为椭圆形的单细胞,子囊孢子每个隔室包含多个核,表明在子囊孢子发育过程中,基因的缺失影响细胞核分裂、分隔[31]。玉米黑粉菌()中的Septin可以组装成芽颈环,生长尖端的带状结构以及长的Septin纤维,3种不同结构可在同一细胞中共存。基因的缺失严重影响玉米黑粉菌的细胞形态,并引起热敏感性和对细胞壁应激源的敏感性增强,突变体毒力减弱,但的缺失似乎对其他Septin定位的影响较小,仅改变了的芽颈定位,表明Septin在玉米黑粉菌中显示出一定程度的相互独立性[32]。而在酿酒酵母中,当缺失一个时,通常会破坏Septin环。在构巢曲霉中,野生型菌株具有规则的梗基、瓶梗以及分生孢子链,而Δ和Δ突变体形成不规则且融合的梗基、瓶梗,产生的分生孢子较少,菌丝中的横隔减少,并且Δ、Δ突变体的生长发育似乎比野生型更快,分生孢子萌发速度更快,芽管早期出现,菌丝分支增加[33]。揭示了在不同病原真菌中Septin行为的多样性。此外,病原菌效应蛋白的分泌和转运同样也依赖Septin。例如,大丽轮枝菌()Septin5和F-actin以成环的形式(Septin环)定位于菌丝颈环,其在菌丝颈环的有序组织是分泌蛋白穿透界面所必需的,缺失导致分泌蛋白滞留在附着枝及菌丝颈环内,病菌的致病力降低[34],说明Septin参与囊泡运输。
本研究表明,在玉米大斑病菌侵染过程中表达模式发生了明显变化,且4个核心呈现明显不同的表达模式,其中在芽管时期表达最活跃,在附着胞形成阶段和侵染丝时期表达量显著上调。、表达模式相近,均在芽管和附着胞形成时期表达上调。因此推测,可能主要参与孢子萌发早期的芽管形成,、可能与附着胞发育关系密切,而可能在病菌侵染过程中附着胞形成、成熟以及侵入钉的形成发挥重要调控作用。结合隔膜蛋白Septin在调控稻瘟病菌、禾谷镰孢和玉米黑粉菌致病性中的重要作用及玉米大斑病菌不同发育时期的表达规律,推测玉米大斑病菌Septin与其功能相似,均参与调控病菌极性生长及致病力。在玉米大斑病菌中Septin是否作为一个复合体发挥作用,多个Septin高级结构如何在同一细胞质中以致病形态共存,再者,隔膜蛋白Septin在病菌中是否显示出一定程度的相互独立性等所涉及的生物学问题有待于进一步深入研究。
4 结论
玉米大斑病菌基因组中共有6个基因,随机分布,不存在连锁关系;其中4个为核心,均具有GTP-CDC结合域(G1、G3、G4 motif)。、分别在芽管及附着胞形成阶段活跃表达,、在侵入丝形成时期表达上调。
[1] VAN INGHELANDT D, MELCHINGER A E, MARTINANT J P, STICH B. Genome-wide association mapping of flowering time and northern corn leaf blight () resistance in a vast commercial maize germplasm set., 2012, 12: 56.
[2] 孙淑琴, 温雷蕾, 董金皋. 玉米大斑病菌的生理小种及交配型测定. 玉米科学, 2005, 13(4): 112-113.
SUN S Q, WEN L L, DONG J G. Identification of physiological races and mating type of., 2005, 13(4): 112-113. (in Chinese)
[3] WERIRRICH C S, ERZBERGER J P, BARRAL Y. The septin family of GTPases: architecture and dynamics., 2008, 9(6): 478-489.
[4] 张家静. Septin11对肥大细胞活化的影响及机理研究[D]. 昆明: 昆明理工大学, 2018.
ZHANG J J. Study on the effect and mechanism of Septin11 on activation of mast cells[D]. Kunming: Kunming University of Science and Technology, 2018. (in Chinese)
[5] GLADFELTER A S, PRINGLE J R, LEW D J. The septin cortex at the yeastmother-bud neck., 2001, 4(6): 681-689.
[6] ONISHI M, KOGA T, HIRATA A, NAKAMURA T, ASAKAWAH, Shimoda C, Bahler J, Wu J Q, Takegawa K, Tachikawa H, Pringle J R, Fukui Y. Role of Septins in the orientation of forespore membrane extension during sporulation in fission yeast, 2010, 30(8): 2057-2074.
[7] De Virgilio C, DeMarini D J, PRINGLE J R., a sixth member of the Septin gene family inthat is expressed specifically in sporulating cells., 1996, 142(10): 2897-2905.
[8] DOBBELAERE J, GENTRY M S, HALLBERG R L, BARRAL Y. Phosphorylation-dependent regulation of septin dynamics during the cell cycle., 2003, 4(3): 345-357.
[9] 李国涛. 酵母Coronin蛋白与Septin家族成员相互作用研究[D]. 昆明: 云南师范大学, 2017.
LI G T. Study on the interaction between Coronin protein and Septin family members in yeast[D]. Kunming: Yunnan Normal University, 2017. (in Chinese)
[10] AN H, MORRELL J L, JENNINGS J L, LINK A J, GOULD K L. Requirements of fission yeast Septins for complex formation, localization, and function., 2004, 15(12): 5551-5564.
[11] DAGDAS Y F, YOSHINO K, DAGDAS G, RYDER S L, BIEKLSA E, STEINBERG G, TALBOT N J. Septin-mediated plant cell invasion by the rice blast fungus,., 2012, 336(6088): 1590-1595.
[12] GUPTA Y K, DAGDAS Y F, MARTINEZ-ROCHA A L, KERSHAW M J, LITTLEJOHN G R, RYDER L S, SKLENAR J, MENKE F, TALBOT N J. Septin-dependent assembly of the exocyst is essential for plant infection bye., 2015, 27: 3277-3289.
[13] HERNANDEZ-RODRIGUEZ Y, HASTINGS S, MOMANY M. The Septin AspB informs bars and filaments and plays roles in growth emergence and conidiation., 2012, 11(3): 311-323.
[14] 冯会强. 灰葡萄孢菌隔膜蛋白Septin的生物学功能解析[D]. 长春: 吉林大学, 2017.
FENG H Q. Biological function analysis of Septin protein in[D]. Changchun: Jilin University, 2017. (in Chinese)
[15] HELFER H, GLADFELTER A S. AgSwe1p regulates mitosis in response to morphogenesis and nutrients in multinucleatedcells., 2006, 17(10): 4494-4512.
[16] SINHA I, WANG Y M, PHIL R, LI C R, YAP W H, WANG Y. Cyclin-dependent kinases control Septin phosphorylation inhyphal development., 2007, 13(3): 421-432.
[17] WARENDA A J, KAUFFMAN S, SHERRILL T P, BECKER J M, KONOPKA J B.Septin mutants are defective for invasive growth and virulence., 2003, 71(7): 4045-4051.
[18] LI L F, ZHANG C D, KONOPKA J B. Atemperature-sensitivemutant identifies rose for Septin in selection of sites of germ tube formation and hyphal morphogenesis, 2012, 11(10): 1210-1218.
[19] 申珅, 李贞杨, 赵玉兰, 李盼, 董金皋, 韩建民, 郝志敏. 玉米大斑病菌转录因子Flo8的基因克隆及表达规律分析. 农业生物技术学报, 2017, 25(10): 1661-1667.
SHEN S, LI Z Y, ZHAO Y L, LI P, DONG J G, HAN J M, HAO Z M. Gene cloning and expression pattern analysis of transcription factor Flo8 in., 2017, 25(10): 1661-1667. (in Chinese)
[20] 申珅, 李贞杨, 赵玉兰, 李盼, 韩建民, 郝志敏, 董金皋. 玉米大斑病菌环腺苷酸磷酸二酯酶基因克隆及表达分析. 中国农业科学, 2017, 50(16): 3135-3144.
SHEN S, LI Z Y, ZHAO Y L, LI P, HAN J M, HAO Z M, DONG J G. Cloning and expression pattern analysis of cAMP phosphodiesterase coding genes in., 2017, 50(16): 3135-3144. (in Chinese)
[21] 郭安源, 朱其慧, 陈新, 罗静初. GSDS: 基因结构显示系统. 遗传, 2007, 29(8): 1023-1026.
GUO A Y, ZHU Q H, CHEN X, LUO J C .GSDS: A gene structure display server., 2007, 29(8): 1023-1026. (in Chinese)
[22] 韩长志. 希金斯炭疽菌中5个典型Septin的生物信息学分析. 河南农业科学, 2014, 43(8): 91-96.
HAN C Z. Bioinformatics analysis of five typical Septin sequences in., 2014, 43(8): 91- 96. (in Chinese)
[23] PAN F F, MALMBEGR R L, MOMANY M.Analysis of septins across kingdoms reveals orthology and new motifs., 2007, 7: 103.
[24] NISHILHAMA R, ONISHI M, PRINGLE J R. New insights into the phylogenetic distribution and evolutionary origins of the Septins., 2011, 392: 681-687.
[25] AUXIER B, DEE J, BERBEE M L, MOMANY M. Diversity of opisthokont septin proteins reveals structural constraints and conserved motifs., 2019, 19: 4.
[26] 余文博, 江松敏, 余龙.基因家族的研究进展. 遗传, 2008, 30(9): 1097-1107.
YU W B, JIANG S M, YU L. Research progresses onfamily., 2008, 30(9): 1097-1107. (in Chinese)
[27] 史汉强. 球孢白僵菌四个Septin基因的功能解析与无外源抗性标记表达杀虫蛋白Vip3Aal的工程菌构建[D]. 杭州: 浙江大学, 2015.
SHI H Q. Functional characterization of four Septingenes and construction of markerless transgenic strains expressing insecticidal protein Vip3Aal in[D]. Hangzhou: Zhejiang University, 2015. (in Chinese)
[28] 张家静, 杨洋, 刘莹, 郭晓汐, 郝倩, 虞姣姣, 张新宇, 徐天瑞, 安输. Septin蛋白的生理功能及其对相关疾病发生发展的影响. 中国细胞生物学学报, 2018, 40(8): 1392-1401.
ZHANG J J, YANG Y, LIU Y, GUO X X, HAO Q, YU J J, ZHANG X Y, XU T R, AN S. The physiological function of Septin protein family and its effects on the occurrence and development of Septin- associated diseases., 2018, 40(8): 1392-1401. (in Chinese)
[29] RYDER L S, DAGDAS Y F, Kershaw M J, VENKATARAMAN C, Madzvamuse A, Yan X, CRUZ-Mireles N, SOANES D M, OSES-Ruiz M, STYLES V, SKLENAR J, MENKE F L H, TALBOT N J. A sensor kinase controls turgor-driven plant infection by the rice blast fungus., 2019, 574(7778): 423-427.
[30] CHEN A H, XIE Q R, LIN Y H, Xu H J, SHANG W J, ZHANG J, ZHANG D M, ZHENG W H, LI G P, WANG Z H. Septins are involved in nuclear division, morphogenesis and pathogenicity in., 2016, 94: 79-87.
[31] ZHANG Y, GAO T, SHAO W Y, ZHENG Z T, ZHOU M G, CHEN C J. The septins FaCdc3 and FaCdc12 are required for cytokinesis and affect asexual and sexual development, lipid metabolism and virulence in., 2017, 18(9): 1282-1294.
[32] ALVAREZ-TABARES I, PEREZ-MARTIN J. Septins from the phytopathogenic fungusare required for proper morphogenesis but dispensable for virulence., 2010, 5(9): e12933.
[33] LINDSEY R, COWDEN S, HERNANDEZ-RODRIGUEZ Y, MOMANY M. Septins AspA and AspC are important for normal development and limit the emergence of new growth foci in the multicellular fungus., 2010, 9(1): 155-163.
[34] ZHOU T T, ZHAO Y L, GUO H S. Secretory proteins are delivered to the Septin-organized penetration interface during root infection by., 2017, 13(3): e1006275.
Identification and expression pattern analysis ofgene family of
LONG Feng1, WANG Qing1, ZHU Hang1, WANG Jianxia1, SHEN Shen1, LIU Ning1, HAO Zhimin1, DONG Jingao1,2
(1College of Life Sciences/Key Laboratory of Hebei Province for Plant Physiology and Molecular Pathology, Hebei Agricultural University, Baoding 071001, Hebei;2College of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei)
【】Septin, which is widely found in all eukaryotes except plants, is a highly conserved GTP binding protein family and is considered to be the fourth cytoskeletal protein after microtubules, microfilaments and intermediate fibers. Septin proteins of pathogenic fungi are involved in cell polarity determination, morphological shaping and morphological transformation associated with pathogenicity.【】The objective of this study is to identifygene family of, analyze its expression pattern at different developmental stages, and to lay a foundation for clarifying the relationship between the membrane protein Septin and fungal infection structure development.【】The amino acid sequences of six Septin proteins inwere used as probe sequences, online Blastp alignment and keyword search were carried out in thedatabase to obtaincandidate. Then bioinformatics analyses including gene structure, physical and chemical properties and transmembrane region structure of the Septins were conducted. The materials ofthat were induced by artificial hydrophobic media at different stages of infective structures development and infected host leaves at different times were collected, and RT-qPCR (real-time fluorescence quantitative PCR) technology was used to analyze the transcription levels ofat different stages of infective structures development.【】Six candidatewere obtained, and among them, four typicalcontained G1, G3, and G4 motifs, were named by,,and,respectively. The expression level ofincreased slowly under the induction on artificial hydrophobic media.was active in the late stage of germ tube formation, and its expression level was 25.69 times of that in the conidia period (<0.01). The expression level ofreached a peak in appressorium anaphase, and then the expression level was down-regulated. The change trend ofexpression in the process of pathogen infection was basically consistent with that under the induction of artificial hydrophobic material.expression was significantly up-regulated at 6 h after inoculation (<0.01). As time went on,actively expressed during the period of appressorial formation, and the expression reached a peak at 18 h after inoculation. After that, the expression was down-regulated, but it was still higher than that in the early stage of germination.andwere active at 18 h and 24 h after inoculation, exceeding the initial stage of germination.【】There are 4 corein the genome of.andare actively expressed during the formation of germ tube and appressoria, respectively. The results will provide a theoretical basis for further clarifying the function of Septin and the infection regulation mechanism of.
;gene family; RT-qRCR; gene expression

10.3864/j.issn.0578-1752.2020.24.005
2020-03-28;
2020-05-10
国家重点研发计划(2018YFD0200607)、河北省自然科学基金(C2018204120、C2020204172)、河北省高等学校青年拔尖人才科学技术研究项目(BJ2014349Y)、国家现代农业产业技术体系(CARS-02-25)、国家自然科学基金(31901827)
龙凤,E-mail:2801351713@qq.com。王擎,E-mail:wangqing9525@126.com。龙凤和王擎为同等贡献作者。通信作者董金皋,Tel:0312-7528166;E-mail:dongjingao@126.com。通信作者郝志敏,Tel:0312-7528142;E-mail:haozhimin@hebau.edu.cn
(责任编辑 岳梅)
