转phyA2、ZmTMT和Bar玉米的获得及其特性分析
2021-01-04姚兴兰杨文竹罗彦忠陈茹梅王磊张兰
姚兴兰,杨文竹,罗彦忠,陈茹梅,王磊,张兰
转、和玉米的获得及其特性分析
姚兴兰,杨文竹,罗彦忠,陈茹梅,王磊,张兰
(中国农业科学院生物技术研究所,北京 100081)
【】玉米是家禽和单胃动物饲料的主要原料,但玉米籽粒中高活性的α-生育酚含量较低,且籽粒中的磷主要是以植酸磷的形式存在,动物不能有效吸收利用,因此,饲料中需要添加化学合成的维生素E和无机磷或微生物来源的植酸酶以满足动物生长发育的需要,增加了饲料成本,同时又容易造成磷污染。通过转基因获得α-生育酚含量和植酸酶活性大量提高的玉米,为饲用玉米育种提供材料基础。构建含有3个基因表达盒的载体,采用农杆菌侵染的方法转化玉米,草铵膦作为筛选压力;通过喷施草铵膦和PCR鉴定的方法筛选转基因阳性植株,RT-PCR分析目的基因在转录水平的表达情况;Western blot分析目的基因在翻译水平上的表达情况,采用分光光度计测定转基因玉米籽粒中的植酸酶活性,利用HPLC测定籽粒中的维生素E含量,同时比较转基因株系与野生型在其他营养成分和农艺性状上的差异。构建了胚乳特异性启动子123387驱动的植酸酶基因表达盒、胚特异性启动子13387驱动的玉米γ-生育酚甲基转移酶基因表达盒以及组成型启动子CaMV 35S驱动的草铵膦抗性基因表达盒串联的植物表达载体;转化玉米获得转基因植株;喷施草铵膦和PCR鉴定得到阳性植株;经过多个世代回交转育,获得目标性状均较好的2个转基因纯合玉米株系TPB1和TPB2;RT-PCR和Western blot分析结果表明、和在转基因玉米中显著高表达。植酸酶活性测定结果表明,转基因玉米籽粒中植酸酶活性达到10 000—13 000 U·kg-1。维生素E含量测定结果表明,转基因玉米籽粒中90%以上的γ-生育酚转化为α-生育酚,α-生育酚的含量达到50—70 mg·kg-1,α-三烯生育酚的含量也有明显增加。转基因玉米中的植酸酶活性和α-生育酚含量完全能够满足动物饲料的需要。转基因株系的农艺性状与野生型无显著差异,TPB1的营养成分与野生型总体无显著差异,TPB2稍高于野生型但是未产生不利影响;且均具有草铵膦抗性。获得的富含维生素E和植酸酶、且具有除草剂抗性的玉米新材料可以用于玉米杂交种的开发应用,降低饲料成本,提高磷的利用率,减少环境污染。
玉米;植酸酶;维生素E;α-生育酚;草铵膦抗性
0 引言
【研究意义】玉米()是动物和家禽重要的饲料作物之一,全球用于饲料的玉米占总量的65%,相当于4.5×108亿t[1]。磷和维生素E是动物生长发育所需的重要元素,磷在谷物、豆类等籽实作物中主要以植酸磷的形式存在,占植物种子磷含量的52%—80%[2-3]。而单胃动物(例如猪、鸡等)消化道中不能分泌植酸酶,导致植酸磷不能得到有效利用[3-5]。此外,植酸是抗营养因子,能与动物体内的重要矿质元素(如Fe3+、Zn2+、Ca2+、Mg2+和K+)和蛋白结合形成共沉淀,从而导致动物不能有效吸收矿物质[6-8]。因此,饲料中需外源添加无机磷或者微生物来源的植酸酶才能满足动物生长的需要。维生素E是一类脂溶性抗氧化剂,是人体和动物营养所必须、但又不能自身合成的重要维生素。维生素E只能在光合组织合成(植物和光合细菌),具有维持生物膜完整性、防止脂质氧化等重要的生物学功能[9-10]。根据天然维生素E植基侧链的饱和程度分为生育酚和三烯生育酚,根据色满醇环上甲基数量和位置的不同分为α-、β-、γ-、δ-生育酚/三烯生育酚[10],其中,以α-生育酚的活性最高[11]。玉米作为动物饲料的主要原料,籽粒中低活性的γ-生育酚含量最高,而高活性的α-生育酚含量较低。为了满足动物生长发育需要,饲料中需要外源添加合成的DL-α-生育酚醋酸酯。DL-α-生育酚醋酸酯的生物活性仅为天然α-生育酚的三分之二,其生物利用率也仅为天然α-生育酚的五分之一左右[12-13]。因此,改善玉米籽粒中植酸酶的表达量和维生素E的组成,提高玉米中植酸酶活性和高活性α-生育酚的含量,则饲料中可以不再外源添加植酸酶或磷和合成的维生素E,大大降低饲料成本。【前人研究进展】植酸酶可以催化植酸水解产生肌醇衍生物和无机磷[14],目前,已从植物和微生物中分离了植酸酶基因,其中来源于微生物、尤其是曲霉属的植酸酶报道比较多[15-18]。曲霉来源的植酸酶因其在酸性环境酶活性高、耐热性好而备受关注[18]。酵母中表达的具有较高的酶活性(13 000—16 000 U·mL-1)和良好的热稳定性[14],目前已被用作饲料添加剂[15-18]。玉米中胚特异性表达,籽粒中植酸酶活性达到2 200 U·kg-1[19],胚乳特异性表达,籽粒中植酸酶活性达到125 000 U·kg-1[20],此胚乳特异表达的玉米已获得安全生产证书(BVLA430101)[21],可应用于饲料生产。而在维生素E的合成途径中,γ-生育酚甲基转移酶(γ-TMT)催化低活性的γ-生育酚转化为高活性的α-生育酚。因此,提高γ-TMT的表达来增加高活性的α-生育酚含量是进行维生素E基因工程的首选。1998年,SHINTANI等[22]率先过表达拟南芥的(),使得拟南芥种子中α-生育酚含量提高约80倍;水稻中过表达,转基因水稻胚乳中α-三烯生育酚含量提高1.7倍[23];莴苣中过表达,T2代转基因株系中α-生育酚含量提高约38倍[24];过表达拟南芥和白苏的,转基因大豆种子中α-生育酚含量分别提高4倍和10.4倍[25-26]。Zhang等[23,27]分别研究了大豆的和玉米的,转和玉米株系α-生育酚含量分别提高3—4.5倍和5—6.5倍。【本研究切入点】前期分别研究了和在玉米籽粒中的表达,转玉米中,植酸酶活性得到大幅度提高[19-20];转玉米中,α-生育酚含量与野生型相比提高5—6.5倍[27]。但是通过同时表达和聚合高α-生育酚和植酸酶活性2种性状的相关研究却未见报道,因此,利用和共表达获得多种目标性状聚合的转基因玉米,将为饲料加工提供便利,还可以大大降低成本;同时,研究多性状聚合是否会影响受体材料的农艺性状以及营养成分,为今后聚合更多性状饲用玉米育种提供参考。【拟解决的关键问题】本研究分别利用胚、胚乳特异表达的启动子驱动目的基因的表达,获得多性状聚合的转基因玉米,为饲料加工提供便利,大大降低成本;同时为饲料玉米育种提供资源。
1 材料与方法
1.1 试验材料
双元载体pCAMBIA3301(含有表达盒,具有草铵膦抗性)、质粒pPHP20754-phyA2(含植酸酶基因表达盒、LEG1启动子、LEG1终止子)[20]、pSP-ZmTMT(含有表达盒,Glb1的启动子和终止子)[27]、pEU13387G3(含有13387启动子)[28]、pUM3G-123387(含有123387启动子)、农杆菌菌株EHA105、含有30a-ZmTMT质粒的大肠杆菌菌株[27]均为王磊研究员实验室保存。
转化受体材料Hi-II[29]和回交转育材料(自交系郑58)为王磊研究员实验室保存。玉米大田种植于试验基地;转基因幼苗在25℃的生长箱中以16 h光照/8 h黑暗周期生长约2周,再在16 h光照/8 h黑暗周期中移至28℃的温室中。
1.2 载体构建和转基因植株的获得
利用引物ZT3301 FW:5′-ATCGCAAATTTGGTC ATGGCTCACGCGGCGCTGCT-3′,ZT3301 RV:5′- CGATCGGGGAAATTCGAGCTGGGTCACCTCTTTTATGAATAATAATAA-3′,以质粒pSP-ZmTMT为模板,PCR扩增获得片段(含有序列和Glb1终止子序列)。利用引物13387 FW0:5′-CTATGACCATGATTACGGTTTAAACAAGGAACATCTTAGGAAGTG-3′(加入Ⅰ酶切位点),13387 RV1:5′-GACCAAATTTGCGAT GTGTCGTCG TCCGCCACCCGA-3′,以质粒pEU13387G3为模板,PCR扩增得到13387启动子序列。质粒载体pCAMBIA3301做RⅠ和EⅡ酶切处理。利用试剂盒(Vazyme,C112-01),将酶切后的载体pCAMBIA3301、13387启动子序列以及片段进行重组反应,得到3301-13387-ZT质粒载体。
利用引物CPAO3301 FW:5′-TGGTCACAAATT TCGATGGCCCCACGCCGCCTGCT-3′,CPAO3301 RV1:5′-CTAAGATGTTCCTTGTTTAAACCAGTAT AACTATGCCGAGGT-3′,以质粒pPHP20754-phyA2为模板,PCR扩增得到片段(含有信号肽SP,靶向液泡序列VTS,序列以及LEG1终止子)。利用引物123387 FW:5′-CTATGACCATGATTACG GTTTATTTAAATATGCTTCGACCAAAACACCC-3′,123387 RV:5′-CGAAATTTGTGACCAGCATGCAG TCAACAATGGCCA-3′(加入Ⅰ酶切位点),以质粒pUM3G-123387为模板,PCR扩增得到123387启动子序列。质粒载体3301-13387-ZT做Ⅰ酶切处理。将酶切后的3301-13387-ZT、123387启动子序列以及片段进行重组反应,得到3301-phyA2- ZT质粒载体。
将3301-phyA2-ZT载体转化农杆菌菌株EHA105,侵染玉米Hi-II幼胚,参照HYUN等[30]方法进行,草铵膦BASTA作为筛选压力,获得转基因植株。转基因植株与自交系郑58杂交获得F1植株,然后再与郑58回交5代,自交2代获得BC5F3。最后,获得转基因纯合株系TPB1和TPB2。每个世代的转基因玉米植株均通过叶片涂抹草铵膦或者喷施草铵膦鉴定阳性,再经过PCR验证。
1.3 phyA2、ZmTMT和Bar的RT-PCR分析
利用RNA提取试剂盒(Transgene,ER501-01)提取转基因株系玉米授粉15 d的籽粒总RNA,cDNA第一链的合成按照MonScript™ RTIII All-in-One Mix(Monad,MR05001S)的操作说明进行。
采用RT-PCR的方法分析、、的RNA水平表达。以作为内参[31],引物:Actin-F:5′-ATGTTTCCTGGGATTGCCGAT-3′,Actin-R:5′-CCAGTTTCGTCATACTCTCCCTTG-3′;引物:AO1229F1:5′-TTGTCTGGCGTGACTCT CAC-3′,AO1229R1:5′-TCCTGCTCAGACTGGCAT TG-3′;引物:ZT1229F1:5′-ATGTCGGATGTG GCATTGG-3′,ZT1229R1:5′-CCCTGGATCATTAG CGGC-3′;引物:bar1225F:5′-GGAAGTTGACCG TGCTTGTC-3′,bar1225R:5′-CGAGTCAACCGTGT ACGTCT-3′。
1.4 phyA2、ZmTMT和Bar蛋白的western blot分析
转基因株系成熟籽粒研磨成粉末,称取100 mg提取总蛋白(蛋白提取液:50 mmol·L-1Tris-HCl(pH 8.0)、150 mmol·L-1NaCl、1 mmol·L-1EDTA、2% NP-40(v/v)和10 mmol·L-1PMSF)进行western blot分析,参考Chen等[19]方法进行。SDS-PAGE使用12%浓度胶,使用NC膜(Merk,Germany)转膜。phyA2杂交一抗为phyA2蛋白的兔抗血清[19],二抗为辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(CW Bio,CW0156S);ZmTMT和Bar杂交的一抗分别为2个蛋白的鼠抗单克隆抗体,二抗为辣根过氧化物酶标记的羊抗鼠IgG(CW Bio,CW0110S),杂交时一抗/二抗稀释5 000—10 000倍进行杂交。
1.5 植酸酶活性以及植酸磷和磷含量测定
参考Markus等[32]和Chen等[19]方法测定植酸酶活性、植酸磷和磷含量。
植酸酶活性测定:称取上述成熟籽粒粉末50 mg加入1 mL提取液,振荡孵育1 h,10 000 r/min,离心15 min,上清液即为植酸酶提取液。酶活性测定:取20 μL植酸酶提取液,加入80 μL植酸钠,37℃孵育30 min,100 μL 15%TCA终止反应;以孵育前加入TCA的反应体系作为对照。取20 μL反应液加入80 μL水和100 μL显色液,37℃显色20 min,酶标仪检测酶活性。
磷含量测定:称取上述成熟籽粒粉末50 mg加入1 mL 0.4 mol·L-1HCl和15% TCA的混合液;室温置于摇床振荡3 h;5 000 r/min,离心15 min;取200 μL上清加入100 μL H2O,混匀,4 000 r/min,离心10 min;取50 μL上清加入96孔板中;每孔加入100 μL显色液,37℃反应30 min后读数。
植酸磷测定:取50 μL上述磷含量测定时的提取液上清,加入550 μL 36.3 mmol·L-1NaOH和200 μL显色液,混匀,5 000 r/min,离心10 min;取200 μL混合液加入96孔板中进行读数。
1.6 维生素E含量测定以及其他营养成分分析
参考Konda等[33]方法测定维生素E含量,在中国农业科学院作物科学研究所重大工程中心完成。称取上述成熟籽粒粉末50 mg加入1 mL维生素E提取液(0.01% BHT,甲醇﹕二氯甲烷=9﹕1(v/v),标准品1.5 ng·μL-1),混匀静置20 min,10 000 r/min,离心10 min,上清经0.22 μm滤器(津腾,LQ0002)过滤,HPLC上样检测。标准品为Rac-5,7-dimethyltocol(Abcam,ab143879),分离柱为安捷伦XDB-C18柱(258×4.6×5),用荧光检测器(Ex 292 nm,Em 330 nm)进行测定。
根据饲料中所需检测的主要营养成分[34],检测转基因玉米材料籽粒中钙、18种氨基酸、干物质、粗脂肪以及粗蛋白的含量,委托中国农业大学农业农村部饲料效价与安全监督检验测试中心完成。
1.7 农艺性状分析
对成熟期的玉米进行农艺性状分析,各取40个单株,对其株高、穗位,雌穗的穗行数、行粒数、穗长以及轴粗等数据进行统计分析。
2 结果
2.1 转基因植株的获得
为了获得籽粒中α-生育酚和植酸酶含量提高的材料,分别选用胚乳特异表达的启动子和胚特异表达的启动子驱动和的表达,与载体自带的组成型启动子驱动的表达盒串联,如图1所示,采用农杆菌侵染的方法转化玉米,经过多个世代回交转育,获得了目标性状均较好的2个转基因纯合玉米株系TPB1和TPB2,对其进行比较深入的研究。
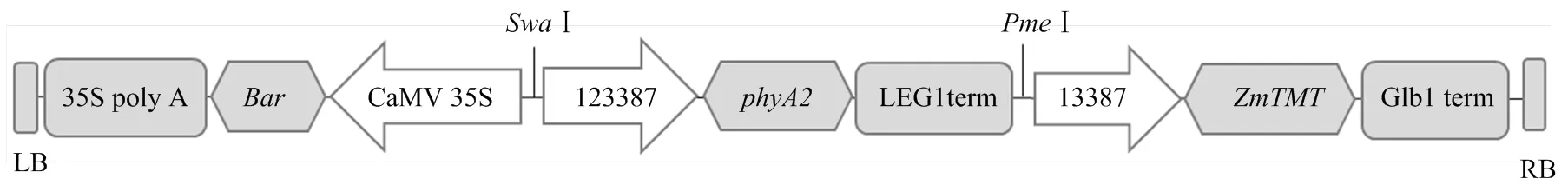
phyA2表达盒由胚乳特异表达的启动子123387驱动;ZmTMT表达盒由胚特异表达的启动子13387驱动;Bar表达盒由组成型启动子CaMV 35S驱动
2.2 phyA2、ZmTMT和Bar的转录水平分析
为了明确转基因株系籽粒中、和的RNA水平表达,提取授粉后15 d籽粒的RNA进行RT-PCR分析(图2)。、和在转基因株系TPB1和TPB2的籽粒中均有高表达,但由于和均是玉米外源基因,二者在WT(郑58)中无表达;而是玉米内源基因,在WT中存在一定水平的表达。
2.3 phyA2、ZmTMT和Bar的翻译水平分析
为了确定转基因株系籽粒中phyA2、ZmTMT和Bar蛋白的表达情况,提取成熟籽粒的总蛋白进行western blot分析(图3)。phyA2、ZmTMT和Bar蛋白在转基因株系TPB1和TPB2的籽粒中均有表达。ZmTMT蛋白为玉米内源蛋白,不但在转基因株系有表达,在WT中也有表达,但在WT中的表达与在转基因株系中的表达差异并不明显,推测可能的原因是,ZmTMT是维生素E合成途径中的关键酶,ZmTMT蛋白可能部分在发挥功能之后被降解;另外,用于阳性对照的ZmTMT蛋白是原核表达的融合蛋白,大小约38 kD,而ZmTMT蛋白本身含有叶绿体定位信号肽,在植物体内信号肽被去除之后其蛋白大小约为33 kD,这也是ZmTMT的蛋白杂交条带与阳性对照有差异的原因(图3-A)。Bar和phyA2蛋白均为外源蛋白,因此,2个蛋白只在转基因株系TPB1和TPB2中有表达,而在WT中无表达(图3-B和图3-C)。
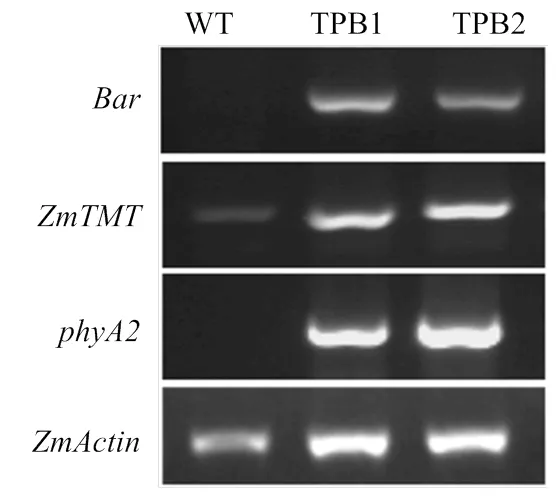
WT:野生型郑58;TPB1、TPB2:转基因纯合株系
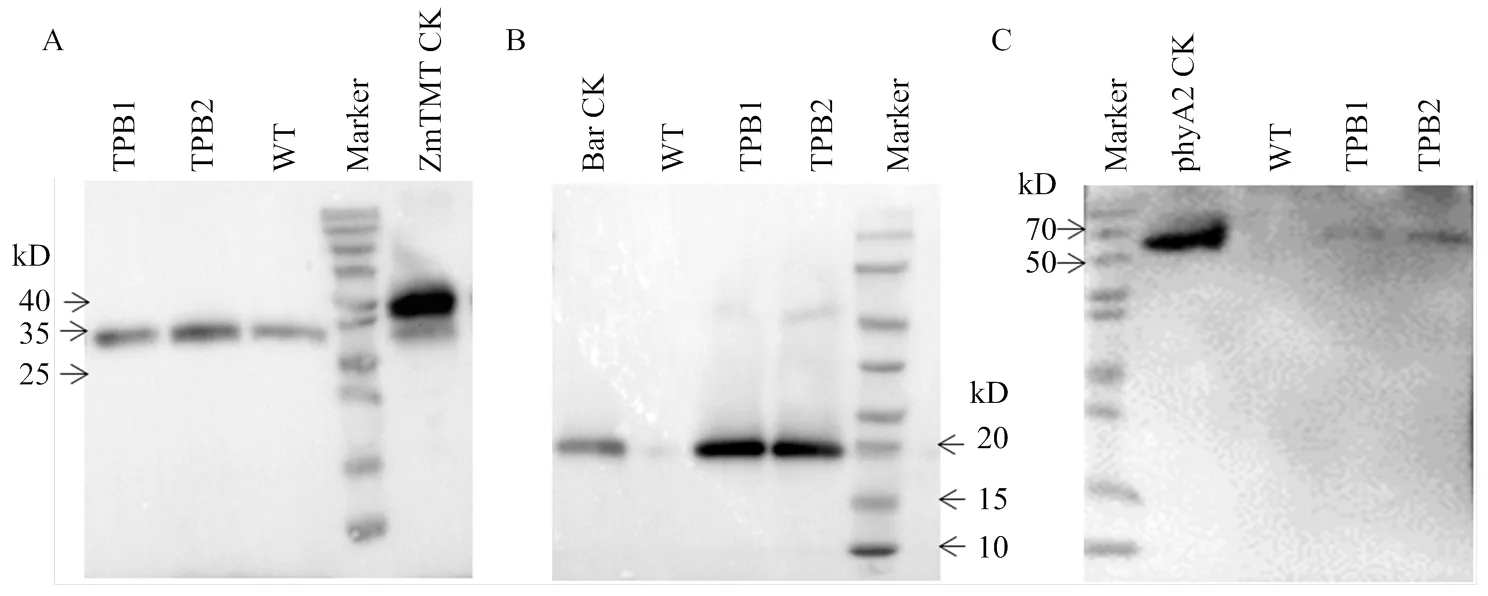
A:ZmTMT蛋白的表达分析;B:Bar蛋白的表达分析;C:phyA2蛋白的表达分析。WT:野生型郑58;TPB1、TPB2:转基因纯合株系;Marker:蛋白分子量标准;ZmTMT CK:原核表达的融合ZmTMT蛋白阳性对照;Bar CK:Bar蛋白阳性对照;phyA2 CK:已报道的转基因玉米表达的phyA2蛋白阳性对照[19]
2.4 植酸酶活性以及植酸磷和磷含量测定
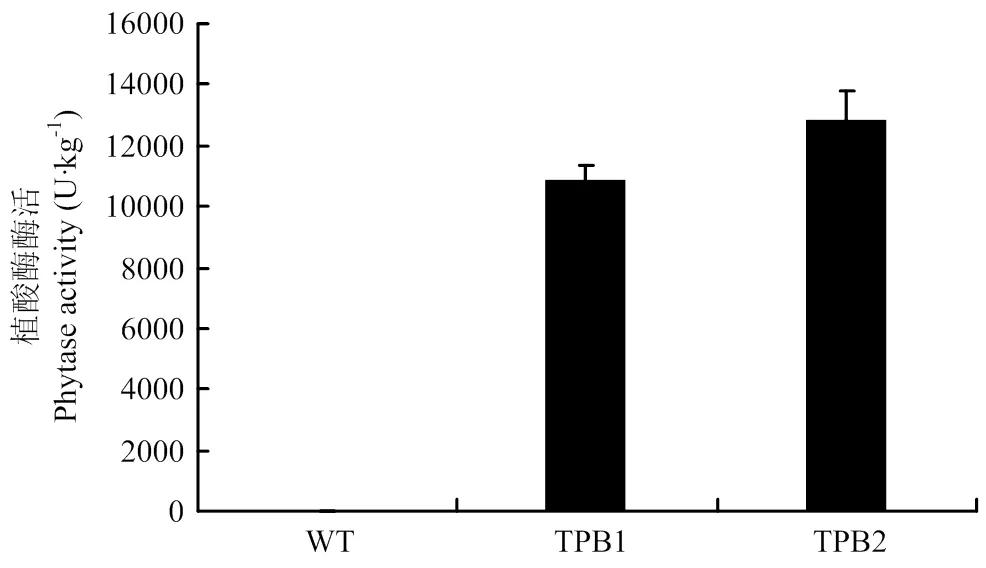
植酸酶phyA2蛋白已在转基因玉米成熟籽粒得到高表达,接下来对其酶活性进行了测定(图4)。转基因株系TPB1和TPB2中phyA2的酶活性均超过10 000 U·kg-1,TPB1中phyA2的酶活性是10 884 U·kg-1,TPB2中phyA2的酶活性达到12 864 U·kg-1。已有报道饲料中对植酸酶的需求量是750—1 000 U·kg-1[35],TPB1和TPB2中植酸酶活性已到达需求量的10倍以上,完全能够满足饲料的需要。
植酸酶能够分解植酸磷生成肌醇衍生物和无机磷,进一步测定了植酸磷和磷的含量,结果显示,转基因株系TPB1和TPB2中植酸磷和磷的含量与WT相比并无差异(表1),这是由于植酸磷主要存在于胚中,而TPB1和TPB2中的植酸酶主要在胚乳中特异高表达,酶和底物存在部位的不同导致植酸酶不能直接分解植酸磷。而植酸酶在胚中特异高表达时则可以有效分解植酸磷[19]。
2.5 维生素E含量以及其他营养成分分析
γ-生育酚转化为高活性的α-生育酚,为了确定ZmTMT蛋白的高表达对维生素E组分的影响,采用内标法,利用HPLC检测了转基因株系TPB1和TPB2中维生素E的含量(图5)。转基因株系TPB1和TPB2中,α-生育酚的含量显著提高,TPB1中达到51.58 mg·kg-1,TPB2中达到66.18 mg·kg-1,分别是WT中α-生育酚含量的4.9倍和6.3倍;同时,γ-生育酚的水平则均显著下降(<0.01),表明ZmTMT充分发挥了其功能,将90%以上的γ-生育酚转化为了α-生育酚。另外,ZmTMT蛋白的高表达,也将部分γ-三烯生育酚转化为了α-三烯生育酚(图5-B)。
WT:野生型郑58;TPB1、TPB2:转基因纯合株系
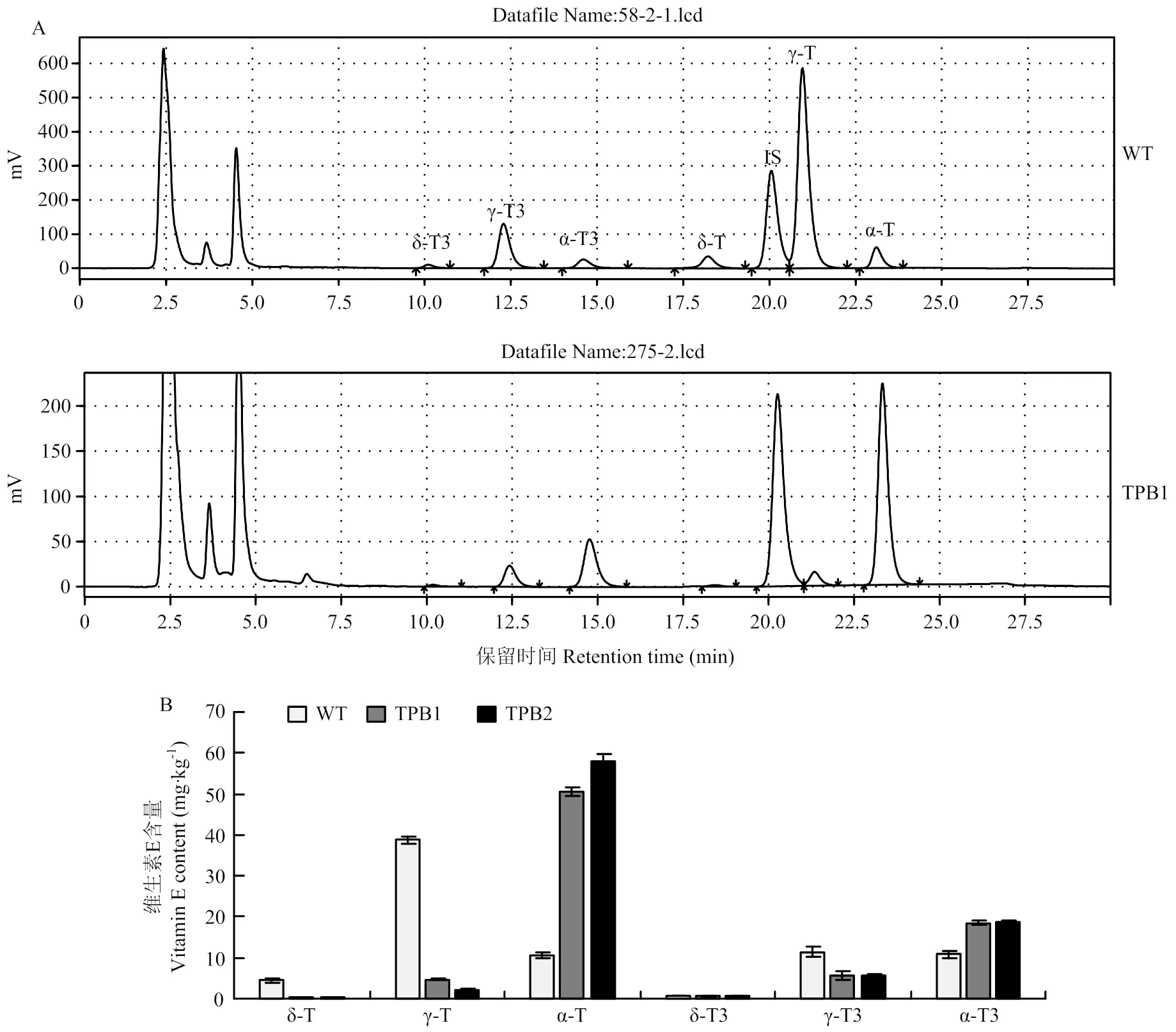
A:维生素E测定色谱图。α-、γ-、δ-T/T3表示α-、γ-、δ-生育酚/生育三烯酚;IS:标准品;Rac-5,7-dimethyltocol;B:籽粒中维生素E含量分析。WT:野生型郑58;TPB1、TPB2:转基因纯合株系

表1 籽粒中植酸磷和磷含量分析
WT:野生型郑58;TPB1、TPB2:转基因纯合株系
WT: wild type zheng58; TPB1, TPB2: transgenic homozygous lines
为了确定转基因玉米中α-生育酚和植酸酶的积累是否影响玉米籽粒其他营养成分的含量,对转基因株系籽粒中的营养成分进行了测定(表2)。结果显示,TPB1的营养成分总体与WT无显著差异,TPB2总体稍高于WT,推测原因为:不同转基因株系之间由于插入位点的不同可能会导致性状之间有一定的差异;另外,转基因材料最初受体是玉米Hi-II,之后转育到郑58中,转基因株系中存留了少量的Hi-II遗传信息,这也可能是导致差异的原因之一;除此之外,并未发现任何不利影响。
2.6 农艺性状分析
为了检测转基因玉米中α-生育酚和植酸酶的积累是否影响玉米本身的农艺性状,对转基因株系TPB1和TPB2的株高、穗位,雌穗的穗长、穗行数、行粒数和轴粗等进行了统计分析。结果显示,转基因植株的株高、穗位以及雌穗的性状与WT相比均无显著差异(图6),表明转基因玉米籽粒中维生素E组分的改变以及植酸酶含量的提高并未对其农艺性状产生影响。
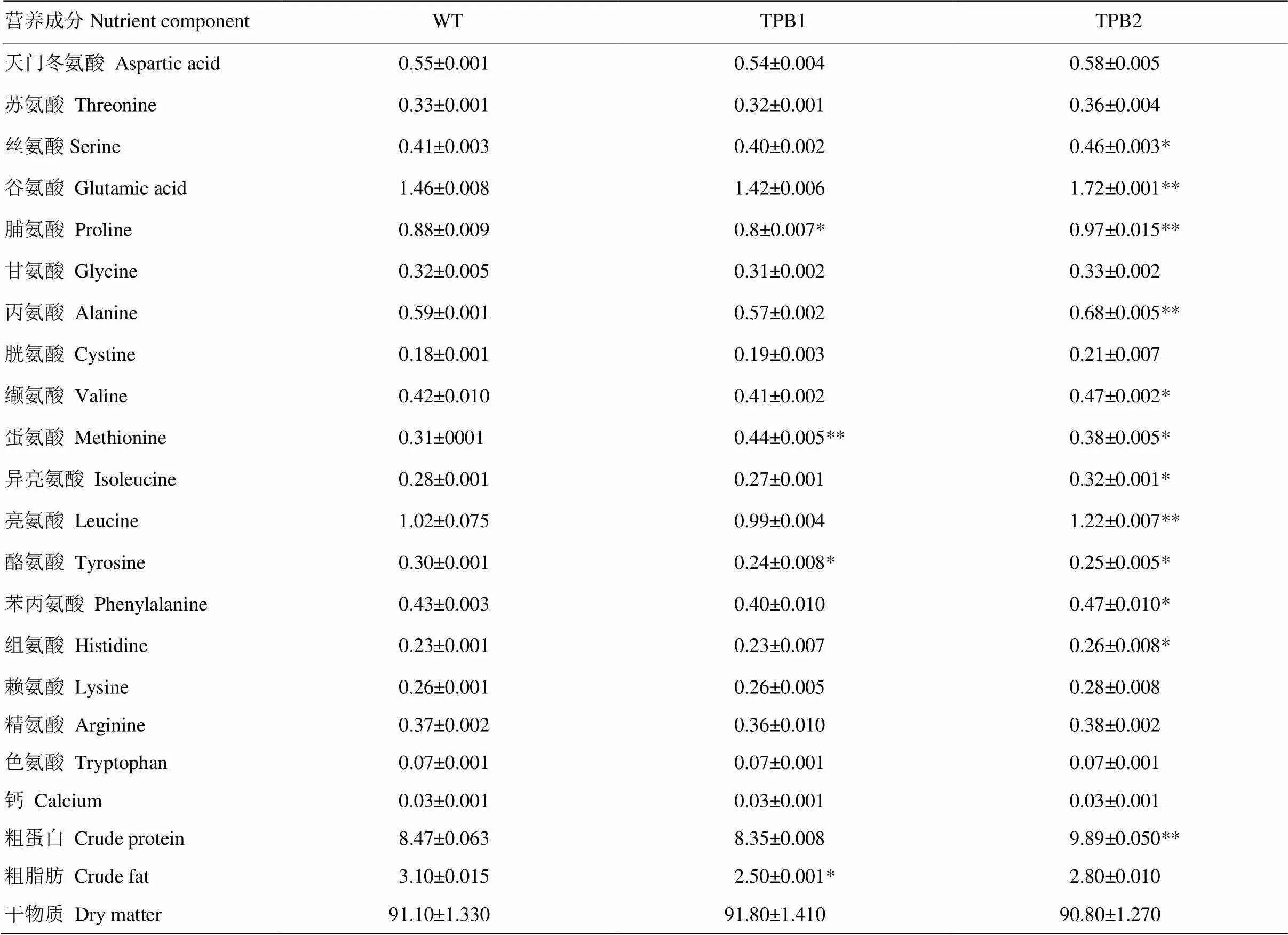
表2 籽粒中其他营养成分分析
WT:野生型郑58;TPB1、TPB2:转基因纯合株系;结果以平均值±标准差(SD)表示;*表示≤0.05,**表示≤0.001
WT: wild type zheng 58; TPB1, TPB2: transgenic homozygous lines; Results are expressed as mean ± standard deviation (SD); *≤0.05, **≤0.001
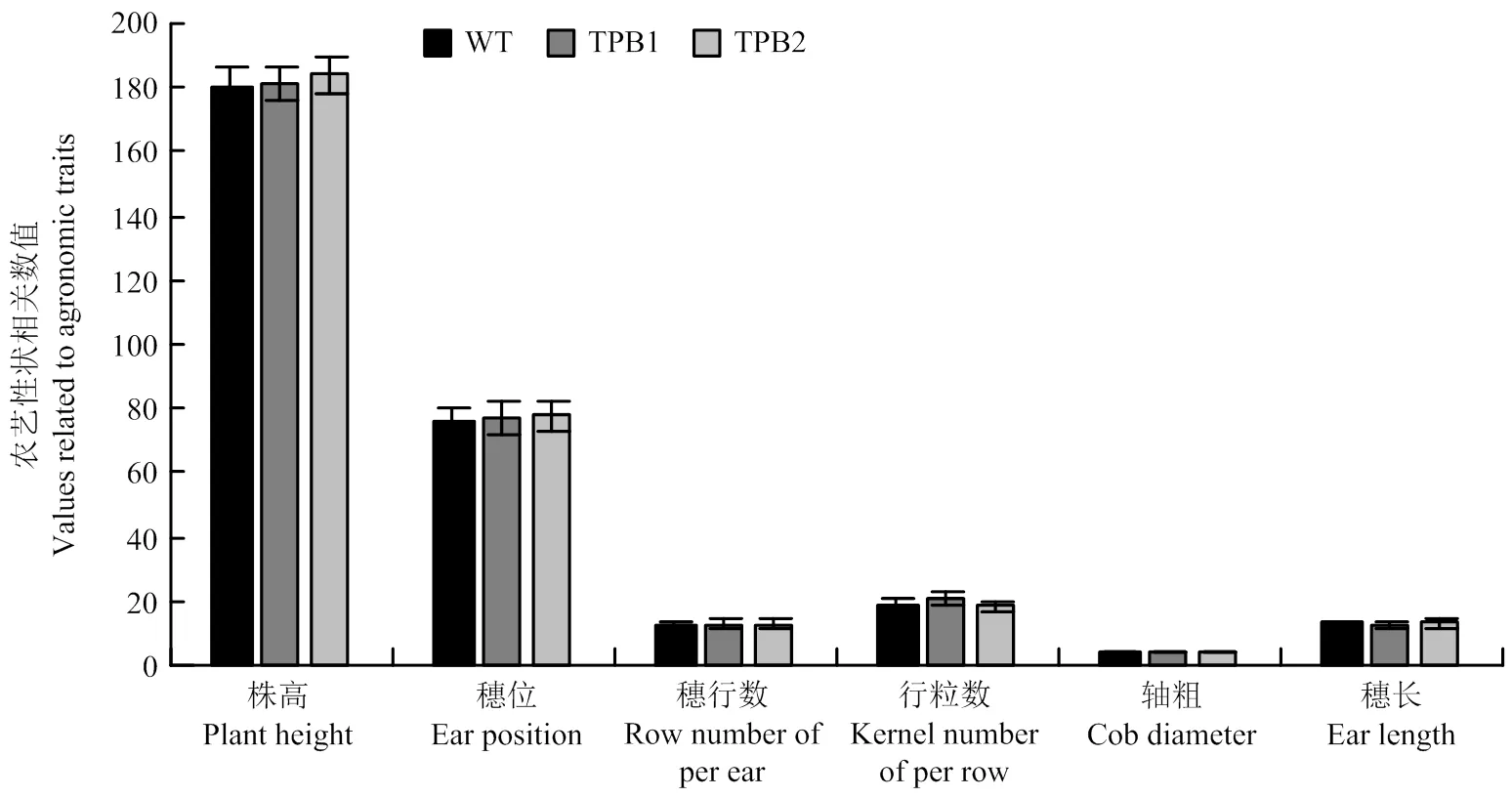
WT:野生型郑58;TPB1、TPB2:转基因纯合株系 WT: wild type zheng58; TPB1, TPB2: transgenic homozygous lines
3 讨论
玉米是最重要的畜禽饲料原料之一,约占饲料成分的二分之一。玉米中低植酸酶活性和维生素E含量使得饲料中必须外源添加大量微生物来源的植酸酶和合成的维生素E。中国饲料工业年鉴2006/2007数据显示,中国饲料工业一年需要合成的维生素E达17 500 t,按市场价150元/kg计算,则需要花费26亿元;而且近些年的数据还在不断增加[27]。而目前,国际市场上植酸酶占饲料酶市场总量的40%,高达3×105t以上,对于标准化为5 000 FTU·g-1的产品(工业植酸酶制剂的浓度范围通常为5 000—100 000 FTU·g-1),市场价格7—35元/kg不等,花费在21亿—25亿元,大大增加了饲料的成本[36]。转玉米与微生物来源的植酸酶分别同时添加到饲料中饲喂肉鸡发现,玉米表达的对肉鸡的营养作用与微生物来源的植酸酶在减少饲料无机磷添加和动物粪便中磷酸盐的排泄方面相似[20],表明表达的玉米可以直接应用于饲料生产。转玉米与合成的DL-α-生育酚醋酸酯分别同时添加到饲料中饲喂肉鸡发现,尽管玉米表达的维生素E与合成的维生素E对肉鸡生长性能无显著差异,但富含维生素E的转基因玉米能够提高肉仔鸡血清中α-生育酚含量,改善血清和肝脏的抗氧化能力[37],表明α-生育酚含量高的玉米不但可以用于饲料,而且要优于合成的维生素E。本研究将、和表达盒串联转化玉米,获得了具有植酸酶活性>10 000 U·kg-1、α-生育酚含量达50—70 mg·kg-1以及草铵膦抗性的性状聚合的玉米新材料,该玉米用于饲料,则饲料中不再需要外源添加维生素E和植酸酶就完全能够满足动物生长发育的需求,可以降低饲料成本,增加生产性能,减少磷污染。另外,此转基因玉米在同时表达3个基因、聚合3种性状时,其植株农艺性状以及籽粒的营养成分(除目标性状外)等与WT相比无显著差异;表明获得的转基因材料既保持了该品种自身的所有性状,同时又增加了除草剂抗性、改良了品质性状。这也为多性状聚合育种提供了参考。
本研究中,转基因玉米中不仅α-生育酚含量升高,α-三烯生育酚的含量也得到了提高。α-三烯生育酚的生物活性约相当于合成的DL-α-生育酚醋酸酯生物活性的45%[38],即本研究获得的转基因材料中活性维生素E成分有额外的改善。另外,多项研究表明,三烯生育酚也同样具有清除自由基、抗氧化等作用。Che等[39]通过同时表达和,使得高粱中生育酚和三烯生育酚含量以及β-胡萝卜素含量都得到了提高,并且大量积累的维生素E对β-胡萝卜素储存过程中的稳定性起到了非常关键的作用。Konda等[33]同时表达和,使得大豆中维生素E含量提高;此转基因大豆与高SDA的大豆材料杂交后,改善了PUFA的氧化稳定性。在医疗方面,三烯生育酚还具有降低胆固醇、抑制癌细胞生长等重要作用[40-41]。因此,从生物强化的角度来看,维生素E仍将是未来具有潜力的研究方向,通过同时转化多个基因的手段,不但能够获得多性状聚合的植物材料,而且还可以具有营养丰富、耐储存等优良性状。
4 结论
同时表达生育酚合成相关基因、植酸酶基因和草铵膦抗性基因,获得了富含α-生育酚和植酸酶、且具有除草剂抗性的转基因玉米,可应用于饲料生产。
[1] Abbassian A. Maize: International Market Profile. In Food and Agriculture Organization of the United Nations, 2006: 1-37.
[2] Cosgrove D J. The chemistry and biochemistry of inositol polyphosphates., 1966, 16: 209-215.
[3] Austin S, Bingham E T, Mathews D E, Shahan M N, Will J, Burgess R R. An overview of a feasibility study for the production of industrial enzymes in transgenic Alfalfa., 1994, 721(1): 234-244.
[4] Ravindran V, Bryden W L. Phytates: occurrence, bioavailability and implications in poultry nutrition., 1995, 6: 125-143.
[5] Peers F G. The Phytase of Wheat., 1953, 53(2): 102-110.
[6] Urbano G, Lopez M, Aranda P, Vidal C, Tenorio E, Porres J. The role of phytic acid in legumes: antinutrient or beneficial function?, 2000, 56: 283-294.
[7] Kozi A, Kunisuke T, Kasai Z. Formation of phytic acid in cereal grains.,1969, 165: 801-814.
[8] Liener I E. Implications of antinutritional components in soybean foods., 1994, 34(1): 31-67.
[9] Traber M. Vitamin E: beyond antioxidant function., 1995, 62(6 Suppl.): 1501S-1509S.
[10] AfafK. The chemistry and antioxidant properties of tocopherols and tocotrienols., 1996, 31(7): 671-701.
[11] Traber M. Vitamin E in humans: demand and delivery., 1996(16): 321-347.
[12] Cheng K, Niu Y, Zheng X C, Zhang H, Chen Y P, Zhang M, Huang X X, Zhang L L, Zhou Y M, Wang T. A comparison of natural (d-alpha-tocopherol) and synthetic (dl-alpha-tocopherol acetate) vitamin e supplementation on the growth performance, meat quality and oxidative status of broilers., 2016, 29(5): 681-688.
[13] Marusich W L, Ackerman G, Bauernfeind J C. Biological efficacy of D-and DL-α-tocopheryl acetate in chickens., 1967, 46(3): 541-548.
[14] Yao B, Zhang C Y, Wang J H, Fan Y. Recombinantoverexpressing bioactive phytase., 1998, 41: 330-336.
[15] Theo C V, Peter A P, Albert J J, Jan W M, André H, Pen J. Stable accumulation ofphytase in transgenic tobacco leaves., 1995, 109: 1199-1205.
[16] Henrik B P, Lisbeth D S, Holm P B. Engineering crop plants: getting a handle on phosphate., 2002, 7(3): 118-125.
[17] Alan E R, Paul A H, Hayes J E. Extracellular secretion offromroots enables plants to obtain phosphorus from phytate., 2001, 25 (6): 641-649.
[18] 范云六. 植酸酶的分子生物学与基因工程. 生物工程学报, 2000, 16(1): 1-5.
Fan Y L. Molecular biology and genetic engineering of phytase., 2000, 16 (1): 1-5. (in Chinese)
[19] Chen R, Xue G, Chen P, Yao B, Yang W, Ma Q, Fan Y, Zhao Z, Tarczynski M C, Shi J. Transgenic maize plants expressing a fungal phytase gene., 2008, 17(4): 633-643.
[20] Chen R, Zhang C, Yao B, Xue G, Yang W, Zhou X, Zhang J, Sun C, Chen P, Fan Y. Corn seeds as bioreactors for the production of phytase in the feed industry.,2013, 165(2): 120-126.
[21] 曹茸. 我国首度批准发放转基因粮食作物安全证书. 农业知识, 2010, 6: 49-50.
Cao R. China's first approval to issue safety certificate of genetically modified food crops., 2010, 6: 49-50. (in Chinese)
[22] Shintani D, DellaPenna D. Elevating the vitamin E content of plants through metabolic engineering., 1998, 282: 2098-2100.
[23] Zhang L, Luo Y, Zhu Y, Zhang L, Zhang W, Chen R, Xu M, Fan Y, Wang L. GmTMT2a from soybean elevates the alpha- tocopherol content in corn and., 2013, 22(5): 1021-1028.
[24] Cho E, Lee C, Kim Y S, Baek S H, Reyes B, Yun S. Expression of c-tocopherol methyltransferase transgene improves tocopherol composition in lettuce (L.)., 2005, 19: 16-22.
[25] Tavva V S, Kim Y H, Kagan I A, Dinkins R D, Kim K H, Collins G B. Increased alpha-tocopherol content in soybean seed overexpressing thegamma-tocopherol methyltransferase gene.,2007, 26(1): 61-70.
[26] Lee B K, Kim S L, Kim K H, Yu S H, Lee S C, Zhang Z, Kim M S, Park H M, Lee J Y. Seed specific expression of perilla γ-tocopherol methyltransferase gene increases α-tocopherol content in transgenic perilla ().,, 2007, 92(1): 47-54.
[27] Zhang L, Luo Y, Liu B, Zhang L, Zhang W, Chen R, Wang L. Overexpression of the maize gamma-tocopherol methyltransferase gene (ZmTMT) increases alpha-tocopherol content in transgenicand maize seeds., 2020, 29(1): 95-104.
[28] Liu X, Tian J, Zhou X, Chen R, Wang L, Zhang C, Zhao J, Fan Y. Identification and characterization of promoters specifically and strongly expressed in maize embryos., 2014, 12(9): 1286-1296.
[29] Armstrong C L, Green C E, Phillips R L. Development and availability of germplasm with High Type-II culture formation response., 1991, 65: 92-93.
[30] Hyun A K, Setyo D U, Suk Y K, Sung R M, Jin S K, Han S Y, Choi P S. The development of herbicide-resistant maize: stable-mediated transformation of maize using explants of type II embryogenic calli., 2009, 3: 277-283.
[31] Li Y, Liu X, Li J, Li S, Chen G, Zhou X, Yang W, Chen R. Isolation of a maize ZmCI-1B promoter and characterization of its activity in transgenic maize and tobacco., 2015, 34(8): 1443-1457.
[32] Markus W, Luis P, Arno F, Roland R, Michel T, Alexandra K, Anke M, Martin L, Line S, Röthlisberger U. Biochemical characterization of fungal phytases (myo-Inositol Hexakisphosphate Phosphohydrolases): catalytic properties.,1999, 65(2): 359-366.
[33] Konda A R, Nazarenus T J, Nguyen H, Yang J, Gelli M, Swenson S, Shipp J M, Schmidt M A, Cahoon R E, Ciftci O N. Metabolic engineering of soybean seeds for enhanced vitamin E tocochromanol content and effects on oil antioxidant properties in polyunsaturated fatty acid-rich germplasm., 2019, 57: 63-73.
[34] 王薇薇, 宋歌, 王丽, 周航, 董正林, 刘宽博, 王永伟, 宋丹, 李爱科. 黑龙江粮库库存玉米的营养成分、脂肪酸值和霉菌毒素含量分析. 粮油食品科技, 2019, 27(5): 69-74.
Wang W W, Song G, Wang L, Zhou H, Dong Z L, Liu K B, Wang Y W, Song D, Li A K. Analysis of nutritional content, fatty acid value and mycotoxins content of corn in Heilongjiang Grain Depot., 2019, 27(5): 69-74. (in Chinese)
[35] Humer E, Schwarz C, Schedle K. Phytate in pig and poultry nutrition.(Berl), 2015, 99(4): 605-625.
[36] Guerrand D. Chapter 26 - Economics of food and feed enzymes: Status and prospectives. In: Enzymes in Human and Animal Nutrition. Edited by Nunes C S, Kumar V: Academic Press; 2018: 487-514.
[37] 杨欢, 汤超华, 张凯. 富维生素E转基因玉米对0~3周龄肉仔鸡生产性能和抗氧化能力的影响. 甘肃农业大学学报, 2016, 194(2): 28-34.
Yang H, Tang C h, Zhang K. Effects of vitamin E-rich transgenic corn on production performance and antioxidant capacity of broilers at 0-3 weeks of age., 2016, 194 (2): 28-34. (in Chinese)
[38] 李海娜, 高仁喜, 田胜军, 刘艳. 天然维生素,生产技术现状. 湿法冶金, 2003, 22(3): 113-117.
Li H N, Gao R N, Tian S J, Liu Y. Natural vitamins, current production technology., 2003, 22(3): 113-117. (in Chinese)
[39] Che P, Zhao Z Y, Glassman K, Dolde D, Hu T X, Jones T J, Gruis D F, Obukosia S, Wambugu F, Albertsen M C. Elevated vitamin E content improves all-trans β-carotene accumulation and stability in biofortified sorghum., 2016, 113(39): 11040-11045.
[40] Wang L, Newman R K, Newman C W, Jackson L L. Tocotrienol and fatty acid composition of barley oil and their effects on lipid metabolism., 1993, 43: 9-17.
[41] Parker R, Pearce B, Clark R W, Gordon D A, Wright J. Tocotrienols regulate cholesterol production in mammalian cells by post-transcriptional suppression of 3-hydroxy-3-methylglutaryl-coenzyme A reductase., 1993, 268: 11230-11238.
Acquisition and characteristic analysis of transgenic maize with,, and
YAO XingLan, YANG WenZhu, LUO YanZhong, CHEN RuMei, WANG Lei, ZHANG Lan
(Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081)
】Corn seeds are the main feed ingredient for poultry and monogastric animals, but the content of α-tocopherol with high-activity in corn seeds is low, and maizerich, which cannot be effectively utilized by animals. Therefore, synthesized DL-α-tocopheryl acetate and phosphorus or microbial phytase are supplemented in the feed for optimal animal growth. These methods not only greatly increase the feed cost, but also cause the phosphorus pollution due to the undigested phytate. The aim of this study is to acquire maize seeds rich in α-tocopherol and high in phytase activity, and provide resources for forage maize breeding.【】Construct an expression vector with three expression cassette, and introduced into maize through agrobacterium infection method, glufosinate was used for screening; The positive transgenic plants were identified by spraying glufosinate and PCR analysis; RT-PCR analysis of target gene expression at the transcription level; Western blot analysis of target gene expression at the translation level; Phytase activity was measured by spectrophotometric method; vitamin E content was determined by HPLC. At the same time, the differences of other nutrients and agronomic traits between transgenic lines and wild types were compared.【】Constructed an expression vector with three expression cassette,driven by endosperm-specific promoter 123387,driven by embryo-specific promoter 13387,driven by constitutive promoter CaMV35S, and introduced into maize; Transgenic plants were identified by spraying glufosinate and PCR; Two transgenic homozygous maize lines TPB1 and TPB2 with good target traits were obtained after multiple generations of backcross transfer. RT-PCR and Western blot analysis showed that,andwere all highly expressed in transgenic lines. Phytase activity determination showed phytase activity reached to 10 000-13 000 U·kg-1, which is able to meet the needs of animal growth and development, vitamin E content measurement showed more than 90% of γ-tocopherol was transformed to α-tocopherol, and α-tocopherol content increased to 50-70 mg·kg-1. In addition, there were no significant differences on agronomic traits between transgenic lines and wild type, and there was no significant difference on nutrient component between TPB1 and wild type, slight difference but without adverse effect between TPB2 and wild type; and the transgenic plants were resistant to BASTA.【】These transgenic maize, which are rich in α-tocopherol and phytase, and also with herbicide resistance, can be applied for maize breeding to reduce feed cost, improve the utilization rate of phosphorus and reduce environmental pollution.
maize; phytase; vitamin E; α-tocopherol; glufosinate resistance

10.3864/j.issn.0578-1752.2020.24.002
2020-03-07;
2020-04-20
转基因生物新品种培育科技重大专项(2016ZX08003-002)
姚兴兰,E-mail:15751004149@163.com。通信作者张兰,E-mail:zhanglan01@caas.cn。王磊,E-mail:wanglei01@caas.cn
(责任编辑 李莉)
