苦参碱急性毒性试验及对小鼠血液生理生化指标影响
2021-01-04吴海港张梦瑶胡玉妍陈潇钦刘锦妮
吴海港 , 张梦瑶 , 胡玉妍 , 陈潇钦 , 刘 佳 , 刘锦妮 *
(1.信阳农林学院牧医工程学院,河南信阳 464000;2.信阳市兽药新制剂研发与创制工程技术研究中心,河南信阳 464000)
苦参碱是从豆科的槐属、野决明属及山豆根属等植物提取的生物碱。苦参碱具有多种生物活性,对机体多种器官具有调节作用,同时具有抗寄生虫、抗细菌、抗真菌及抗病毒等药理作用(吴富鑫等,2019;张明发等,2018),在畜牧生产中具有广泛的推广应用价值。冷晓红(2013)、韩欢胜等(2017)采用苦参碱治疗奶牛乳房炎取得了较好的临床效果。胡安君等(2016)报道苦参碱对PRRSV有显著抑制作用,可用于猪繁殖与呼吸障碍综合征的治疗。 Raza(2015)和 Kostadinovic等(2015)使用苦参碱治疗家禽新城疫及球虫病,治疗效果显著。
苦参碱在众多方面具有较好的生物活性,但是一些研究发现大剂量使用苦参碱可能引起中毒症状,主要以急性肝毒性、神经毒性、胃肠道反应为主,此外还可引起呼吸系统、心血管系统毒性等。研究表明,苦参碱可提高中枢神经的兴奋性递质谷氨酸水平,降低抑制性递质γ-氨基丁酸水平,还可抑制胆碱酯酶活性造成胆碱能神经兴奋,是引起癫痫样发作的生物化学机制 (梁培等,2015)。张茜等(2011)试验结果表明,苦参碱和氧化苦参碱可能对正常的肝细胞具有一定的毒性作用。杨良月(2015)对绵羊的毒理学试验表明,大剂量使用苦参碱可造成肺脏、肝脏、脑、肾脏和心脏损伤。因此,开展苦参碱安全性评价对苦参碱在畜牧生产中的应用推广至关重要。本试验对苦参碱的急性毒性及对血液生理生化指标影响进行初步评价,为下一步苦参碱的推广和研究提供理论依据。
1 材料与方法
1.1 试验动物 小鼠,雌雄各半,96只,体重(25±2)g,动物分笼饲养于信阳农林学院养殖基地,标准饲料喂养,自由摄食和饮水,室温(22±2)℃,湿度(70±5)%。
1.2 主要药品与设备 苦参碱 (含量≥98%,陕西滕迈生物科技有限公司提供);迈瑞BC-2600全自动血细胞分析仪 (武汉凯典瑞医疗科技有限公司);Animal-3000型动物生化分析仪 (济南格利特科技有限公司)。
1.3 试验方法
1.3.1 半数致死量的测定 预试验:在实验室中,将温度控制在(22±2)℃,试验时,应提前禁食 12 h,禁水2 h。然后,取小鼠20只,随机平均分成5组,分别按不同剂量灌胃给药,给药后,给予其正常饮水和进食,确定其绝对致死剂量与最大耐受剂量,为正式试验做准备。
正式试验:在实验室中,将温度控制在(22±2)℃,试验时,应提前禁食12 h,禁水2 h。然后,取小鼠40只,随机平均分5组,根据一定的组间剂量比,每组按一定的剂量采用灌胃给药。给药后,给予其正常饮水和进食,并连续观察5 d。隔一定时间观察并记录小鼠的症状、生理状态和死亡情况,根据每组死亡数量,最后算出半数致死量(改良寇氏计算法)。
1.3.2 血常规指标和血液生化指标的测定 选用健康、体重均匀的小鼠36只,随机均分成4组,根据半数致死量结果,分高、中、低(5、2、0.5 mg/mL)三个剂量组对小鼠进行灌胃给药,对照组以等量生理盐水进行灌胃。每天给药一次,每次每只灌胃0.5 mL,连续灌胃14 d。每天观察并记录小鼠健康状况,活动、采食、饮水、排泄物、发病和死亡等。分别于第7天和第14天采用眼眶采血法进行采血,进行血液生理和生化检测。
检验项目包括:红细胞(RBC)、白细胞(WBC)、红细胞压积(HCT)、血红蛋白(HGB)、血小板总数(PLT)等血常规指标和丙氨酸转移酶(ALT)、碱性磷酸酶(ALKP)、肌酐(CREA)、尿素(UREA)、总蛋白(TP)、血糖(GLU)等血液生化指标。
1.4 数据的统计分析 采用SPSS 18.0进行单因素方差分析,用LSD法进行多重比较,结果均以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果
2.1 急性毒理试验结果 小鼠试验观察结果表明,高剂量组(500 mg/kg)灌胃 3 min后,神经症状,四肢无力,精神不济,出现抽搐倒地,全身震颤;约5 min后全部死亡。350、245、171.5 mg/kg剂量组小鼠灌胃后3~5 min均出现肌肉抽搐,乱跑乱跳,痉挛,钻地扎堆等现象。120.05 mg/kg剂量组灌胃给药后出现轻微神经症状,轻度肌肉抽搐,精神沉郁,身体蜷缩,钻地扎堆,约2 h后精神恢复正常,未有死亡状况出现(表1)。未死亡小鼠1 d后精神活动均恢复正常。苦参碱经口灌服半数致死量LD50为245.0191 mg/kg,其95%置信区间为201.56 ~297.92 mg/kg。
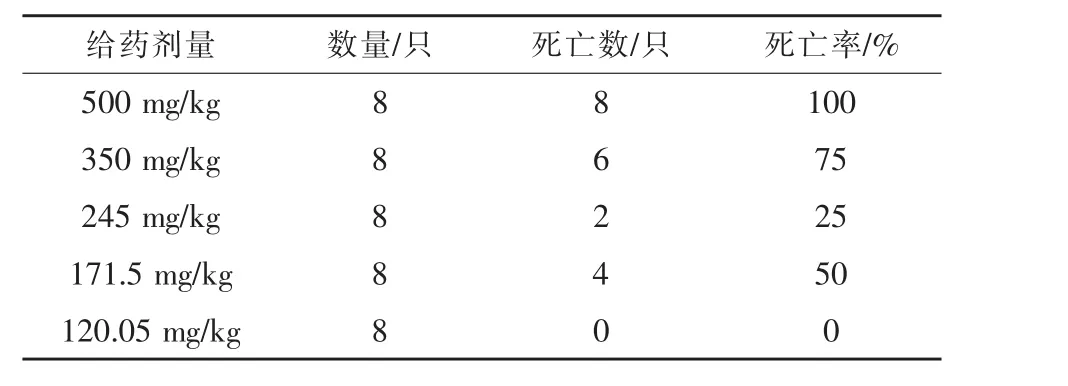
表1 苦参碱对小鼠急性毒性试验结果
2.2 苦参碱对小鼠血常规指标和血液生化试验结果
2.2.1 苦参碱对小鼠血液生理学试验结果 由表2可知,给药7 d后,与对照组相比,各试验组中白细胞总数、淋巴细胞、中间细胞和血小板总数降低,差异显著(P<0.05),粒细胞、红细胞总数和血红蛋白数量升高,差异显著(P<0.05)。其中中剂量组中各项指标升高或者降低程度最为明显。各试验组相比,中剂量组中白细胞总数、淋巴细胞和中间细胞数量显著低于低剂量组和高剂量组(P<0.05),而低剂量组和高剂量组中各项指标差异不显著(P>0.05)。给药14 d后,各试验组中血小板数量降低最明显。低剂量组血液中白细胞总数、中间细胞、粒细胞显著高于对照组(P<0.05),而淋巴细胞、红细胞总数、血红蛋白和血小板总数显著低于对照组(P<0.05)。 中剂量组血液中各项指标显著低于对照组(P<0.05)。和第7天相比,低剂量组中白细胞总数、淋巴细胞、中间细胞、粒细胞显著升高,红细胞总数、血红蛋白和血小板总数显著降低(P<0.05),而中剂量组和高剂量组中各项生理指标总体呈降低趋势。
2.2.2 苦参碱对小鼠血液生化学试验结果 由表3可知,给药7 d后,中剂量组和高剂量组中ALKP、UREA、TP含量较对照组显著增高 (P<0.05),其中高剂量组中ALKP和TP分别是对照组的1.96倍和2.18倍。ALT和GLU含量低于对照组,差异显著(P<0.05)。低剂量组中除CREA和TP外,其他各项指标显著降低(P<0.05)。各试验组相比,中剂量组中各项指标变化最为明显。给药14 d后,各试验组中ALKP和GLU含量显著低于对照组(P<0.05),低剂量组和中剂量组中ALT、UREA、CREA、TP 的 含量 显著升高 (P <0.05)。各试验组相比,高剂量组中各项指标呈下降趋势,其中ALKP和CREA含量差异显著(P<0.05)。 和第 7天相比,血清中 ALKP、GLU、TP 呈下降趋势,ALT、CREA、UREA呈升高趋势。
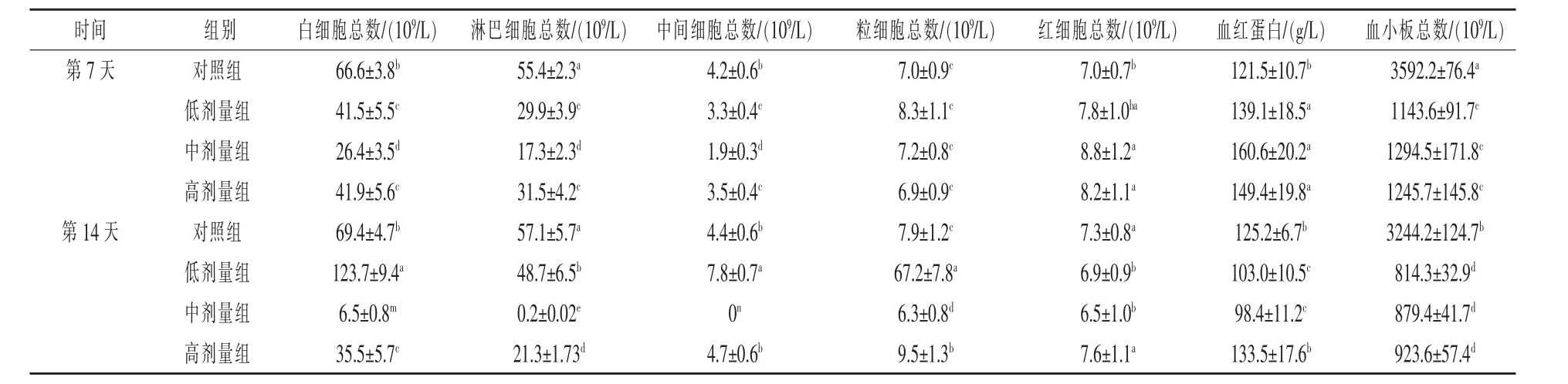
表2 苦参碱对小鼠血液生理指标的影响
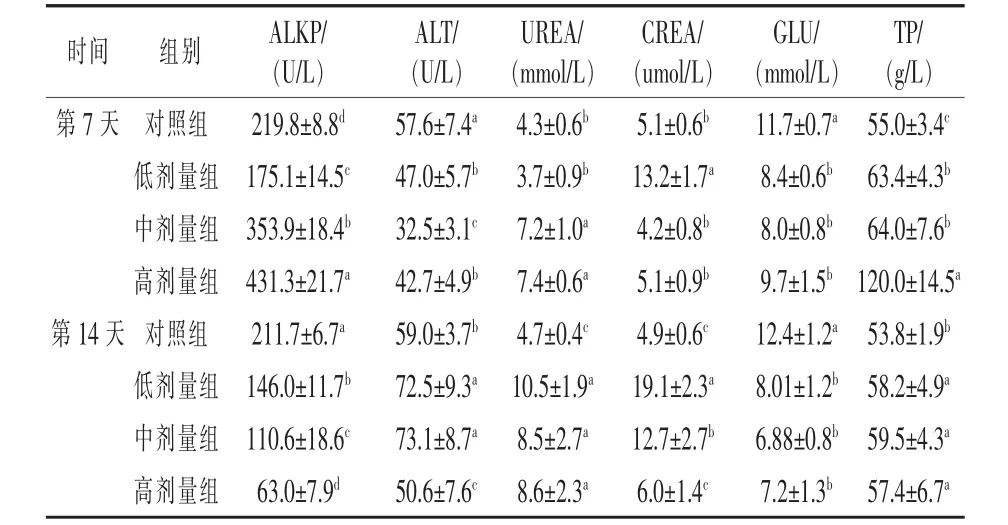
表3 苦参碱对小鼠血液生化指标的影响
3 讨论
急性毒性试验是评价药物及其制剂安全性的重要指标,可以根据急性毒性试验结果判断药物的毒性大小及其作用的靶器官,并且为亚急性、慢性毒性试验设计提供依据。LD50是评价急性毒性的重要指标。杨良月等(2015)报道,苦参碱小鼠灌胃的LD50为570.26 mg/kg,其95%置信区间为487.45 ~ 635.78 mg/kg。 张宏利等(2005)研究表明,苦参碱小鼠灌胃的LD50为64 mg/kg。贝宇飞等 (2012)对小鼠腹腔注射苦参碱得出的LD50为92.56 mg/kg。本试验结果显示,苦参碱小鼠灌胃的LD50为 245.0191 mg/kg,其 95%置信区间为201.5580~297.9202 mg/kg。表明药物LD50大小与给药途径、剂型、药物纯度等因素有关。此外,本试验过程中发现小鼠灌服苦参碱后,大部分小鼠会出现强直性痉挛,肌肉震颤等毒性反应,时而会出现上窜下跳,身体蜷缩,喜扎堆等反应,可见苦参碱毒性会作用于神经系统。这与田雪松等(2016)报道结果相一致,其原因可能是由于大量使用苦参碱后,会抑制体内胆碱酯酶的活性。
血液生理指标、生化指标是评价机体和组织器官病变的重要指标。丙氨酸转移酶和碱性磷酸酶是评价肝是否损伤的指标,肌酐和尿素是评价肾是否损伤的指标。总蛋白、血糖可反映体内蛋白质含量与血液中葡萄糖浓度(戴五好等,2015)。本试验结果显示,使用苦参碱能够提高血液中红细胞、粒细胞的数量,减少血小板总数,且与药物浓度呈负相关,与用药次数呈正相关。此外,剖检小鼠发现,体内组织中有大量充血和出血现象,表明苦参碱产生的毒性反应会引起小鼠体内产生炎症或局部感染,这和宋兵(2009)、刘学楠等(2019)报道的苦豆子提取物的毒性相似。 研究表明,苦参碱能够显著升高血清ALT、AST含量,降低SOD、MDA、GSH 含量,导致肝毒性(郭秋平,2016;李素君,2011)。本试验结果显示,给药7 d后,中剂量组和高剂量组中 ALKP、UREA、TP含量显著增高,ALT和GLU含量呈下降趋势,而给药14 d后,各试验组中ALKP和GLU含量下降,ALT、UREA、CREA、TP的含量升高。表明苦参碱能够引起肝脏和肾脏毒性,其呈现毒性-时间-浓度正相关。这与李素君(2011)的试验结果相一致,说明苦参碱毒性靶器官主要是肝脏、肾脏和神经系统。其毒性机制有待进一步研究。
4 结论
本试验结果表明,苦参碱经口灌服半数致死量 LD50为 245.0191 mg/kg,其 95%置信区间为201.5580~297.9202 mg/kg,属中等毒性物质。苦参碱能够升高血液中红细胞、粒细胞的数量,降低血小板总数。 血清中 ALKP、GLU、TP、ALT、CREA、UREA总体呈现升高趋势,且与药物剂量、给药时间呈正相关。
