长链非编码RNA LINC01116靶向调控has-miR-4693-3P参与胶质瘤进程
2021-01-04杨力侠
鲍 红,杨力侠,高 敏*
(1.西电集团医院,陕西西安710077;2.西安外事学院,陕西西安710077)
胶质瘤(Gliomas)起源于神经上皮,由于血管丰富,生长快,易受正常脑组织侵犯,临床预后较差,复发率高,对放疗、化疗耐药,仍是世界范围内导致癌症相关死亡的主要原因[1-3]。加之胶质瘤的发生具有复杂的生物学特性,涉及一系列的病理生理变化,以及多种基因和信号通路的表达变化,使得胶质瘤的临床治疗效果较差[2-4]。目前对于介导脑胶质瘤发生的分子机制还没有明确的结论。因此迫切需要探索新的治疗靶点成功干预胶质瘤。
长链非编码RNA(longnon-coding RNAs,LNCRNAs)[5-9]是ncRNA家族的一员,其长度超过200个核苷酸,具有较低的小分子多肽编码能力。越来越多的研究表明,lncRNA在人类癌症中起着重要的作用,包括肝癌(HCC)[6]、胶质瘤[7]等。异常的lncRNAs广泛参与神经胶质瘤的肿瘤发生,调节胶质瘤的增殖、凋亡、侵袭和转移[5-9]。lncRNAs不仅可以作为胶质瘤诊断的重要标志物,而且可作为胶质瘤患者重要的预后指标[7-9]。
LncRNA长基因间非蛋白编码RNA0116(LINC01116),位于2号染色体,其在乳腺癌[10],骨肉瘤[11]、前列腺癌[12]等中已有报道,对多种癌症的生物学过程具有积极的影响,尤其在细胞增殖、迁移、侵袭等方面[10-14]。然而,LINC01116在胶质瘤中的作用还有待探索。本研究旨在探讨LINC01116在胶质瘤组织细胞中的表达增殖、侵袭与迁移,及可能存在的调控机制,为脑胶质瘤的早期诊断和治疗提供新的靶点。
1 材料与方法
1.1 细胞培养及主要试剂
人胶质瘤细胞株U87MG、U251、A172购自中国科学院细胞库(上海),正常的人类星形细胞(NHAs)为本实验室保存。细胞培养于RPMI 1640(hyclone)+0.1%青霉素/链霉素+10%胎牛血清(FBS)(Gibco)的培养基中,于37℃、5%CO2湿化培养箱中培养,待细胞融合度达到80%以上用于后续实验,根据说明书使用Lipofectamine 2000(Invitrogen)试剂细胞的转染。has-miR-4693-3P minics购自generalbiol公司,LINC01116干扰质粒sh-LINC01116、LINC01116过表达质粒pcDNA3.1-LINC01116、野生型及突变型LINC01116报告基因质粒(pmirGLO-LINC01116-WT,mirGLO-LINC01116-MUT)均由实验室构建。TRIzol试剂(Invitrogen,美国),PrimeScriptRT试剂盒(Takara,日本)、TURBODNA-freeTMKit(Invitrogen,美国),SYBR Green PCR Master Mix(Takara,日本),CCK8试剂盒(APExBIO,美国),Nucleiez lysis Buffer(sigma,美国)。
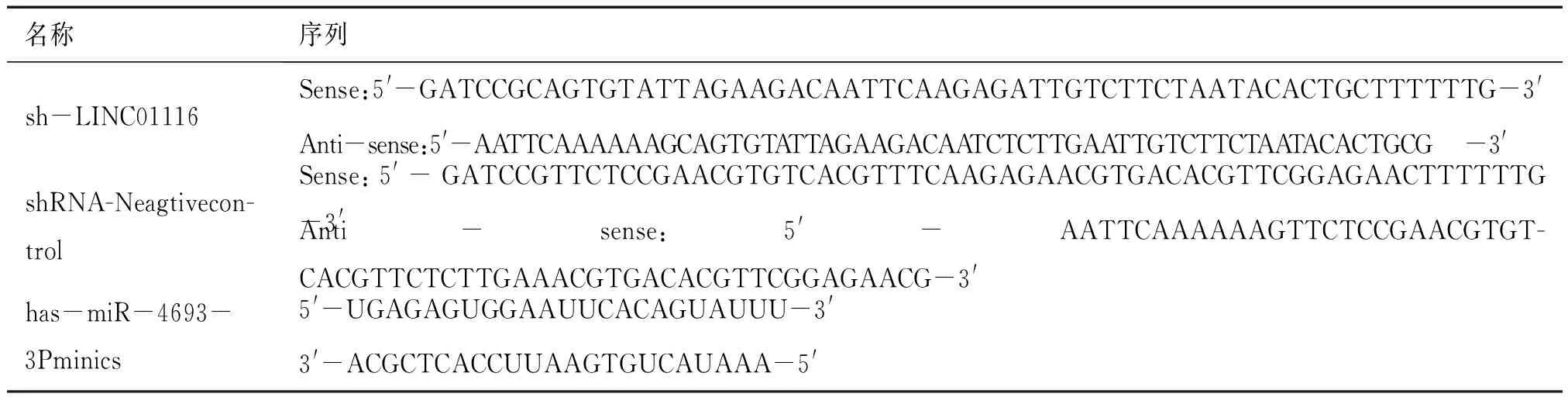
表1 基因序列
1.2 荧光定量PCR(qRT-PCR)
采用TRIzol试剂按照说明书从不同处理的培养细胞中提取总RNA,并使用Prime ScriptTMRT Master Mix的说明书进行逆转录。利用SYBR Green PCR Master Mix在ABI7500 Fast Real-Time PCR系统上进行qRT-PCR扩增,GAPDH及U6作为内参,根据2-ΔΔCt法比较相对表达量。所用引物如表2所示。
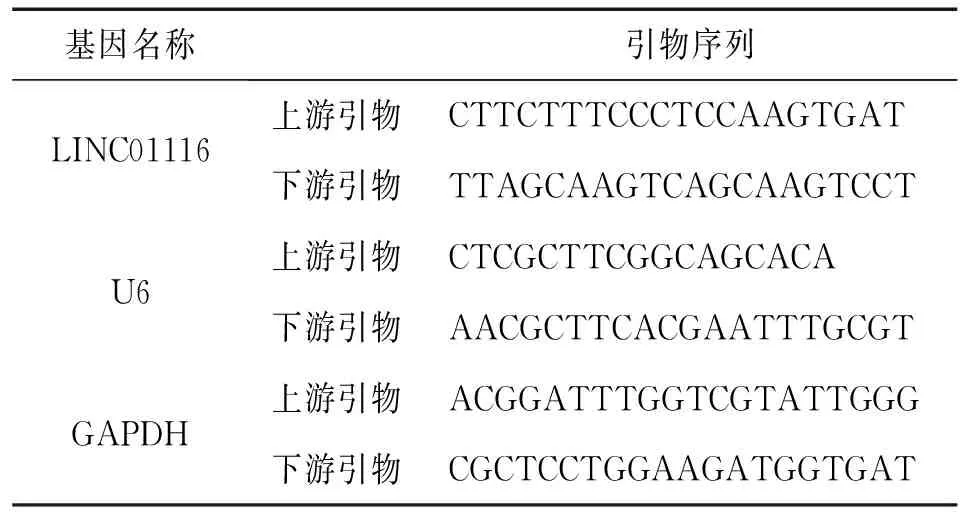
表2 使用的qRT-PCR引物
1.3 细胞增殖、迁移和侵袭试验
细胞增殖采用CCK8法[15]进行,U251与U87MG细胞中shRNA转染12 h后,细胞以每孔2×104个细胞的密度接种于96孔板中,以含10%胎牛血清DMEM培养液进行培养,转接后培养时间为0、24、48、72、96h使用细胞计数试剂盒-8(CCK8试剂盒,日本同仁)检测细胞增殖,所有的检测都至少重复三次。
细胞迁移实验采用细胞划痕法测定,先用记号笔在6孔板后用直尺画线,6孔板中加入约2×105个U251细胞,过夜培养后用10 μL枪头用力均匀的在培养皿中划痕,加入无血清培养液培养箱中培养,24 h后拍照比较分析。
侵袭实验采用Transwell法进行[16],用康宁Transwell预涂基质凝胶进行侵袭试验。shRNA转染24 h后,取200 μL DMEM的细胞悬液悬浮3×104个细胞加入24孔Transwell小室,700 μL DMEM(含有10%FBS)添加24孔板下室。在Transwell系统中37℃孵育24 h后,用棉签取出膜上表面的细胞,用4%甲醛固定膜下表面的细胞,用0.1%结晶紫过滤。随机选取5个视野中的染色细胞,在荧光显微镜下进行统计分析。
1.4 亚细胞分离
为了探索LINC01116参与胶质瘤细胞增殖的分子机制,我们首先利用RNAlocate分析了LINC01116在胶质瘤细胞中的分布。然后使用sigma的细胞核裂解缓冲液分离纯化细胞质RNA和核RNA,具体参照说明书操作。如前所述,采用qRT-PCR检测LINC01116在核内和胞内的表达,分别以U6及GAPDH为参照。
1.5 双荧光素酶报告基因检测
实验方法参照文献[12-13]进行,将HEK-293T细胞接种于96孔板中,每孔接种密度为104个细胞左右,第2天将40 nmol/L miR-control或者has-miR-4693-3P minic、0.2 μg pmirGLO-LINC01116-WT或pmir-GLO-LINC01116-MUT分别共转染,重复3个复孔。48 h后每孔加入1×passive溶解缓冲液50 μL,室温摇床孵育20 min后分别依次加入30 μL裂解液及100 μL荧光素酶缓冲液,多功能酶标仪检测每个孔中萤火虫荧光素酶活性值。每孔再次加入10 μL Stop & GLO,多功能酶标仪读取海肾荧光素酶活性值。荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值,统计分析。
1.6 统计学方法及生物学方法

athena-innovation.gr/index.php?r=lncbasev2)和miRDB(http://mirdb.org/)预测LINC01116可能结合的目标microRNA。
2 实验结果
2.1 LIN01116在胶质瘤中高表达
qPCR实验结果显示,较之NHA细胞,LINC01116在人胶质瘤细胞系(U87MG、U251、A172)中显著升高(见图1,P<0.01),这提示LINC01116的高表达与胶质瘤的发生相关。
2.2 LINC01116基因的下调可抑制胶质瘤细胞的增殖、侵袭与迁移
在U251、A172、U87MG细胞中,以sh-NC为阴性对照,转染LINC01116特异性的shRNA(sh-LINC01116)。qRT-PCR检测结果显示LINC01116表达被shRNA明显抑制(见图2A,P<0.01)。CCK-8实验显示,sh-LINC01116可抑制U87MG和U251细胞的增殖(见图2B,2C,P<0.05)。细胞划痕实验显示,shRNA处理的U251细胞迁移能力明显低于对照组的(见图2D,P<0.01),Transwell实验结果显示,shRNA处理的U251细胞穿膜细胞数明显低于对照组(见图2E,P<0.01)。
2.3 LINC01116基于ceRNA调控机制
qPCR鉴定LINC01116在细胞质与细胞核中的分布,结果表明LINC01116在细胞质和细胞核中均有分布,但细胞质中LINC01116的比例远高于细胞核中LINC01116的比例(见图3A),因此,LINC01116可能通过在胶质瘤细胞的细胞质中作为ceRNA发挥其促癌作用。miRDB和LncBasev.2预测LINC01116可能潜在靶向位点miRNA为has-miR-4693-3P(见图3B)。双荧光素酶报告基因实验结果显示,has-miR-4693-3P可以降低pmirGLO-LINC001116-WT的荧光素酶活性,但不能改变pmirGLO-LINC001116-MUT的荧光素酶活性(见图3C,P<0.01)。这表明has-miR-4693-3P可以通过识别特定位点直接与LINC001116结合。此外,CCK-8法测定has-miR-4693-3P和LINC01116在促进胶质瘤细胞生长的相互作用,结果显示has-miR-4693-3P抑制U251和U87MG细胞生长,而当共转染has-miR-4693-3P和pcDNA3.1-LINC01116,has-miR-4693-3P的生长抑制作用得到逆转(见图3D,3E,P<0.05)。这些结果表明,LINC01116通过作为has-miR-4693-3P促进胶质瘤细胞的生长。
3 讨论
胶质瘤是最常见的原发颅内肿瘤,占恶性脑瘤的81%,由于预后不良,它具有侵袭性[1,3]。成像是诊断胶质瘤的有效方法[17],而分子治疗仍是胶质瘤的主要治疗方法[18]。本研究主要探讨胶质瘤发生发展的新分子途径。越来越多的证据表明,长链非编码RNA的异位表达在肿瘤的生物学过程中起着重要的作用[7-9]。LINC01116可促进前列腺癌[11]、骨肉瘤[12]、乳腺癌[10]、卵巢癌[19]的进展。但其在胶质瘤细胞中的作用还有待探究。
本文讨论了LINC01116在多种胶质瘤细胞中的表达,结果发现LINC01116在胶质瘤细胞系中均高表达,这提示LINC01116可能是一个与胶质瘤发生相关的lncRNA。已有研究表明[19-21],LINC01116促进了癌症细胞活性,主要涉及细胞增殖、迁移周期与凋亡等。本文根据干扰实验证实了LINC01116基因的下调可以抑制胶质瘤细胞的增殖,抑制侵袭与迁移。因此,我们证实上调的LINC01116与胶质瘤的发生相关。
越来越多的研究表明,lncRNA可以作为ceRNA发挥作用。例如,Chen,等[20]的研究表明,CDKN2BAS通过microRNA-153-5p(miR-153-5p)上调RhoGTPase活化蛋白18(ARHGAP18)的表达,从而促进肝癌细胞的迁移;Fang,等[21]人认为lncRNAHNF1A-AS1通过调节miR-34a/SIRT1/p53的表达,发挥ceRNA的作用,促进了结肠癌的转移进展。然而,LINC01116是否通过调节miRNAs影响胶质瘤进展尚未见报道,本文中我们通过胶质瘤细胞亚细胞定位分析LINC01116的分布,确定LINC01116主要分布于细胞质中,这提示LINC01116可能通过ceRNA机制参与调控胶质瘤进程,miRDB和LncBasev.2软件分析LINC01116可能作用的miRNA,结果发现has-miR-4693-3P与LINC01116具有很高的匹配度,双荧光素酶报告基因鉴定及细胞活性实验进验证了has-miR-4693-3P与LINC01116的相互作用,结果提示LINC01116通过has-miR-4693-3P促进胶质瘤细胞的生长。总之,本文研究结果表明LINC01116在胶质瘤细胞中高表达、参与了胶质瘤细胞的增殖、迁移及侵袭等,并通过ceRNA机制参与胶质瘤进程,这将为LINC01116作为新的胶质瘤的诊断和预后标志物提供了理论依据。
