国内外兽用生物制品无菌检验方法的比较分析
2021-01-01李俊平罗玉峰
刘 博,魏 津,马 欣,王 甲,李俊平,罗玉峰
(中国兽医药品监察所,北京 100081)
无菌检验是兽用生物制品质量控制的重要检验项目,关系到兽用生物制品的安全性,准确的检验结果不仅能够客观公正地评价相关制品的质量,还能够为生产企业提供技术参考,为行业监管和行政决策提供坚强的依据[1]。提高无菌检验敏感性,降低无菌检验操作难度,进一步优化现有无菌检验方法不仅可为行业内兽用生物制品生产企业提供便利,还可进一步保障兽药安全、促进养殖业发展。本文从无菌检验的依据、培养基及培养条件、培养基质量控制、无菌检验的具体方法几个方面,对国内外主流兽用生物制品无菌检验方法进行比较分析,以探讨影响无菌检验结果的因素,为无菌检验方法的优化提供参考。
1 无菌检验依据
中国兽用生物制品无菌检验依据现行《中国兽药典》2020年版三部[2];欧盟国家兽用生物制品无菌检验依据《欧洲药典》10.0版[3],且人药和兽药无菌检验遵循一致依据;美国兽用生物制品无菌检验依据《美国联邦法规》第九卷(9CFR)[4],而人药无菌检验依据《美国药典》第19版,但是9CFR中明确规定,无菌检验培养基的质量控制需遵守《美国药典》相关规定。
2 无菌检验培养基及培养条件
2.1 培养基种类 现行《中国兽药典》《欧洲药典》及9CFR中无菌检验培养基相同之处在于均使用两种常规培养基,分别是硫乙醇酸盐流体培养基(TG)及胰酪大豆胨液体培养基(TSB)。其中,TG培养基主要用于厌氧菌和需氧菌的检查,TSB培养基主要用于真菌及需氧菌的检查。
2.2 培养基配方 现行《中国兽药典》《欧洲药典》及9CFR中无菌检验培养基的配方有所区别。《中国兽药典》TG和TSB培养基配方唯一。《欧洲药典》中TG培养基有两种,一种与中国兽药典中所列TG培养基配方一致,另一种省略了琼脂和刃天青溶液。9CFR中TG培养基有两种,一种与中国兽药典中所列TG培养基配方一致,另一种额外添加了0.5%牛肉膏。此外,《中国兽药典》另使用酪胨琼脂培养基(GA)用于需氧菌的检查,9CFR中另使用脑心浸液琼脂用于真菌和需氧菌的检查。
2.3 培养条件 《中国兽药典》中规定,TG及GA培养基的培养温度是35~37 ℃及23~25 ℃,TSB培养基的培养温度是23~25 ℃;欧洲药典规定TG培养基的培养温度是30~35 ℃,TSB培养基的培养温度是20~25 ℃,对于含汞类防腐剂的兽用生物制品,用TG替代TSB置于20~25 ℃培养;9CFR规定TG培养基的培养温度是30~35 ℃,TSB培养基的培养温度是30~35 ℃或者20~25 ℃,对于含汞类防腐剂的兽用生物制品,用TG替代TSB置于20~25 ℃培养。三种方法版本的无菌检验用培养基及培养温度见表1。

表1 无菌检验用培养基及培养温度Tab 1 Culture media and culture temperature of sterility test
3 无菌检验培养基质量控制
国内外无菌检验培养基质量控制的要点均为无菌检验和微生物促生长能力。
3.1 无菌检验 《中国兽药典》要求将三种培养基均分别置于35~37 ℃及23~25 ℃培养7 d,《欧洲药典》及9CFR要求将TG和TSB分别置于30~35 ℃及23~25 ℃培养14 d,未发现有菌生长后方可使用。对于抽检比例,《中国兽药典》规定每批培养基随机抽取10支(瓶),《欧洲药典》及9CFR仅要求抽取部分培养基进行无菌检验,具体数量未做要求。
3.2 微生物促生长能力 《欧洲药典》及9CFR使用6株质控菌种控制培养基质量,菌种代次不得超过5代;《中国兽药典》使用5株质控菌种,与《欧洲药典》及9CFR相比少一株枯草芽孢杆菌,质控菌种代次无具体要求。《欧洲药典》及9CFR具体规定如下:取不超过100 CFU的金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌菌种悬液分别接种TG培养基,于30~35 ℃培养不超过3 d;取不超过100 CFU的白色念珠菌、巴西曲霉、枯草芽孢杆菌菌种悬液分别接种TSB培养基,于20~25 ℃培养不超过5 d;若有菌生长,则培养基微生物促生长能力符合要求。《中国兽药典》中规定,取不超过50 CFU的金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌菌种悬液分别接种TG培养基,于35~37 ℃培养3 d;取不超过50 CFU的金黄色葡萄球菌、铜绿假单胞菌菌种悬液分别接种GA培养基,于35~37 ℃培养3 d;取不超过50 CFU的白色念珠菌、巴西曲霉菌种悬液分别接种TSB培养基,于23~25 ℃培养5 d;若有菌生长,则培养基微生物促生长能力符合要求。质控菌种信息见表2。
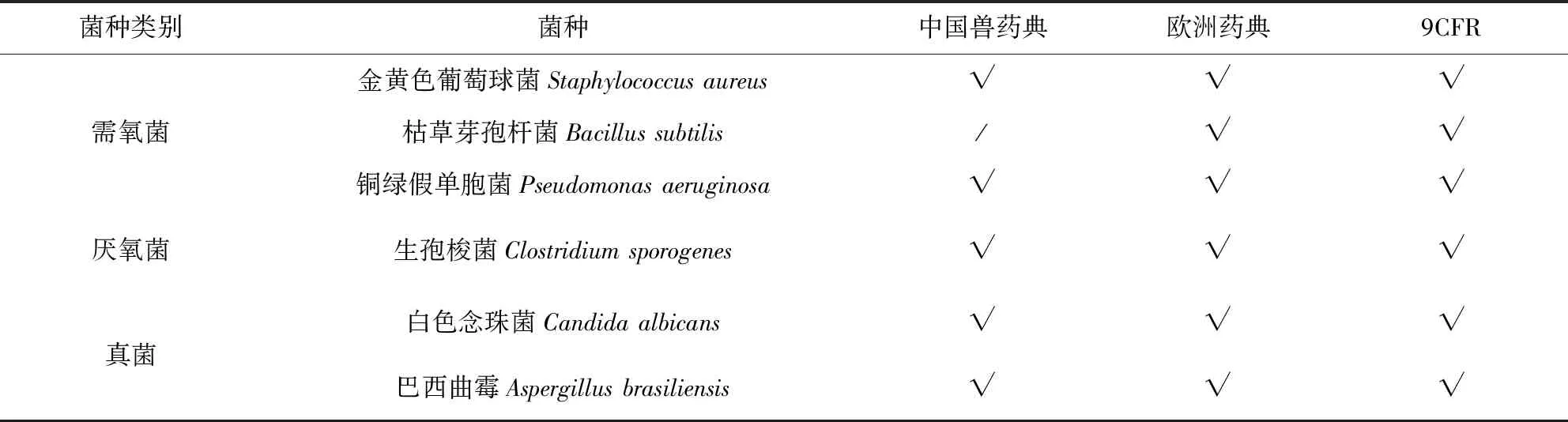
表2 微生物促生长能力试验质控菌种表Tab 2 Strains of the test micro-organisms suitable for use in the growth promotion test and the method suitability test
其他常规质量控制参数中,《欧洲药典》关于TG培养基装量有特殊要求。TG培养基由于分为氧化层和厌氧层,要求储存于密闭无菌容器内,且培养基的上层表面积和深度之间需要遵循一定比例,保证在培养结束时,培养基氧化层在培养基高度的一半以内。《中国兽药典》与9CFR无上述要求。
4 无菌检验方法适用性检测
《欧洲药典》要求,对新制品进行无菌检验时或者检验方法有更改时,需进行方法适用性检测(与检品的无菌检验同时进行)。
4.1 膜过滤法适用性检测 在将待检样品转移至滤膜过滤后,在用于洗涤滤器的无菌稀释液中加入不超过100 CFU的质控菌种。
4.2 直接接种法适用性检测 在将待检样品接入培养基后,在培养基内加入不超过100 CFU的质控菌种。两种方法适用性检测均需用表2中所列的6种菌种分别进行。将所有的样品在适宜温度培养不超过5 d。如果待检样品管内质控菌种生长状态与阳性对照一致,则说明该样品在当前检验方法下无抗菌活性或者其抗菌活性已经被中和且符合要求,该方法可以直接应用;如果与阳性对照相比,待检样品管内质控菌种未见明显生长,则说明该样品的抗菌活性在当前方法下未被成功中和,当前方法需要进行修改并重新进行适用性检测。
5 无菌检验操作方法
《中国兽药典》和9CFR中,兽用生物制品无菌检验只有直接培养法,样品的最小抽检量和最小取样量均需遵循表3规定。
《欧洲药典》中,无菌检验用到的方法分别为膜过滤法和直接培养法。对于具体方法的选择,《欧洲药典》规定如下:只要检品性质允许,在当前使用方法下无抗菌活性,均使用膜过滤法[5]。不论选择哪种方法,样品的最小抽检量和最小取样量均需遵循表4和表5规定。

表4 《欧洲药典》样品最小抽检量Tab 4 Minimum number of items to be tested in EP

表5 《欧洲药典》样品最小取样量Tab 5 Minimum quantity to be used for each medium in EP
5.1 膜过滤法 选择滤膜孔径不超过0.45 μm、截留微生物能力被验证过的、滤膜直径大小为50 mm的膜式过滤器。水溶性制品、油性制品以及稀醇制品选择硝酸纤维素滤膜;浓醇制品选择醋酸纤维素滤膜。如果改变滤膜直径,稀释液以及洗液的体积也需相应调整。过滤装置和滤膜须保证自身无菌,且样品在无菌条件下通过过滤装置过滤,膜需要在无菌条件下取出并且放置于培养基内,或者可直接在无菌条件下将培养基加入到过滤装置中并培养。
5.2 直接培养法 《中国兽药典》《欧洲药典》及9CFR中无菌检验均涉及直接培养法,但具体操作有所差别,此部分主要阐述各标准中培养法的差异。
5.2.1 《中国兽药典》直接培养法 样品按表3进行抽样后,半成品直接接种TG、TSB、GA小管培养3~7 d后判定结果。成品样品经过50 mL TG小瓶增菌3 d,再移植至TG、TSB、GA小管继续培养7 d后判定结果。
5.2.2 《欧洲药典》直接培养法 按照表4及表5进行抽样,取适量的样品直接接种于培养基,除非有特殊规定,样品接种量不低于培养基体积的10%。如果待检样品有抗菌活性,需用适宜中和剂中和其抗菌活性或者将样品接入足够量的培养基中以达到稀释的作用。如果样品的量大,则使用经过浓缩的、后续需稀释的培养基就更为合适。如果有必要,可以直接将浓缩的培养基加到样品的容器中。将接种样品后的培养基培养不少于14 d。在培养期间观察培养基。油苗需每天轻轻摇晃,但是需要注意为了保证硫盐培养基的厌氧环境,摇晃培养基的频率和振幅需控制在最小。
5.2.3 9CFR直接培养法 含0.5%牛肉膏的TG培养基、TSB培养基用于含梭菌类毒素、菌苗、以及菌苗-类毒素制品的无菌检验;含或者不含0.5%牛肉膏的TG培养基、TSB培养基用于其他灭活苗、细胞系、原代细胞及动物源材料的无菌检验。
病毒类活苗、原始毒种的无菌检验选用TSB培养基(检测细菌和真菌生长均用TSB,培养温度上进行区分)。需要保证样品可能带有的抑菌或者抑真菌活性被中和。
细菌类活苗、原始菌种的无菌检验选用TG(检测细菌)和TSB(检测真菌)培养基。冻干制品需按照瓶签注明的头份/羽份数用随样品携带的稀释液或者无菌纯水复溶。推荐每1000 头份/羽份疫苗用30 mL水复溶。
除注射外其他给药方式的鸡胚源活疫苗,未检测或者按照常规活苗检验方法检测有菌生长时,选择每毫升含500 Kinetic (Kersey)单位青霉素的脑心浸液琼脂平皿进行检验。
6 讨 论
6.1 无菌检验的依据 无外源细菌和真菌污染,是兽用生物制品安全应用的重要保障。无菌检验作为检测制品是否污染外源细菌和真菌的检验参数,存在于所有兽用生物制品的质量标准中(《中国兽药典》细菌类活苗中为纯粹检验)[6]。无菌检验方法敏感性的高低,直接决定结果的准确性。中国和美国对于兽用生物制品的无菌检验均有单独的规定且区分于人用药品,而欧盟国家对于兽药和人药的无菌检验依据是一致的。考虑到检验成本、适用对象、产品工艺及剂型差别,适当的区分更有利于检验技术的推广和开展。
6.2 无菌检验培养基的质量控制 无菌检验培养基的质量直接影响无菌检验结果。培养基质量的关键在于微生物促生长能力,《中国兽药典》中检验方法与国外最大的区别在于用于TSB培养基质量控制的质控菌株只有白假丝酵母菌和巴西曲霉,少一株枯草芽孢杆菌。由于TSB培养基应用目的是检测需氧菌和真菌的生长,因此使用枯草芽孢杆菌作为检测TSB培养基促进需氧菌生长能力的质控菌株是有必要的。对于微生物促生长能力的检测限,国外为培养基需检出100 CFU的质控菌,而我国规定需能检出50个CFU的质控菌,从这个角度来说,我国对于培养基质量要求相对更高。自身无菌也是控制无菌检验培养基质量的重点,国内与国外方法在这方面的差别在于培养时长,《中国兽药典》中规定培养7 d,国外方法要求14 d。《美国药典》和《欧洲药典》分别于2000年和1998年将培养基的无菌检验周期从7 d修改为14 d,原因在于考虑到7 d的周期可能无法检测到部分“生长缓慢”的微生物,这为我国无菌检验培养基质量控制提供了参考。此外,对于培养基的抽样比例也有所区别。《中国兽药典》规定每批次培养基随机抽取10 支(瓶)进行检验,《美国药典》和《欧洲药典》规定抽取部分培养基进行检验,未明确具体抽检数量。
6.3 无菌检验培养基种类及培养条件的选择 《中国兽药典》对于无菌检验培养基的选择比较单一,而《欧洲药典》和9CFR对于无菌检验培养基均做过适当调整,使培养基可以更适合于当前样品的培养。《欧洲药典》和9CFR中TG及TSB培养基常规培养温度比《中国兽药典》中规定的温度略低,基于无菌检验的目的主要是检测生产过程中可能污染的环境杂菌,此类杂菌可适应30~35 ℃以及20~25 ℃的培养条件,然而不同培养温度对方法敏感性的影响还有待研究。《中国兽药典》内无菌检验培养基装量恒定,《欧洲药典》和9CFR内无菌检验培养基装量根据检品不同而不同。理论上来说,充足的培养基更有利于潜在污染菌的生长。考虑到TG培养基的特性,《欧洲药典》特地对其装量表面积和深度有所规定,是为了保证检验结束时,培养基内仍能保证需氧和厌氧两个环境,对于潜在污染菌的检出是值得借鉴的规定。9CFR中对于不同制品,培养基和培养条件均有差别。比如对于病毒类活疫苗,就不再选用TG培养基。这一点可能基于病毒活疫苗生产过程中培养基和培养方式,不利于厌氧菌的生长,且有利于营养苛求需氧菌的生长,故选用TSB培养基在30~35 ℃培养以检出样品中潜在污染菌。对方法的细化有利于提高无菌检验方法的敏感性和准确性。近年来在检验过程中发现,TSB培养基无法检出组织源制品中污染营养苛求菌(如副猪嗜血杆菌、链球菌等),导致制品出现“假阴性”结果;或者因组织强毒污染导致无法客观评价被检疫苗的免疫效力。筛选出营养特性好的培养基用于特殊样品的检验非常值得深入研究。
6.4 无菌检验方法 对于具体无菌检验方法的选择,除《欧洲药典》中列出且首选膜过滤法外,《中国兽药典》和9CFR对于兽用生物制品均选用直接培养法[7]。直接培养法从仪器设备、操作难度、经济成本方面来说都是优于膜过滤法的选择,推广简单上手容易,更利于兽用生物制品生产企业对于技术的掌握。然而,膜过滤法通过对样品中潜在污染菌的浓缩、培养,从检验结果的准确性来说更胜一筹。而对无菌检验方法控制上,9CFR中要求检验时需添加质控菌作为阳性对照,还需同时设置阴性对照。《欧洲药典》除增加阴阳性对照外,在检验方法或者检验条件改变时还需进行方法适用性检测保证体系的适用性。对方法的控制可有力确保单次结果的准确性,排除非样品原因导致的检验结果异常。
《中国兽药典》《欧洲药典》及9CFR中对供试品的抽检量各有规定,与本批制品的生产量直接相关,然而对于每一瓶样品的接种量却各有不同。《中国兽药典》和9CFR中,样品的接种量是固定的,与样品分类有关而与本身装量基本无关。《欧洲药典》里,样品的接种量和样品装量直接相关,且规定样品接种量不能少于培养基装量的10%。更为细致的接种量的选择,对于保障结果准确性,减少漏检率是有意义的。
《中国兽药典》中对于成品的无菌检验均需按照接种-移植的步骤进行,国外方法均为一步培养,仅在观察过程中由于疫苗的性质导致结果不易判定时才需进一步移植。统一接种-移植的步骤可以稀释防腐剂或抗生素、减少培养基用量,但是增加了操作程序且稀释了样品用量,对于某些对营养要求高的菌类,用TG小瓶培养3 d可能导致为数不多的菌死亡,从而造成漏检。
6.5 小结 无菌检验最早于1932年出现在《英国药典》中,作为样品安全性的重要指标,几十年来世界各国对于其方法的优化和完善一直在进行[8]。通过对《中国兽药典》《欧洲药典》和9CFR系统的比较发现,我国兽用生物制品无菌检验方法仍然存在优化和探讨的空间。从培养基、培养条件、接种方式进行优化和验证,结合国情制定更为完善的无菌检验方法,对我国兽用生物制品的生产和管理具有重要意义。
