猪圆环病毒3型荧光定量PCR检测方法的建立及其在猪体中的组织分布研究
2021-01-01石宝兰徐丹丹顾素云漆世华李婷婷谢红玲
薛 霜,石宝兰,徐 松,徐丹丹,顾素云,漆世华,李婷婷,冯 钊,谢红玲
(国药集团动物保健股份有限公司,武汉 430075)
猪圆环病毒3型(Porcine circovirus type 3,PCV3)是近几年发现的一种新型的猪圆环病毒,基因组全长2.0 kb,为单链环状、无囊膜的DNA病毒,形态呈正二十面体形,GC含量50%,包含3个主要开放阅读框(opening reading frame,ORF),与其他圆环病毒科病毒具有类似的基因组结构,但衣壳蛋白氨基酸序列同源性很低。PCV3与PCV2的Cap蛋白同源性仅约30%,且二者在Cap蛋白抗原表位上无任何同源性,表明这2种毒株之间不具有交叉免疫保护特性。PCV3能引起猪的皮炎肾病综合征、繁殖障碍以及心脏和多系统的炎症反应[1-2],与PCV2引起的临床症状极其相似,给临床确诊带来一定的难度。自2016年以来,PCV3已在多个国家猪群中相继被检测到[3-5]。我国研究人员通过大范围的检测发现,该病原在来自我国多个省份的样品中也有检测到[6-7]。
本研究以临床分离的PCV3阳性组织毒感染断奶仔猪,并通过建立的荧光定量PCR检测方法研究PCV3在猪不同组织脏器中的感染情况,以期为PCV3感染的诊断、预防和控制提供理论依据。
1 材料与方法
1.1 实验材料 PCV3阳性组织毒悬液,采自湖北某猪场一PCV3阳性猪,由国药集团动物保健股份有限公司制备并鉴定;PCV1、PCV2、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV),均由国药集团动物保健股份有限公司鉴定和保存;大肠杆菌Trans5α感受态细胞,购自北京全式金生物技术有限公司。
1.2 主要试剂 Taq DNA聚合酶、DNA片段回收纯化试剂盒、质粒小量快速提取试剂盒、病毒核酸小量提取试剂盒、pMD18-T载体和Premix Ex Taq试剂盒(探针法)均购自宝生物工程(大连)有限公司。
1.3 荧光定量PCR检测方法的建立
1.3.1 引物及探针设计 从GenBank中下载多条具有代表性的PCV3基因全序列,利用DNAStar生物软件分析选出基因高度保守的核苷酸区域,然后应用Becon Design软件设计筛选出最佳引物和探针组合,确定为本方法中所使用的引物和探针。同时设计一对扩增PCV3 Cap蛋白基因的引物。
1.3.2 定量标准品的制备 取PCV3阳性组织毒200 μL,按病毒核酸小量提取试剂盒说明书提取病毒核酸,用所设计的PCV3 Cap蛋白基因引物对提取的病毒DNA进行PCR扩增,PCR体系为10×PCR Buffer 5 μL,dNTPs 4 μL,上、下游引物终浓度均为0.5 μmol/L,Taq酶0.5 μL,模板5 μL,补加无菌无核酸酶水至50 μL。反应条件为:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 40 s,72 ℃ 45 s(35 cycles);72 ℃ 10 min。PCR产物经胶回收试剂盒纯化,连接至pMD18-T载体上,转化Trans5α感受态细胞,37 ℃培养12~16 h。随机挑取若干单菌落接种于5 mL LB/Ampr培养液中,37 ℃振摇过夜,提取质粒。按上述PCR体系和条件进行鉴定,将初步鉴定为阳性的重组质粒送生物公司测序。测序鉴定正确后作为PCV3荧光定量PCR阳性质粒,-20 ℃保存备用。经紫外分光光度计测定质粒浓度(连续测定3次取平均值),计算出每微升所含的DNA拷贝数并进行10倍梯度稀释,取其中101~107copies/μL的阳性质粒作为定量标准品。
1.3.3 反应体系的建立 参考宝生物Premix Ex Taq试剂盒说明书,用所构建的阳性重组质粒为模板对荧光PCR引物、探针浓度进行优化后确定反应体系。
1.3.4 标准曲线的建立 以1.3.2中制备的定量标准品为模板,利用1.3.3中确定的反应体系进行荧光定量PCR检测,得到相关标准曲线。
1.3.5 荧光定量PCR检测方法的特异性 按照1.3.3中确定的反应体系检测PCV1、PCV2、PCV3、PPV、PRV、PRRSV、CSFV、PEDV、TGEV等猪体常见病原的核酸,并设阴性水对照组,从而确定该方法的特异性。
1.3.6 荧光定量PCR检测方法的灵敏度 将已计算出拷贝数的阳性质粒梯度稀释至1 copy/μL,按照1.3.3确定的反应体系对所稀释的不同浓度阳性质粒进行检测,以此确定该方法的检测灵敏度。
1.4 PCV3在猪体中的组织分布研究
1.4.1 动物分组 将5头28日龄健康易感仔猪随机分为两组,分别为PCV3攻毒组和空白对照组,1#、2#、3#猪为攻毒组,4#、5#猪为空白对照组。
1.4.2 攻毒方法 肌肉注射PCV3阳性组织毒悬液2 mL、滴鼻8 mL,对照组按同样方法接种无菌生理盐水,将两组试验动物隔离饲养,逐日观察。
1.4.3 采样和检测 如试验猪攻毒后28 d内死亡,试验猪发现死亡的第一时间进行解剖。攻毒后第28 d,剖杀其余仔猪。采集仔猪的脑、心脏、脾脏、肺脏、扁桃体、肠系膜淋巴结、肺门淋巴结、腹股沟淋巴结和颌下淋巴结的部分组织用于荧光定量PCR检测。
2 结果与分析
2.1 荧光定量PCR检测方法的建立
2.1.1 引物及探针设计 本方法中所使用的引物和探针序列信息见表1。

表1 PCV3荧光定量PCR引物及探针序列信息Tab 1 Fluorescent quantitative PCR primers and probe of PCV3
2.1.2 定量标准品的制备 鉴定正确的阳性质粒(图1)经紫外分光光度计测定核酸浓度,按公式换算成DNA拷贝数为2×1010copies/μL。1∶10倍比稀释后取2×107~2×101copies/μL的阳性质粒作为荧光PCR定量标准品。
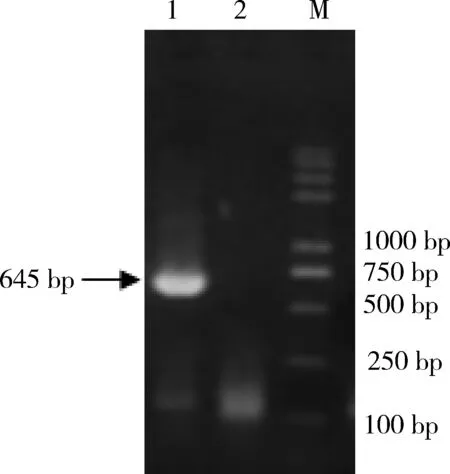
M:Trans2K plusⅡ DNA Marker;1:PCV3 Cap蛋白基因PCR产物;2:阴性对照图1 PCV3 Cap蛋白基因PCR鉴定Fig 1 Identification of PCV3 Cap protein gene by PCR
2.1.3 反应体系的建立 优化后的最佳反应体系为:上下游引物、荧光探针终浓度均为0.2 μmol/L,Premix Ex TaqTM(2×) 10 μL,DNA模板2 μL,补加灭菌蒸馏水至总体积20 μL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃ 35 s(收集荧光信号FAM),40个循环。
2.1.4 标准曲线的建立 本研究建立的PCV3荧光定量PCR检测方法在2×101~2×107copies/μL的线性范围内可以得到良好的动力学曲线(图2),且标准曲线较理想(图3)。标准曲线方程为Y=-3.257lgX+36.388(X代表核酸拷贝数,Y代表Ct值),线性相关系数R2为1,扩增效率为102.8%,说明本方法的检测误差较小,可信度较高。
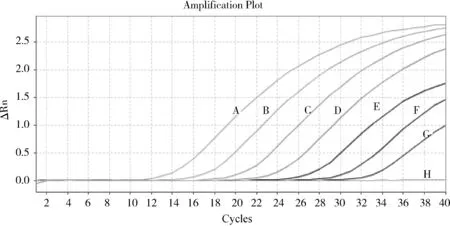
A~G:2×107~2×101 copies/μL的定量标准品;H:阴性水对照图2 PCV3荧光定量标准品扩增曲线图Fig 2 Fluorescent quantitative PCR amplification curves of PCV3 standard plasmid
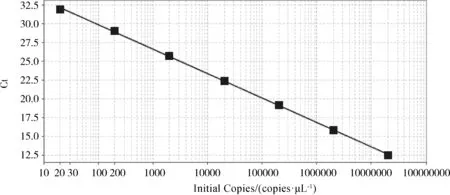
图3 PCV3荧光定量标准曲线Fig 3 Fluorescent quantitative standard curve of PCV3
2.1.5 荧光定量PCR检测方法的特异性 图4检测结果显示,除PCV3外,对PCV1、PCV2及其他几种常见猪病毒病原的检测结果均为阴性。
2.1.6 荧光定量PCR检测方法的灵敏度 荧光定量PCR检测到的最小病毒核酸量为1 copy/μL,Ct值为36.94。检测结果见图5。
2.2 PCV3在猪体中的组织分布研究 试验猪攻毒后28 d内均无死亡、无明显发病症状。剖杀各试验猪,采集脑、心脏、脾脏、肺脏、扁桃体、肠系膜淋巴结、肺门淋巴结、腹股沟淋巴结和颌下淋巴结的部分组织用于荧光定量PCR检测。结果显示,空白对照组试验猪各组织检测均为阴性,攻毒组试验猪部分组织检出PCV3阳性,病毒主要存在于肺脏、淋巴结和脾脏中,在扁桃体中有少量存在,在心脏和脑组织中均未检测到PCV3病毒核酸(表2)。

A:PCV3扩增曲线;B~J:PCV1、PCV2、PPV、PRV、PRRSV、CSFV、PEDV、TGEV及阴性水对照扩增曲线图4 荧光定量PCR特异性检测结果Fig 4 The specific detection result of fluorescent quantitative PCR

A~G:1×106~1 copy/μL;H:阴性水对照图5 荧光定量PCR灵敏度检测结果Fig 5 The sensitivity detection result of fluorescent quantitative PCR

表2 PCV3在猪体主要免疫器官及部分内脏组织的分布情况Tab 2 Distribution of PCV3 in the main immune organs and some visceral tissues of pigs
3 讨论与结论
病毒分离是实验室确诊特定病原体感染的经典方法,但由于PCV3在PK15细胞、ST细胞、Vero细胞等细胞上均不产生细胞病变,目前仍未有研究资料报道能够成功通过体外细胞培养分离到PCV3,而仅仅只是使用分子生物学检测方法检测到PCV3病毒核酸的存在,并进行测序鉴定。目前对该病的研究还处于起始阶段,针对PCV3的预防和控制还处于探索阶段。常规PCR检测方法简单快速,但容易出现交叉污染,容易产生假阳性,而隐性感染和混合感染的猪群中病毒含量可能并不高。实时荧光PCR方法操作简便、快速高效、具有较高的敏感度和特异性,而且封闭性好、不需要后续处理,大大降低了污染的可能性。显著的优越性使得该方法不仅在生物技术方面应用广泛,现今更作为一种诊断方法应用于临床。本研究结果表明所建立的荧光定量PCR检测方法特异性好、敏感性高,可用于PCV3的快速定量检测。
在本次研究中,虽然在PCV3人工感染猪体多种组织器官中检测到了PCV3病毒的存在,但并未引起明显的临床症状,这可能与攻毒病毒剂量较低和该毒株毒力较弱有关。同时,检测结果显示1#猪的阳性组织中病毒含量较其余猪只高,而在临床观察中1#猪曾有链球菌感染情况,说明当猪体状态较弱或存在其他病原混合感染时可能更容易受PCV3感染。本研究人工感染PCV3猪体中,病毒主要存在于肺脏、淋巴结,在扁桃体和脾脏中有少量存在,显示出PCV3对猪体呼吸器官和免疫器官具有较高的组织嗜性。多项调查研究提示PCV3可能与母猪繁殖障碍、猪皮炎肾病综合征(PDNS)、发热、呼吸系统疾病以及多系统炎症相关,且还可能引起新生仔猪先天性震颤和心肌炎等[8]。因此对PCV3在猪体中的组织分布情况的研究可为进一步揭示PCV3的感染途径、组织嗜性和致病机理等提供理论依据。
