胶原蛋白/纤维素纳米晶体敷料的制备及性能
2020-12-31周姝妤许淑琴梁李园陈敬华
周姝妤, 许淑琴,2, 梁李园, 陈敬华,2
(江南大学 1. 药学院;2. 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
外科手术、慢性溃疡或烧伤后形成的伤口使皮肤的屏障作用遭到严重破坏,伴随而来的伤口感染和炎症反应将引发剧烈疼痛,影响伤口愈合,甚至有可能危及患者生命。理想的伤口敷料应具有屏障作用:抵抗外源性微生物入侵、保持环境湿润以及促进伤口愈合[1-3]。
胶原蛋白(Col)已被广泛应用于伤口敷料领域。胶原基敷料具有优异的生物相容性、良好的生物降解性和弱抗原性,但其较差的力学强度、热稳定性和快速生物降解性仍限制着它的应用[4-6]。Shinya 等[4]通过冷冻干燥透明质酸、表皮生长因子和胶原混合溶液的方式制备海绵状敷料,通过紫外光交联法提高海绵的力学强度,该敷料有促进血管生成和肉芽组织形成的作用,有利于伤口愈合。Ge 等[5]通过将胶原海绵直接浸入二醛化黄原胶(DXG)-银纳米颗粒(AgNP)水溶液的方式制备了一种抗菌海绵敷料,DXG 有效提高了AgNP 在水中的分散性,并与胶原发生化学交联,赋予了敷料形状记忆的新特性。然而,如何进一步提高胶原基敷料的力学强度并赋予它额外的特性如抗菌性、抗炎性和镇痛效果仍是目前的研究热点。
天然纤维素是自然界最丰富的生物质之一,用酸水解其无序晶间区域可以获得纤维素纳米晶须(CNCs)。CNCs 具有高纵横比、高强度、高生物丰度以及良好的表面可修饰性等特点。自1995 年Favier 等[7-9]发表以CNCs 作为增强材料制备复合膜的研究后,CNCs 及其衍生物在该领域引起了极大关注。Huang 等[10]制备了一种由羧甲基壳聚糖和改性CNCs 制备的自愈合纳米水凝胶,CNCs 的大比表面积和纵横比为水凝胶提供了大量活性交联位点,改善了水凝胶的强度,还使其具有快速自愈能力。Shao 等[11]也报告了一种高弹性且可快速自愈合的纳米复合水凝胶,以马来酰亚胺化聚乙二醇包裹呋喃基修饰的CNCs,构建了一种互穿网络结构。
布洛芬(IBP)作为一种已被广泛使用的非甾体抗炎药(NSAID),具有解热镇痛和抗炎作用。已有研究证明口服IBP 对骨关节、静脉性腿部溃疡和肌肉愈合具有良好的抗炎效果,但该过程会产生明显的副作用,如胃肠道损伤和肾功能衰竭的风险[3,12,13]。
本文综合了CNCs 的表面可修饰性和增强功能、Col 的生物相容性和保湿性以及IBP 的抗炎镇痛功能,将醛基引入CNCs 表面获得双醛化纤维素纳米晶须(DACs),利用抽滤制膜的方法,使DACs 表面的醛基和Col 的氨基发生希夫碱反应,最终得到了一种透明且兼具良好力学性能和生物相容性的Col/DACs-IBP 多层膜,通过缓释IBP 达到抗炎镇痛的效果,可应用于敷料领域。
1 实验部分
1.1 原料和试剂
纤维素:湖北化纤集团有限公司;Col:无锡贝迪生物工程有限公司;小鼠胚胎成纤维细胞株(NIH-3T3):中国科学院上海细胞库;DMEM 培养基:Gibco 公司;噻唑蓝(MTT):Sigma-Aldrich 公司;胎牛血清(FBS):杭州四季青公司;其他化学试剂:分析纯,国药集团(上海)化学试剂有限公司。
1.2 CNCs 与DACs 的制备
CNCs 的制备方法在参考文献[14]的基础上进行了一定的改进,取15 g 纤维素浸没在200 mL w=30%的硫酸中,在60 ℃下剧烈搅拌8 h。以冷水稀释反应液,离心洗涤沉淀至中性,超声后再次离心,所得上清液即CNCs 水溶液(w=1.8%)。
参考文献[15, 16]在避光条件下取2.6 g 高碘酸钠溶解于200 mL CNCs 水溶液(w=1.0%)中,调节体系pH 至3.0,反应一定时间后用乙二醇终止反应,将所得产物在去离子水中透析3 d。通过控制反应条件(见表1),得到4 种氧化度不同的DACs。
1.3 C/D 膜的制备
取Col 溶解于 0.01 mol/L 的乙酸溶液中,得到Col 溶液(w=0.1%)。取适量IBP 溶解于0.1 mol/L 的NaOH溶液中,制备IBP 溶液(w=0.4%)。将IBP 溶液与CNCs 溶液(w=0.4%)混合,得到CNCs-IBP 混合溶液。通过交替抽滤Col 溶液和CNCs-IBP 混合溶液,制备Col/CNCs-IBP 多层膜。将复合膜剥离滤膜,在室温下晾干,命名为C/C-m 膜,m 表示膜层数。将CNCs 溶液替换为DACs溶液,重复以上步骤,制备Col/DACs-IBP 多层膜,命名为C/Dn-m 膜,Dn 即D1~D4,m 表示膜层数。
1.4 测试与表征
1.4.1 CNCs 与DACs 的结构 原子力显微镜(AFM,德国布鲁克公司Dimension ICON 型):将5 μL 样品(w=0.01%)滴至云母片表面,晾干后观察;X 射线衍射仪(XRD,德国布鲁克公司D8 型):将样品冻干后进行测试,测试范围为5°~50°;Zeta 电位及纳米粒度分析仪(英国马尔文公司,Zetasizer nano ZS 型):将样品稀释至w=0.2%,用0.01 mol/L 的盐酸调节pH 为6.0 后进行测定[17];傅里叶变换红外光谱仪(FT-IR,德国布鲁克公司TENSOR II 型):将样品冻干,通过衰减全反射法(ATR)进行红外分析,扫描范围为500~4 000 cm-1,扫描次数为32 次,分辨率为4 cm-1。
DACs 氧化度(DO)的测定基于醛基与盐酸羟胺的希夫碱反应。取0.1 g DACs 于50 mL 盐酸羟胺的乙酸缓冲液(0.2 mol/L,pH=4.5)中反应24 h,使用0.1 mol/L 标准NaOH 溶液滴定,以CNCs 作为对照[18]。DO按照式(1)计算:

表 1 DACs 的氧化反应条件以及对应的氧化度Table 1 Experimental conditions of DACs oxidation reaction and the corresponding degree of oxidation

其中:c0是标准NaOH 溶液的浓度(mol/L),V 是标准NaOH 溶液的体积(L),m 是样品的质量(g),M 是纤维素的重复单元葡萄糖环的相对分子量质量。
1.4.2 C/D 膜的持水性 取样品湿膜,准确称重(ms),放入60 ℃烘箱中干燥至恒重,再准确称重(md)。各样品的持水率(Wc)按照式(2)计算[19]:

1.4.3 C/D 膜的透光度 采用紫外-可见分光光度计(日本岛津公司UV-2550 型)测量样品在300~800 nm 处的透光率[20]。
1.4.4 C/D 膜的拉伸强度 采用中国美特斯工业系统公司CMT8202 型万能实验机测试。将样品裁剪为6.0 cm ×1.0 cm 的长条,在室温下测试样品的拉伸强度,拉伸速率为0.5 mm/min。
1.4.5 C/D 膜的内部微观结构 将样品于液氮中浸泡并脆断,经冻干、固定和喷金处理后,在加速电压5 kV 下采用扫描电子显微镜(SEM,日本日立公司Hitachi Su 1510 型)观察其内部微观结构。
1.4.6 IBP 的体外释放 参照文献[12, 13],将样品浸泡于10 mL PBS 溶液(pH=7.4)中,于37 ℃,110 r/min 环境中振荡,在一定的时间间隔取样,并立即补充等体积的PBS 溶液。使用紫外-可见分光光度计测定释放液于264 nm处的吸光度,并按照式(3)计算其在不同时刻的药物累计释放率(R)。

其中:Ve为取出的释放液体积(mL);V0为加入释放液的总体积(mL);m 为样品中IBP 的质量(mg);ci、cn分别为i 时间点及第n 个时间点所取释放液中的IBP 质量浓度(mg/mL)。
1.4.7 C/D-IBP 膜的生物相容性 通过与NIH-3T3 细胞的共培养评价C/D-IBP 膜的生物相容性。细胞在DMEM培养基中培养(体积分数为10 %的胎牛血清、100 IU/mL 青霉素和0.1 mg/mL 链霉素),培养环境为37 ℃,体积分数为5% 的CO2。将预先灭菌的复合膜放入48 孔板,经PBS 溶液清洗和DMEM 培养基浸润后接种细胞,于第1 天和第3 天分别以MTT 法评价细胞增殖情况,利用酶标仪(美国伯乐公司680 型)测定570 nm 处的氧化度。
2 结果与讨论
2.1 CNCs 与DACs 的特性以及结构表征
2.1.1 外观形貌 在水解反应中硫酸的作用下,CNCs 和DACs 表面均呈现了大量羟基和磺酸酯基,这些负电荷基团之间产生强烈静电排斥作用,使其能稳定均匀地分布在水中[8,17],如图1 所示。图2 显示了CNCs 与不同氧化度DACs 溶液Zeta 电位的变化。CNCs 与D1~D4 溶液的Zeta 电位均为负值,随着DACs 氧化度的提高,DACs 溶液的Zeta 电位从-17 mV 逐渐提高至-10 mV,即仍有大量负电荷被保留在DACs 表面,因此DACs 溶液可通过静电相互作用保持良好的稳定性。CNCs 和D3 的AFM 图(图3)显示,CNCs 和DACs 均呈棒状。CNCs 长为(224 ± 64)nm,高为(9 ± 3)nm(统计数N=80),均匀分散。D3 长为(208 ± 30)nm,宽为(9 ± 3)nm(N=80),略小于前者,轻微聚集。图4 显示了CNCs 与不同氧化度DACs 的XRD 结果,CNCs 与DACs 均在14.9°、16.5°和22.7°处出峰,与文献中的结果一致[6,21],但峰形随着氧化度的提高而明显减小。这说明氧化反应可使DACs 尺寸变小,分布稳定性降低,并会对其晶体结构产生一定的破坏,但通过控制反应条件,D1~D4 依然维持了基本的结晶形态和良好的分散稳定性。

图 1 CNCs 和D1~D4 水溶液的照片Fig. 1 Photos of CNCs and D1—D4 dispersions
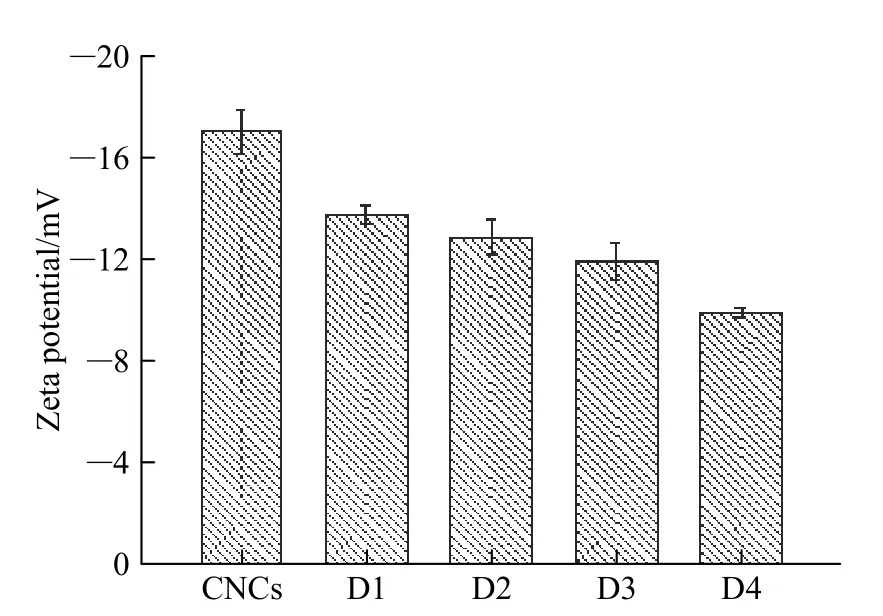
图 2 CNCs 和D1~D4 水溶液的Zeta 电位Fig. 2 Zeta potential of CNCs and D1—D4 dispersions

图 3 CNCs 和D3 的AFM 图Fig. 3 AFM micrographs of CNCs and D3
2.1.2 氧化度 如图5(a)所示,FT-IR 谱图中CNCs 在3 400 cm-1处的宽峰归属于O―H 伸缩振动,2 900 cm-1处的吸收峰归属于C―H 伸缩振动,1 050 cm-1和1 160 cm-1处的吸收峰与C―O 的伸缩振动有关。在DACs(D1~D4)的谱图中,1 730 cm-1和889 cm-1处出现了新的吸收峰,这分别归因于醛基和半缩醛的形成,表明CNCs 发生了氧化[9,18,22]。
2.2 C/D 膜的特性以及结构表征
2.2.1 内部微观结构 图5(b)显示了Col、D4 与C/D4-6
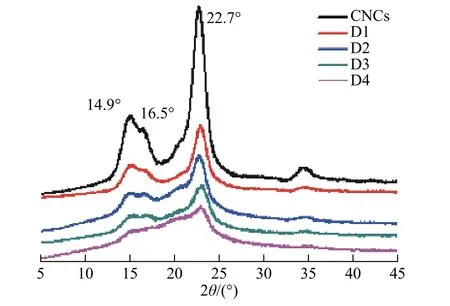
图 4 CNCs 和D1~D4 的XRD 谱图Fig. 4 XRD spectra of CNCs and D1—D4
膜的FT-IR 谱图。C/D4-6 膜在1 730 cm-1处的醛基峰明显减弱,而1 549 cm-1处出现了―C=N―的特征峰,这表明DACs 表面的醛基与Col 表面的氨基发生了希夫碱反应,醛基被消耗,而希夫碱键形成[6]。此外,图6 显示了C/C-6 膜和C/D3-6 膜的多层结构以及层间界面结构。图6(b,d)的上侧为Col 层,其结构紧密连续且可见层次结构;图6(b,d)的下侧分别为CNCs 层和DACs 层,其结构相对松散,存在较小孔隙且未见分层。此外,C/C-6 膜的Col 层和CNCs 层界面处存在孔隙,而C/D3-6 膜层间结合紧密,互相渗透。这表明Col 层和DACs 层发生的希夫碱反应加强了两者的结合。

图 5 CNCs 和D1~D4 的FT-IR 谱图 (a) 以及Col 和C/D 膜的FT-IR 谱图(b)Fig. 5 FT-IR spectra of CNCs and D1—D4 (a), Col and the C/D films (b)

图 6 C/C-6 膜和C/D3-6 膜的SEM 图Fig. 6 SEM images of C/C-6 film and C/D3-6 film
2.2.2 持水性 伤口表面过度干燥将引起皮肤的皱缩,因此,具有良好保湿性的敷料更有利于伤口的修复。本文通过固定Col 和DACs 的质量,改变复合膜的层数和每层质量,探究两者分布均匀性以及DACs 氧化度对其持水性的影响。复合膜层数越多,DACs 与Col 接触面积越大,两者分布越均匀。如图7(a)所示,随着DACs 氧化度的提高,C/Dn-6 膜的持水率逐渐下降,C/D3-6 膜持水率为78.4%,比C/C-6 膜降低了13.3%。这表明随着氧化度的提高,DACs 的粒径稍有下降,DACs 层内孔隙率下降。此外,DACs 表面更高的醛基密度提高了层间结合的紧密度,对Col 层起到压缩和固定作用,限制了Col 的持水能力,进一步降低了复合膜的持水性。但图7(b)显示了DACs 层对Col 层的这种压缩和固定作用是相对有限的,由于Col 在复合膜中起主要的持水作用,当改变D3 与Col 的分布均匀性时,层数对C/D3 膜持水性的影响并不明显。
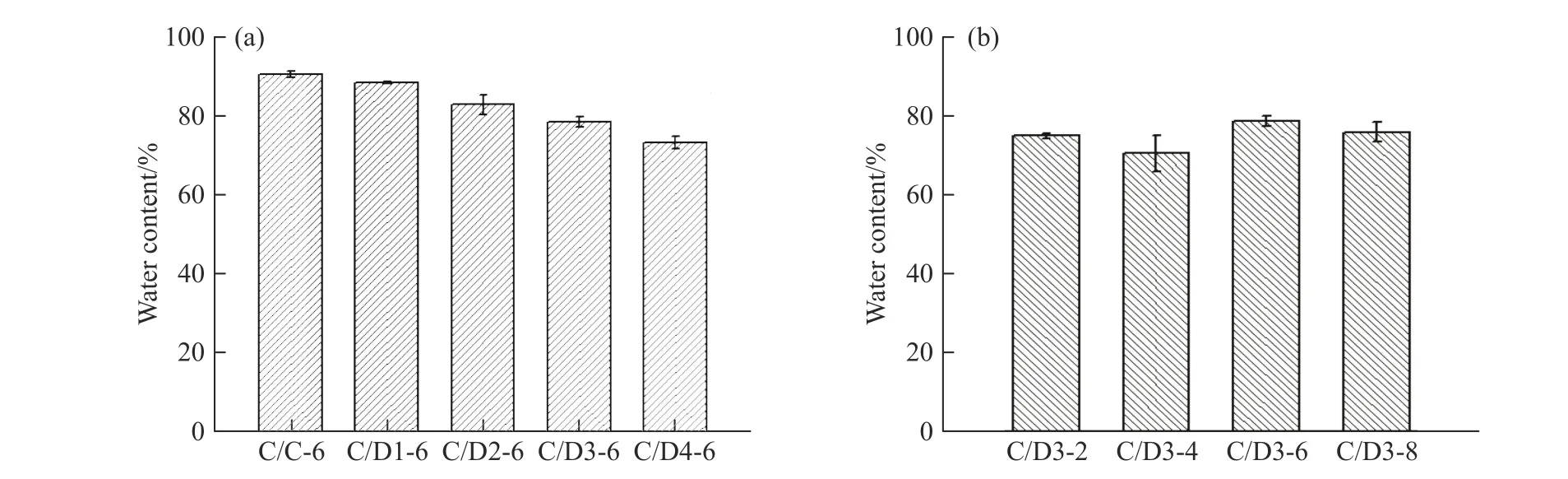
图 7 DACs 氧化度(a)和层数(b)对C/D 膜持水性的影响Fig. 7 Effect of degree of oxidation of DACs (a) and the number of layers (b) on the water content of C/D films
2.2.3 透光性 提高敷料的透光性便于实时监测伤口情况。本文探究了DACs 的氧化度以及DACs 和Col 的分布均匀性对复合膜透光率的影响。表2 显示随着DACs 氧化度和层数的增加,复合膜透光性逐渐提高,C/D4-6 的透光率高达95.7%,相比C/D3-2 提高了13.5%。提高DACs 氧化度以及DACs 和Col 的分布均匀性增强了两种基质的结合程度,促进了复合膜内部结构均一化,从而提高了透明度。
2.2.4 拉伸强度 图8 为DACs 氧化度和层数对C/D 膜拉伸强度的影响。由图8 可知,C/D3-4 膜拉伸强度可达54.2 MPa,分别是C/D1-4 膜和C/D3-2 膜的2.2 倍和2.5 倍,表明提高DACs 和Col 的分布均匀性以及DACs 氧化度均可提高C/D 膜的拉伸强度。当层数从2 增加至4 时,C/D3 膜的强度显著增强,断裂伸长率也有稍有增加。

表 2 DACs 氧化度和层数对C/D 膜透光率的影响Table 2 Effects of degree of oxidation of DACs and the number of layers on the light transmittance of C/D films

图 8 DACs 氧化度(a)和层数(b)对C/D 膜拉伸强度的影响Fig. 8 Effect of degree of oxidation of DACs (a) and the number of layers (b) on the tensile strength of C/D films
2.2.5 药物释放行为 图9 显示了IBP 溶液与CNCs 溶液或DACs 溶液混合前后的粒径分布情况,纯CNCs溶液有两个峰(58、330 nm),D4 溶液也有两个相似的峰(38、267 nm)。而IBP 与CNCs 或D4 的混合溶液的两个峰均向大尺寸方向偏移,其中,D4-IBP 水溶液的两个峰分别位于56 nm 和390 nm 处,表明IBP 与D4 可能通过非共价键力(氢键)作用发生聚集,导致粒径变大。而无微米级颗粒则表明混合溶液具有良好的稳定性。溶液中的粒子略有聚集,但CNCs 和DACs 仍维持了良好的分散性,可以认为IBP 的加入对DACs 的稳定性无较大影响。

图 9 样品的粒径分布情况Fig. 9 Particle size distribution of samples
在体外药物释放测试中,C/D 膜中的IBP 都在24 h 内达到释放稳定,但24 h 药物累计释放率存在明显差异(43.8%~91.6%),如图10 所示。大部分IBP 分布在DACs 层内,被上下两层Col 包裹,形成“三明治结构”。由于Col 层结构紧密,IBP 只能通过扩散的方式,缓慢地穿过Col 层到达伤口表面。因内层DACs 中的IBP 需要更长时间的渗透才能释放,DACs 与Col 多层分布的设计延长了IBP 的释放时间,可达到缓释效果。当DACs 氧化度较低时,随着氧化度的提高,复合膜的结合程度提高,内部孔径缩小,24 h 药物累积释放率逐渐降低。但当DACs 氧化度高于30%时(D3,D4),24 h 药物累积释放率明显提高,这是由于复合膜结合程度过高,孔隙率大大减小,载药量大幅下降,导致释放率明显提高。可见,适当降低DACs 氧化度更有利于IBP 的负载和释放。
2.2.6 生物相容性 如图11 所示,当细胞与C/D 膜共培养24 h 时,其增殖情况均优于对照组,可见该复合膜有利于细胞的吸附、生长和增殖,但该效应随着DACs 氧化度的提高而减弱。当共培养至72 h 时,只有DACs 氧化度低于36.7%的复合膜(D1,D2)能促进细胞的增殖,这是由于复合膜外层的Col 被逐渐降解,大量DACs 被暴露出来,与细胞表面接触,对细胞的增殖产生抑制作用。可见,C/D 膜表现出良好的生物相容性,在短期伤口覆盖过程中有利于伤口修复。
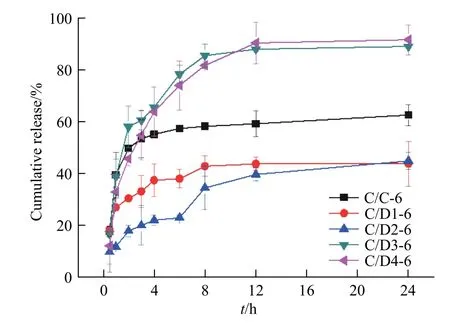
图 10 DACs 氧化度对C/D 膜中IBP 释放行为的影响Fig. 10 Eeffect of degree of oxidation of DACs on the IBP release from C/D films
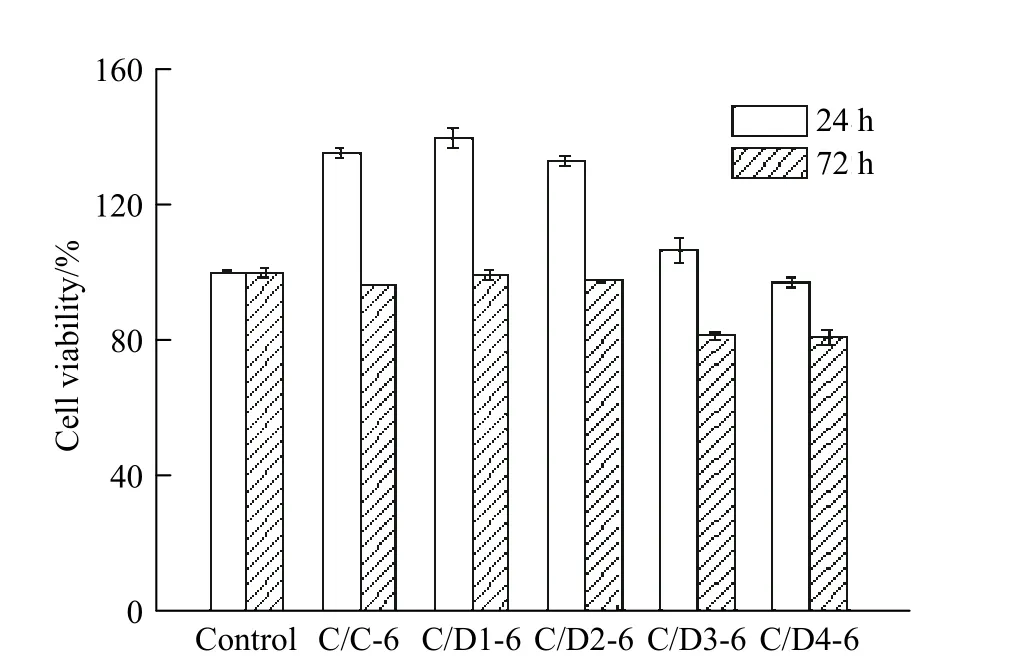
图 11 DACs 氧化度对C/D 膜生物相容性的影响Fig. 11 Eeffect of degree of oxidation of DACs on the biocompatibility of C/D
3 结 论
(1)采用酸水解法和高碘酸钠氧化法制得氧化度为8.6%~51.3%的DACs,产物呈棒状,长为(208 ± 30 )nm,宽为(9 ± 3) nm,可在水中稳定分散。
(2)通过交替抽滤DACs-IBP 混合溶液和Col 溶液制备C/D 多层膜。相邻DACs 层的醛基和Col 层的氨基在界面处发生希夫碱反应,形成化学交联网络。
(3)增加C/D 膜的层数有利于DACs 和Col 的分布趋于均匀化,而提高DACs 的氧化度增强了两者间的化学交联,使膜的微观结构更加均一紧密。与CNCs 相比,D3 使复合膜透光率从86.9%提高到94.3%,持水率从90.4%降至78.4%。最优C/D 膜的拉伸强度高达54.2 MPa。
(4)C/D 膜具有良好的生物相容性,用于短期伤口覆盖可有效促进细胞黏附和生长,有利于伤口修复。
(5)C/D 膜负载的IBP 药物在24 h 内缓慢释放,累计释放率可达89.0%,赋予了该膜抗炎镇痛的功效。
