基于超支化聚醚的纳米级超声造影剂
2020-12-31杨少玲周永丰
李 婕, 黄 平, 王 琮, 杨少玲, 周永丰
(1. 上海交通大学化学化工学院,金属基复合材料国家重点实验室,上海 200240;2. 上海交通大学附属第六人民医院南院,上海 201499)
超声成像[1-2]由于其无创性、低辐射、实时监测以及经济实惠的优点被广泛应用于器官、肌肉或者血流体系的检查诊断中。超声造影剂(UCA)[3]作为一种可以显著增强超声信号的试剂对于辅助超声成像进行精准诊断具有重要的意义。典型的UCA 是一种由不同种类的壳材料包裹气体形成的微气泡,气体是一种很强的声波散射体,所以导致UCA 与周围组织的声阻抗值差异很大,表现在图像上为超声波回声信号的增强,图像对比度的增加。UCA 在器官内部结构的显影成像和血流动力学的评估等领域[4]广泛应用,如心腔中心内膜边缘的增强成像[5]、心肌组织血流灌注的实时显示[6]以及新生微血管生成的检测诊断[7]等。
肿瘤组织在生长期间需要大量的新生血管来为快速分裂的细胞提供营养,肿瘤血管和正常血管的差异在于其血管内皮间隙会扩张增大,在血管壁上形成380~780 nm 的小孔[8]。常规的UCA 尺寸一般为微米级(2~8 μm),例如临床上最常用的造影剂Sonovue,由于尺寸的限制,其不能渗透肿瘤组织的脉管系统到达相应的靶点发挥诊断或治疗的功效。因此,开发出一种可以渗透到肿瘤组织血管间隙的纳米级UCA 具有十分重要的意义。近年来人们开发出了一系列不同种类的纳米级UCA,并将其应用于肿瘤组织的成像和治疗中[9-12],其中基于磷脂分子的纳米级UCA 因其较好的造影性能和良好的生物相容性得到了广泛应用。Yin等[9]使用薄膜水化-声振空化法、通过离心后处理得到了尺寸为(381.7 ± 36.9) nm的纳米级磷脂UCA,并将其作为载体负载药物分子到达肿瘤部位,结合低频超声有效地抑制了肿瘤的生长。Zhou 等[10]使用薄膜水化-机械振荡法制备了磷脂UCA 微泡,静置分离得到了尺寸为(635.5 ± 25.4) nm 的纳米级造影剂,并将其运用到肿瘤靶向诊断中。然而,大多数基于磷脂小分子制备的UCA 尺寸分布由微米级到纳米级不等,需要通过重力作用[10]、离心[8,9,13]、过滤[14]等方法来梯度分离大尺寸的微米级气泡和小尺寸的纳米级气泡,步骤复杂,产率较低。此外,由于受限于小分子特性,磷脂类UCA 的稳定性不佳,难以满足需求。因此,迫切需要开发出一类制备简单、稳定性好、造影性能优良的纳米级UCA。
超支化聚合物具有优异的自组装行为,可以形成包括管、囊泡在内的多种形态的组装体[15-17],且组装形貌易于调控。超支化聚合物因其组装形貌多样化、官能团丰富易修饰等优点在生物医学领域具有广泛的应用[18],如药物输送[19]、生物成像[20,21]、基因转染[22]等。本文使用以超支化聚3-乙基-3-羟甲基环氧丁烷(HBPO)为疏水核,聚乙二醇(PEO)为亲水性链段的双亲性超支化聚醚(HSP)作为壳材料制备了一系列UCA。HSP 由疏水的超支化聚醚核HBPO 和亲水的PEO 臂组成。本文利用HBPO 核的疏水作用,制备了内部填充六氟化硫(SF6)气体,外部包裹着HSP 的超声造影剂(HSP-UCA)。通过改变PEO 链段的长度,HSP 可以在水中组装成尺寸从100 nm 到100 μm 不等的囊泡[18],因此同样地可以通过改变PEO 链段长度来控制HSP-UCA 的尺寸。当PEO 的臂长为10 时,HSP-UCA 尺寸为517.3 nm,造影剂悬液中SF6体积分数为9.12 × 10-3,体外超声半衰期为3~5 min,且稳定性和浓度都较高。所得的纳米级HSP10-UCA 经兔耳缘静脉注射后可在心脏内观察到较好的灌注效果,表明其具有良好的造影效果。
1 实验部分
1.1 原料和试剂
三羟甲基丙烷(TMP):纯度99%,北京百灵威科技有限公司;碳酸二乙酯(DEC):纯度99%,Adamas 试剂公司;三氟化硼乙醚络合物(BF3·OEt2):w(BF3) = 48%,Adamas 试剂公司;碳酸钾(K2CO3):纯度>99%,Greagent 试剂公司;环氧乙烷(EO):纯度>99%,Adamas 试剂公司;六氟化硫(SF6)气体:纯度99.9%,上海伟创标准气体有限公司;无水乙醇、二氯甲烷等有机溶剂均购自国药化学试剂有限公司;磷酸缓冲液(PBS):购自生工生物工程(上海)股份有限公司(pH 7.4)。没有特别说明的生物化学品,未经处理直接使用。
1.2 测试与表征
核磁共振波谱仪(德国布鲁克公司AVANCE Ⅲ HD 型400MHz):取10 mg 样品溶于0.5 mL 氘代二甲基亚砜(DMSO)中进行一维氢谱测试;透射电子显微镜(美国FEI 公司Talos F200X 型):用移液枪取10 μL 造影剂溶液(0.5 mg/mL)滴于铜网上,室温下自然干燥后进行测试;凝胶渗透色谱仪(日本东曹株式会社HLC-8320GPC 型):取10 mg 样品溶于2 mL 二甲基甲酰胺(DMF)中测试,以DMF 为流动相,流速为0.6 mL/min,标样为PEO;动态光散射仪(英国 Malvern 公司ZS90 型)。
1.3 HSP 的合成
HSP 的合成参考文献[15, 23]。首先在500 mL 三颈烧瓶中装上恒压滴液漏斗,加料前反复抽真空和通氮气,明火烘烤以除尽水分和空气。然后将3-乙基-3 羟甲基环氧丁烷(EHO)单体(11.6 mL, 0.1 mol)置于恒压滴液漏斗中,将约100 mL 干燥的CH2Cl2通过胶管连接口注射到烧瓶中,待反应体系温度降到0 ℃后,将6.4 mL BF3·OEt2(0.05 mol)注射到溶液中,然后快速滴加EHO 单体。在0 ℃以下,强烈搅拌下反应24 h。随后将1 mol EO 单体加入到恒压漏斗中,并快速滴加到上述反应体系中,继续反应24 h 后加入水终止反应,粗产物采用正己烷沉淀后再用水透析,冷冻干燥后得到无色黏稠状HSP。通过控制EO 的量(0.3,0.5,1.0 mol)分别合成了PEO 臂长为3,5,10 的HSP,分别命名为HSP3、HSP5、HSP10。
1.4 HSP-UCA 的制备
采用声振空化法,首先取200 mg 不同臂长的HSP 加入到10 mL PBS 中,搅拌使其溶解自组装形成双分子层,在向溶液中通入2 min 的SF6气体(10 mL/min)后,边使用超声破碎仪施加强超声边通入SF6气体,在强超声作用下水中会形成较多的负压核,SF6气体会在这个过程中被包裹到其中,此时气液界面存在着很强的界面张力,双亲性大分子HSP 解离扩散到气液界面来稳定气液界面,形成由超支化聚合物包裹SF6气体的单层气泡。使用超声破碎仪以最大输出功率超声3 min,得到乳白色HSP-UCA 悬液,静置后上层为不稳定气泡,下层为HSP-UCA。其中,HSP10-UCA 的尺寸为517.3 nm。本文主要针对HSP10-UCA 进行性能及超声成像研究。
1.5 GC-MS 定性定量测定HSP10-UCA 中SF6 的气体体积分数
通过气相色谱-质谱联用仪(GC-MS,美国Agilent 7890A-5975C 型)来定性、定量测定HSP10-UCA 悬液中SF6气体浓度。选用GC-MS 的选择离子监测模式(SIM)测定微泡中气体的成分,通过绘制SF6气体标准曲线测定微泡悬液中SF6的体积分数。首先采用N2作为稀释气体配制一系列体积分数梯度的SF6标准气体(5 ×10-3,10 × 10-3,20 × 10-3,30 × 10-3,100 × 10-3)绘制标准曲线。吸取1 mL 待测微泡样品加入到20 mL 顶空瓶中,超声处理30 min 后加热至70 ℃,保持3 h 使微泡破裂完全释放出SF6气体后,吸取一定体积的气体进样,根据流出曲线峰面积计算得到SF6气体的体积分数。
1.6 HSP10-UCA 体外超声成像效果评价
使用多模式小动物超声/光声成像系统(美国Fujifilm VisualSonics VEVO LAZR-X 型)进行纳米级HSP10-UCA 体外超声成像测试,采集MX550S 探头在B 模式下的图像,频率为40 MHz,增益值为30 dB。首先将脱气水加入到立方体水槽中,将超声探头浸没于液面下捕获图像作为空白对照。随后将HSP10-UCA 依次加入加到水槽中,按照同样的方法捕获图像,每个样品至少采集3 张图片,为了观察样品体外超声稳定性,本文采集了其在连续的超声辐照下不同时间点(0,3,5,10,20,30 min)的超声图像。
1.7 HSP10-UCA 体内超声成像效果评价
纳米级HSP10-UCA 体内超声成像测试使用超声成像仪(美国GE VividE9 型)的9L 探头进行,超声探头频率为3 MHz,机械指数MI = 0.15,在Contrast 模式下进行图像采集,所有的图像采集均采用如上相同的参数。选用新西兰大白兔(约2.5 kg)为实验动物模型,用w = 10%的水合氯醛麻醉剂(3~3.5 mL/kg)腹腔注射麻醉兔子后固定在兔床上,剃去心脏部位的兔毛后通过耳缘静脉建立外周静脉通道。首先对没有注射HSP10-UCA 之前的兔心脏进行超声检查,记录初始状态的空白图像,接着注射1 mL HSP10-UCA 悬浮液并立即用1 mL生理盐水冲洗试管,观察HSP10-UCA 在心脏内的灌注情况。
2 结果与讨论
2.1 不同PEO 臂长的HSP 的合成及表征
超支化聚醚HSP 的合成路线如图1 所示,通过两步阳离子开环聚合得到了HSP。图2 是HSP 的1H-NMR谱图,从图中可以看出,化学位移在0.8 处的峰(峰a)对应于HBPO 核中―CH2―CH3中甲基的质子峰,1.3 处的峰(峰b)对应于HBPO 核中―CH2―CH3中亚甲基的质子峰,3.1 处的峰(峰c)对应于HBPO 核主链中―CH2―O―CH2-亚甲基的质子峰,3.4(峰d)处的峰对应于HBPO 核中―CH2―OH 中亚甲基的质子峰,3.5~3.8 的峰(峰e, f, g)对应于PEO 亲水段中和醚氧相连的―O―CH2―上亚甲基的质子峰。通过PEO 链段中亚甲基峰的峰面积和HBPO 中甲基峰面积的比值计算得到超支化聚合物的臂长(RA/C),根据文献[15]计算得到图2 中HSP 共聚物样品的RA/C= 10。通过改变EO 的加入量可得到不同RA/C的HSP 样品,所得结果列于表1 中。

图 1 超支化聚醚HSP 的合成路线Fig. 1 Synthetic route of hyperbranched polyether
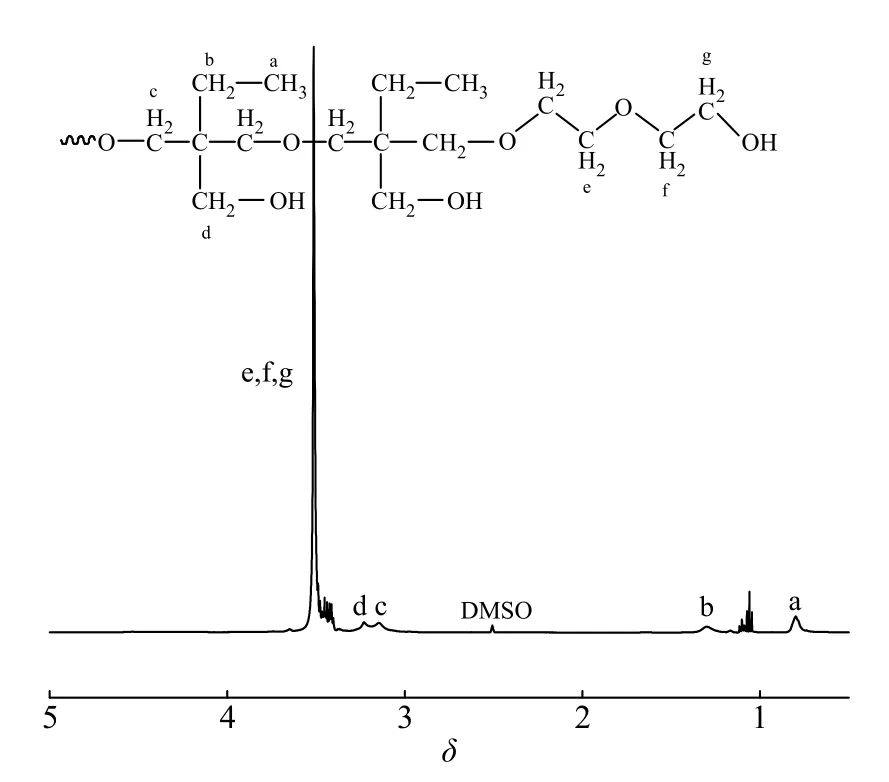
图 2 HSP 的1H-NMR 谱图Fig. 2 1H-NMR spectrum of HSP

表 1 HSP 样品的表征Table 1 Characterizations of HSP samples
2.2 HSP-UCA 体外造影效果评价
图3 为纯水和不同PEO 臂长的HSP-UCA 的体外超声造影图。从图中可以看出随着PEO 臂长的增长,HSP-UCA 造影剂浓度逐渐增加。HSP3-UCA 造影剂浓度较低,视野中只可见到为数不多的造影剂,说明该造影剂稳定性较差。HSP10-UCA 造影剂浓度最高,视野中可见密集的造影剂,稳定性较好。推测臂长对造影剂稳定性的影响和对囊泡稳定性影响相似,PEO 亲水链段越长,其在水中形成的水合层越致密,造影剂在水中的稳定性也越好。
2.3 HSP10-UCA 粒径、形貌的表征

图 3 HSP-UCA 的体外超声造影图Fig. 3 in vitro Ultrasound images of HSP-UCA

图 4 HSP10-UCA 的宏观照片(a),DLS 曲线(b)和TEM 图(c,d)Fig. 4 Photos (a), DLS curve (b) and TEM images (c, d) of HSP10-UCA
图4 为HSP10-UCA 的宏观照片,DLS 曲线和TEM 图。如图4(a)所示,微泡悬液为乳白色,静置后上层为不稳定气泡,下层为纳米级造影剂。DLS 测定出该造影剂的平均粒径为517.3 nm,如图4(b)所示,与图4(c,d)的TEM 结果相吻合,从TEM 图中可以看出造影剂的粒径均在500 nm 左右,证明本文成功地制备了纳米级HSP10-UCA。
2.4 HSP10-UCA 的体外造影效果评价
图5 为HSP10-UCA 的体外造影效果随时间衰减的图像。由于造影效果和造影剂的粒径成正比,所以从图中可以看到相较于一般的微米级UCA,纳米级HSP10-UCA 体外造影图像的超声信号强度要稍微弱一些。当体外超声时间为3 min 时,还有较多肉眼可见的造影剂存在;当超声时间达到5 min 时,造影剂数量大幅减少,由此可推测体外造影的半衰期大约为3~5 min;当体外超声时间达到30 min 时,造影剂几乎全部破裂。

图 5 HSP10-UCA 体外造影的时间衰减图像Fig. 5 in vitro Ultrasound images of HSP10-UCA for different durations
2.5 HSP10-UCA 的体内造影效果评价
图6 为HSP10-UCA 在兔心脏内的超声造影图。从图6(a)可见,在注射HSP10-UCA 之前,心脏内部的回声信号值很低,其内部的结构也无法通过超声成像观察到,当静脉注射HSP10-UCA 纳米级超声造影剂之后,心脏迅速得到了灌注,可见其内部的房室结构,平均造影时长为50~60 s,表明HSP10-UCA 具备一定的体内造影成像的能力。使用GC-MS 测定了造影剂中SF6气体浓度,SIM 模式下可捕获样品较强的吸收峰,表明了造影剂中包覆了一定量的SF6气体,将峰面积代入SF6标准曲线(y = 153 942.111 87x - 1.13 × 106,R2=0.994 46)中,计算得到造影剂悬液中SF6气体的体积分数为9.12 × 10-3。
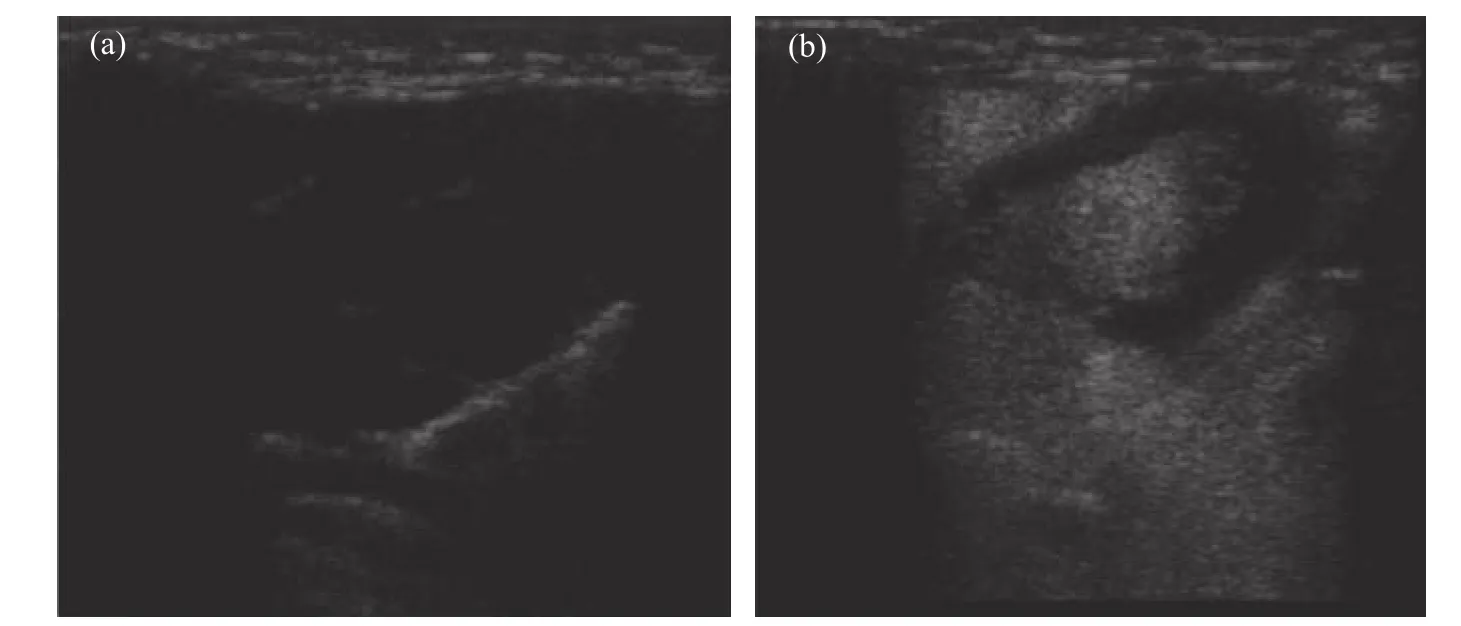
图 6 兔心脏在注射HSP10-UCA 纳米级超声造影剂之前(a)和之后(b)的超声图像Fig. 6 in vivo Ultrasound images of rabbit heart before (a) and after (b) HSP10-UCA injection
3 结 论
(1)合成了不同PEO 臂长的超支化聚合物HSP,随着PEO 链的增长,造影剂的稳定性逐渐增加,浓度也逐渐增加。
(2)HSP10-UCA 平均粒径为517.3 nm,SF6气体的体积分数9.12 × 10-3,其体外超声造影半衰期为3~5 min,兔心脏超声造影平均造影时间50~60 s,组织灌注效果良好。
