原位合成纳米SiOx/溶菌酶/茶多酚/壳聚糖复合保鲜涂膜对海鲈鱼鱼片保鲜性能的影响
2020-12-31张家涛郭晓华于建洋励建荣
武 娇,杨 华,张家涛,张 冉,孙 彤,*,谢 晶,郭晓华,于建洋,励建荣,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.上海海洋大学食品学院,上海 201306;3.山东美佳集团有限公司,山东 日照 276800;
4.荣成泰祥食品股份有限公司,山东 威海 264309)
随着消费者对食品安全问题认识的逐渐提高,食品保鲜技术越来越受到重视,采用无毒、高效、易降解的天然材料改善食品的贮藏品质已成为趋势[1]。食品保鲜技术主要包括物理、化学、生物等形式[2]。生物保鲜技术中的涂膜保鲜是指在食品表面涂覆一层天然可食性物质,利用其风干后形成的结构致密薄膜,抑制和阻止食品与外界环境的物质交换[3-4]。该技术具有安全无毒、易降解、保鲜性能优等特点,被认为是确保保鲜过程中食品质量和安全的有效且环保的方法[5]。
壳聚糖(chitosan,CS)又称脱乙酰甲壳素,是一种阳离子多糖[6]。因其无毒无害,具有成膜性和广谱抗菌性,能减缓水产品中的水分流失,维持其品质和风味,因而作为一种天然的保鲜剂已广泛应用于食品保鲜[7-8]。杨丽丽等[9]研究表明,CS涂膜可有效延缓美国红鱼的品质下降。但是,单一CS涂膜仍存在透水率大、机械性能和渗透性能差的问题,因此影响其应用的推广[10]。
纳米SiOx是一种无毒无害、无污染的无机材料。其分子呈三维链状结构,可与高分子材料中的活性基团发生键合作用,从而提高材料的性能[11]。本课题组的前期研究证明,原位合成纳米SiOx可改变涂膜的微观结构并增强其力学性能,使气体透过性能改善[10]。但涂膜经单一的纳米材料改性后并不具有良好的抗菌性能,在水产品保鲜领域中无法广泛应用。
溶菌酶(lysozyme,LZM)又称为胞壁质酶,是一种无毒无害的天然亲水性蛋白质,具有一定的溶菌作用,可抑制病原细菌的生长,从而延长食品的保质期[12]。蓝蔚青等[13]研究发现,带鱼段在经LZM保鲜液处理后,其感官品质、微生物指标和理化指标均有所提高。但由于其特异性明显,抗菌谱较窄[14],仅使用LZM很难获得最佳的水产品保鲜效果。
茶多酚(tea polyphenols,TP)是重要的天然化合物,又称茶单宁,是茶叶中多酚类物质的总称,具有很强的抗氧化作用、良好的抑菌性及抗癌性,可显著抑制水产品中微生物的生长,有效延长其货架期[15]。但其化学性质不稳定,易受温度、湿度、pH值等因素的影响[16]。有研究表明,添加TP的功能性复合膜已广泛应用于水产品保鲜[17-18]。近年来,复合涂膜保鲜已成为研究热点。Li Tingting等[19-20]探究发现CS和TP复配的复合涂膜可使美国红鱼鱼肉的货架期延长约6 d,使大黄鱼的货架期延长约8 d。复合涂膜技术既发挥了膜基质中各成分的优点,又可弥补单一涂膜的不足,从而达到最佳食品保鲜效果,因此具有更广阔的应用前景[21-22]。
本实验以CS为成膜基质,在原位合成纳米SiOx改性的基础上,以天然生物保鲜剂LZM和TP为添加剂,研究CS基复合涂膜对冷藏海鲈鱼鱼片保鲜品质的影响,以期为复合保鲜涂膜的应用及海鲈鱼的贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
活体海鲈鱼购于辽宁省锦州市水产批发市场。
CS(食品级,脱乙酰度≥95%) 上海晶纯试剂有限公司;TP(食品级,纯度>98%) 安徽红星药业有限公司;LZM 美国Sigma Aldrich公司;其他试剂均为分析纯;去离子水(电导率低于15 μS/cm) 实验室自制。
1.2 仪器与设备
DF-II型集热式磁力加热搅拌器 江苏省金坛市荣华仪器制造有限公司;FE20型pH计 瑞士METTLER TOLEDO公司;SK6210HP型超声波清洗器 上海科导超声仪器有限公司;LRH-150型生化培养箱 上海一恒科技有限公司;Scimitar 2000型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国Varian公司;Ultima IV型X射线粉末衍射仪日本理学公司;S-4800型场发射扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司;TA-XT-PLUS型质构仪 英国Stable Micro Systems公司;CYES-II型氧/二氧化碳气体测定仪苏州市天威仪器有限公司;T25型数显型均质机上海珂淮仪器有限公司;UV-2000型紫外-可见分光光度计日本尤尼柯仪器有限公司;K9840型自动凯氏定氮仪山东海能科学仪器有限公司;X1R型高速冷冻离心机赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 CS复合涂膜的制备
将CS溶于体积分数1%的冰乙酸溶液中,50 ℃下磁力搅拌至CS完全溶解,使CS质量浓度为1.5 g/100 mL。在搅拌条件下,向2 mol/L盐酸溶液中滴加1 mol/L硅酸钠溶液至pH 4~5,得酸性硅溶胶。滴加0.015 g酸性硅溶胶和0.03 mL 1 g/100 mL的十二烷基苯磺酸钠溶液至100 mL上述CS溶液中,再加入0.1 mL甘油,搅拌均匀,再加入0.15 g的LZM和0.25 g TP。将溶液超声脱气10 min后,得涂膜溶液。取40 mL涂膜溶液在20 cm×20 cm亚克力板上流延成膜,于生化培养箱中30 ℃恒温干燥24 h,制得原位合成纳米SiOx/LZM/TP/CS复合涂膜。
参照上述方法,不加硅溶胶、十二烷基苯磺酸钠、LZM及TP,制备CS涂膜;不加LZM及TP,制备原位合成纳米SiOx/CS复合涂膜;不加TP,加入0.3 g LZM,制备原位合成纳米SiOx/LZM/CS复合涂膜;不加LZM,加入0.5 g TP,制备原位合成纳米SiOx/TP/CS复合涂膜。
1.3.2 CS复合涂膜的表征分析
取上述涂膜,研磨处理后采用KBr压片法测定FTIR光谱,波长范围为4 000~400 cm-1,步宽2 cm-1;采用X射线粉末衍射仪对涂膜进行X射线衍射(X-ray diffraction,XRD)分析,检测条件为:40 kV、50 mA、CuKα辐射、步宽0.02°、扫描范围4~70°;将涂膜在20 kV的条件下进行喷金处理,采用场发射SEM观察涂膜表面和断面的微观形貌。
1.3.3 CS复合涂膜理化性能测定
参照韩英等[23]的方法,测定涂膜的拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EB);参照郝晗等[24]的方法,测定涂膜的水蒸气透过率(water vapor transmission rate,WVTR);参照郝文婷等[25]的方法,测定涂膜的氧气透过率(oxygen transmission rate,OP)和二氧化碳透过率(carbon dioxide pransmission rate,CDP);将涂膜剪成比色皿大小后贴于比色皿壁上,于450 nm波长处测定涂膜的透光率/%,采用外径千分尺测定膜厚度/mm,透光性在数值上为透光率和膜厚度的乘积。
1.3.4 贮藏过程中海鲈鱼鱼片鲜度指标测定
取新鲜活体海鲈鱼,用碎冰猝死后,去头、去皮、去内脏,取鱼体两侧鱼片,每片(120±5)g。用无菌水清洗后沥干其体表水分。将海鲈鱼鱼片分别浸入4 ℃保存的不同涂膜液中10 min后取出,未经涂膜液浸渍的鱼片作为对照。处理后将鱼片装于已灭菌的蒸煮袋内密封,4 ℃冷藏保鲜,在一定时间后测定鱼片的鲜度指标。
参照Cai Luyun等[26]的方法对海鲈鱼从气味、色泽、组织状态和肌肉弹性4 个方面对其进行感官评分,其中,16~20 分表示鱼片具有最好品质;12~16 分表示鱼片品质良好;12 分为可接受限值。
pH值的测定参考Arashisar等[27]的方法稍作修改。称取5.0 g绞碎鱼肉,加入45 mL蒸馏水,均质30 s,待30 min后测定其pH值。
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》测定鱼片内菌落总数;参照Sun Tong等[28]的方法测定鱼片的硫代巴比妥酸(thiobarbituric acid,TBA)值;参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》测定鱼片的总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量;参照Cheng Junhu等[29]的方法测定鱼片的K值。
采用质构仪测定其质构指标,具体参考张晗等[30]的方法并略作修改,将鱼肉切成1.5 cm×1.5 cm×1.5 cm,测定参数:P/50探头,测定模式T.P.A,测试速率1 mm/s,测量后探头回程速率1 mm/s,针入距离1 mm,5 g触发力。
1.4 数据统计分析
实验均平行测定3 次,以平均值±标准偏差表示测定结果。使用SPSS软件的单因素方差分析中的Duncan’s法进行显著性分析,采用Origin 8.5软件进行绘图。
2 结果与分析
2.1 CS复合涂膜微观结构表征分析
2.1.1 CS复合涂膜的FTIR和XRD分析结果

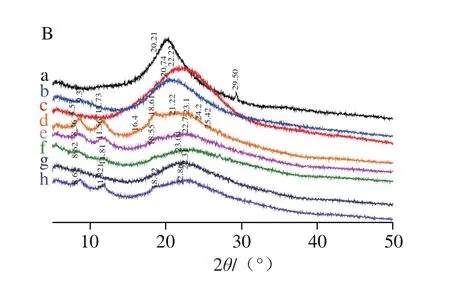
图1 CS涂膜原料及复合涂膜的FTIR(A)和XRD(B)图Fig.1 FTIR spectra (A) and XRD patterns (B) of raw materials and CS composite coatings
如图1A所示,3 500~3 300 cm-1处的宽吸收峰是N—H和O—H的伸缩振动吸收峰,2 920、2 869 cm-1处的吸收峰是甲基和次甲基的C—H伸缩振动吸收峰,2 359、2 339 cm-1处是空气中CO2的特征吸收峰[7],1 650 cm-1和1 560 cm-1处分别是酰胺I带、酰胺II带的特征吸收峰[31],14 57cm-1处为C—H的特征吸收峰[32],668 cm-1处为CS的敏感吸收峰[33]。LZM在1 656 cm-1和1 535 cm-1处出现的特征峰分别属于酰胺I和酰胺II峰,分别对应于C=O键的伸缩振动和N—H键与C—N键弯曲耦合;TP的FTIR图中,在3 600~3 000 cm-1处大且宽的峰是羟基的伸缩振动吸收峰,说明TP分子中有大量游离羟基;1 621 cm-1处为苯环骨架中C=C伸缩振动吸收峰;1 516 cm-1和1 457 cm-1处是TP的特征吸收峰[34]。CS成膜后在3 500~3 300 cm-1处的吸收峰变窄变强,略有蓝移,说明CS成膜后—NH和—OH伸缩振动增强,形成了氢键。在CS中继续加入原位合成纳米SiOx,SiOx/CS涂膜在1 423 cm-1处和1 561 cm-1处的特征吸收峰强度增强,这可能是原位合成纳米SiOx表面的活性基团与CS中的C=O键和酰胺II之间有较强的氢键作用导致的;同时,涂膜在1 256、1 086、564 cm-1处出现了吸收峰,其中1 256 cm-1处为Si—C的伸缩振动吸收峰,1 086 cm-1处为Si—O—Si的反对称伸缩振动吸收峰,564 cm-1处为Si—O的吸收峰。在SiOx/CS涂膜中加入LZM、TP后,涂膜的红外光谱无明显变化。
如图1B所示,CS在衍射角2θ=20.2°处出现非晶态衍射峰,衍射峰相对较窄[35]。LZM和TP均为非晶态物质,LZM的馒头峰位于20.74°,TP的馒头峰位于22.22°。CS溶解后呈现3 种晶型,即水合态(2θ=8°、10°或12°)、非水合态(2θ=15°)、无定形态(2θ=20°~22°)[36]。当CS涂膜形成后,在8.6°、11.7°、18.6°、23.1°、24.2°处出现了较尖锐的衍射峰,说明CS在涂膜脱水过程中形成了晶体,且同时存在水合态、非水合态和非结晶态CS。经原位合成纳米SiOx改性后,CS涂膜的衍射峰分别左移至8.4°、11.6°、18.5°和22.7°处,且在8.4°、11.6°两处衍射峰明显减弱,可能是原位合成纳米SiOx的表面活性基团与CS发生了作用,使水合态CS量减少,说明原位合成纳米SiOx影响CS的晶体形成。在SiOx/CS涂膜中继续加入LZM后,CS涂膜的衍射峰强度显著减弱,说明LZM与CS发生了化学键的作用,阻碍了CS晶体形成,水合态CS的量明显减少。LZM使CS分子的原有基本结构遭到破坏,水合态CS的衍射峰强度略有减弱,但非水合态CS的衍射峰消失,即未形成非水合态CS晶体。SiOx/CS涂膜中继续加入TP后,CS晶体衍射峰消失,且22.3°处出现宽衍射峰,这与TP的特征峰和原位合成纳米SiOx/CS涂膜相似,且衍射峰强度有所增加,TP的特征峰略有增强,说明TP阻碍了成膜过程中CS晶体的形成,形成了非晶态CS;在SiOx/CS涂膜中同时加入LZM/TP后,涂膜在8.6°、11.8°、18.72°和22.9°处出现衍射峰,说明涂膜脱水后形成了水合态、非水合态晶体和无定形态CS。这可能是由于LZM和TP共同加入至涂膜溶液中后,两者之间的活性基团形成了氢键等,故对CS脱水过程的影响减小。
1.2.2.2 各栏羊只采食量相对稳定后,进行日喂次数及方式观察[3]。喂料方式①,日喂2次,每日8:00、17:00各饲喂1次;喂料方式②,日喂3次,喂料时间8:00、13:00、17:00;喂料方式③,日喂2次,根据①日喂2次确定喂料量及补食时间,投喂①料量的90%左右,一定时间内采食完,再适当补料。
2.1.2 CS复合涂膜的微观形貌

图2 CS复合涂膜断面和表面的SEM图Fig.2 SEM images of the cross-section and surface of CS composite coatings
由图2A可见,未改性的CS涂膜断面较粗糙,存在较多的断裂缝隙和少量的团聚态颗粒。这可能是由于CS内部分子间的相互作用力较弱,导致涂膜在脱水过程中断裂;同时,由于涂膜液脱水不均匀,使部分团聚颗粒出现。加入原位合成纳米SiOx后,涂膜断面褶皱剧增呈堆积状,且裂隙数量减少,团聚态大颗粒基本消失(图2B),这是由于在涂膜液脱水过程中,原位合成的纳米粒子表面的活性基团与CS分子间形成了氢键,使涂膜脱水过程更加均匀,减弱了涂膜脱水过程中的应力损失[11]。在SiOx/CS中继续加入LZM后,可观察到涂膜断面褶皱减少,光滑、均匀,无颗粒出现(图2C),可能是由于LZM影响了CS的脱水过程,有效增强了分子间的相容性。在SiOx/CS中加入TP后,涂膜断面裂痕明显增多,且分布不均匀(图2D),分析认为可能是由于TP中存在大量的—OH,使之与CS分子形成了氢键,进而影响了CS的均匀脱水。因此,CS脱水后未形成晶体结构,与XRD结果一致。
在SiOx/CS中同时加入了LZM和TP后,涂膜断面粗糙,颗粒分布不均匀,但裂痕较小,涂膜表面较光滑,存在较多团聚颗粒(图2E、F)。这可能是由于LZM和TP相互作用,使TP对CS脱水影响的能力减弱,与原位合成纳米SiOx/TP/CS涂膜相比,CS脱水的有序性增强,这与XRD分析结果一致。
2.2 CS复合涂膜的理化性能

表1 CS复合涂膜理化性能Table 1 Physicochemical properties of CS composite coatings
由表1可见,当CS涂膜中加入原位合成纳米SiOx后,涂膜TS和EB均显著提高,可能是在形成涂膜的过程中,原位合成纳米SiOx与CS的结合增强了粒子与基体的界面黏合,有利于应力的传递,可承担一定的载荷,纳米粒子分散较均匀,从而增强了复合涂膜的力学性能[11]。
在原位合成纳米SiOx/CS涂膜的基础上继续分别加入LZM和TP,复合保鲜涂膜的TS和EB均增大,且原位合成纳米SiOx/TP/CS涂膜的EB高于原位合成纳米SiOx/LZM/CS涂膜。这可能是由于TP中的多羟基与CS中的氨基和羧基结合形成氢键,从而更加增强了涂膜内分子间的相互作用力[37]。当CS涂膜中同时加入原位合成纳米SiOx、LZM、TP时,复合涂膜力学性能最优。这可能是由于原位合成纳米SiOx使涂膜内CS分子通过纳米颗粒连接的同时,TP和LZM使涂膜内褶皱增多,则涂膜的强度、延展性及柔韧性改善。
以OP、CDP、WVTR为指标,检测复合涂膜的透气性。由表1可见,复合涂膜之间的WVTR并无显著性差异。当CS涂膜中加入原位合成纳米SiOx后,OP、CDP均显著降低,可能是原位合成纳米SiOx表面的羟基与CS分子间的氢键作用,使涂膜的致密性改善,裂痕减少,进而改变了涂膜气体的通透路径,气体透过率降低。继续分别加入LZM、TP两种保鲜剂,复合涂膜的OP、CDP显著降低。这可能是由于在成膜过程中LZM与CS发生化学键的作用,而TP可阻碍CS晶体的形成,二者分别与CS混合后相容性较好,分子间结合更加紧密。原位合成纳米SiOx/LZM/TP/CS复合涂膜OP、CDP最小,可能是LZM与TP共同加至涂膜溶液中后,两者之间活性基团形成了氢键等,故对CS脱水过程影响减小,使复合涂膜的阻气性增大,改变了涂膜内部的分子排列,形成了具有选择性的微孔,这与涂膜表征分析结果一致。与其他涂膜相比,原位合成纳米SiOx/TP/CS涂膜和原位合成纳米SiOx/LZM/TP/CS涂膜的透光性有所下降,可能是TP自身带有颜色,可吸收部分可见光,导致其透光性下降,且加入涂膜中TP的量也会对其透光性产生影响。
2.3 CS复合涂膜对海鲈鱼鱼片冷藏保鲜性能的影响
2.3.1 CS复合涂膜海鲈鱼鱼片贮藏过程中生化及感官指标变化


图3 CS复合涂膜处理后海鲈鱼鱼片新鲜度指标变化Fig.3 Changes in freshness indexes of sea bass fillets treated with CS composite coatings during storage
水产品的腐败变质主要是由于微生物的生长代谢引起的[38]。由图3B可见,在贮藏初期过程中,鱼片的菌落总数增长缓慢,但随着时间的延长,微生物生长速率增大。根据国际微生物规格委员会《微生物检验与食品安全控制》中食品微生物限量规定[39],鱼肉菌落总数达到5×105CFU/g时为可接受限量值,107CFU/g为最高安全限值。对照组鱼片在第7.5天时达到安全限值,不能食用。经CS涂膜及原位合成纳米SiOx/CS复合涂膜处理的鱼片在第12天达到此限值,经原位合成纳米SiOx/LZM/CS复合涂膜及原位合成纳米SiOx/TP/CS复合涂膜处理的鱼片在第15天达到此限值,而经原位合成纳米SiOx/LZM/TP/CS复合涂膜处理的鱼片在第18天达到此限值。说明复合涂膜能够显著抑制微生物的生长,从而延缓鱼片的腐败。
pH值是评价水产品新鲜度的重要指标。如图3C所示,在贮藏初期,随着贮藏时间的延长,海鲈鱼鱼片的pH值逐渐降低,且在第3天时达到最低点。这是由于鱼在停止呼吸后,鱼体内肌肉因糖原酵解而生成乳酸等有机酸及三磷酸腺苷分解成磷酸,导致鱼肉的pH值下降[40]。随着贮藏时间继续延长,鱼肉的pH值升高,这是由于随着微生物繁殖,鱼肉内蛋白质、氨基酸等物质分解为氨、三甲胺、吲哚等碱性物质,使pH值上升[41]。由于涂膜中含有醋酸,故经涂膜处理鱼片的pH值较低。贮藏3 d后,对照组鱼片pH值迅速上升,经涂膜处理的鱼片上升较为缓慢,其中原位合成纳米SiOx/LZM/TP/CS复合涂膜处理的鱼片上升最为缓慢,说明复合涂膜有效抑制了鱼片中微生物的生长繁殖及蛋白质和氨基酸的分解。
不饱和脂肪酸氧化产物中的丙二醛与硫代巴比妥酸反应生成有色化合物,通过在532 nm波长处测定其吸光度,从而可确定脂肪氧化的程度[42]。王煜坤[43]认为,鱼片中TBA值可接受性上限为1 mg/kg。由图3D可见,随着贮藏时间的延长,鱼片的TBA值逐渐增大,至第15天时,对照组鱼片TBA值为1.1 mg/kg,已超过可接受限值。经CS涂膜处理的鱼片在第18天时达到可接受限值,其余复合涂膜处理的鱼片在贮藏过程中均未达到此限值,且经原位合成纳米SiOx/LZM/TP/CS复合涂膜处理的鱼片增长速率最低,说明涂膜有效延缓了鱼肉中脂肪的氧化。
K值代表了鱼体内三磷酸腺苷的降解程度,被广泛应用于水产品鲜度指标的检测。通常认为,鱼肉一级新鲜度的K值小于20%,二级新鲜度K值小于50%,高于50%时可认为不新鲜[44]。由图3E可见,随着贮藏时间延长,对照组鱼片在第15天时接近不可接受限值,此时涂膜处理的鱼片均处于二级鲜度。贮藏至第18天时,CS涂膜和原位合成纳米CS/SiOx涂膜处理的鱼片均腐败,其余复合涂膜处理的鱼片仍处于二级鲜度。
TVB-N是指水产品在贮藏过程中,由于鱼肉中微生物和内源性酶的作用使蛋白质被分解成小分子的氨和胺类化合物的物质[45],其含量常用作评价水产品的鲜度指标,含量越高,表明鱼肉营养价值损失越大。GB/T 18108—2008《鲜海水鱼》[46]中规定,海水鱼一级鲜度为TVB-N含量≤15 mg/100 g,二级鲜度为TVB-N含量≤20 mg/100 g,三级鲜度为TVB-N含量≤30 mg/100 g。如图3F所示,在贮藏过程中,海鲈鱼鱼片的TVB-N含量逐渐增大,与对照组样品相比,涂膜处理后的样品TVB-N含量增长速率减慢。对照组样品在第18天时TVB-N含量为26.68 mg/100 g,已接近三级鲜度的限值,此时复合涂膜处理的样品TVB-N含量均在25 mg/100 g以下,其中经原位合成纳米SiOx/LZM/TP/CS复合涂膜处理的样品仍处于二级鲜度,说明复合保鲜涂膜有效地抑制了鱼片内微生物对蛋白质的分解。
研究结果表明,复合涂膜对海鲈鱼鱼片的抑菌保鲜效果明显,其在鱼体表面形成一层致密、均匀的保护膜,较大程度地阻止了外界微生物的进入。同时有效抑制了鱼体中细菌生长,减少了鱼肉内蛋白质、氨基酸分解,使产生的碱性物质较少,抑制了海鲈鱼的pH值的增长。同时,涂膜阻隔了海鲈鱼鱼片与外界环境的接触,降低了鱼体内的脂肪氧化速率,抑制了海鲈鱼肌肉中ATP的分解,从而使TBA值、K值、TVB-N含量上升缓慢。这一趋势与赵厚菲[47]的结论相似。CS涂膜经原位合成纳米SiOx改性后,保鲜性能增强,与对照组相比,鱼片货架期延长了3~4 d。原位合成纳米SiOx/CS涂膜中分别加入LZM、TP两种保鲜剂,可使鱼片货架期延长4~7 d。这分别与de-la-Re-Vega等[48]对LZM和鞠健等[49]对TP的研究结果相似。当原位合成纳米SiOx/CS涂膜中同时加入LZM和TP两种保鲜剂,其保鲜性能最优,可使货架期延长8~10 d。
2.3.2 CS复合涂膜处理后海鲈鱼鱼片贮藏过程中质构指标变化


图4 CS复合涂膜处理后海鲈鱼鱼片质构指标变化Fig.4 Changes in texture properties of sea bass fillets treated with CS composite coatings during storage
如图4所示,随着贮藏时间的延长,海鲈鱼鱼片的硬度、弹性、咀嚼度和回复性均呈下降趋势,这是由于鱼肉中的蛋白质在内源酶和微生物的作用下发生降解,导致肌肉变软、汁液流失。如图4A所示,随着贮藏时间的延长,鱼片的硬度逐渐下降,对照组鱼片的硬度始终低于同期涂膜处理后的鱼片,且经复合涂膜处理的鱼片要优于经单一CS涂膜处理的鱼片,其中经原位合成纳米SiOx/LZM/TP/CS复合涂膜处理的鱼片硬度下降最慢,硬度最高。分析认为,涂膜处理后,在鱼片表面形成了一层致密的保鲜涂膜,阻隔了鱼片与外界环境的物质交换,进而抑制了微生物的生长繁殖,减缓了鱼片内糖原降解,导致硬度下降缓慢;而加入保鲜剂的复合涂膜具有抗菌、抗氧化性能,有效减缓了鱼片的腐败程度。如图4B~D所示,随着贮藏时间的延长,鱼片的弹性、咀嚼度、回复性均呈下降趋势,这可能是由于鱼片内微生物代谢导致蛋白质空间结构遭到破坏所引起的。
3 结 论
CS涂膜中加入原位合成纳米SiOx、LZM、TP后可改善涂膜的微观结构及理化性能。与对照组相比,经复合涂膜处理后,鱼片鲜度指标(菌落总数、pH值、TBA值、K值和TVB-N含量)水平增长缓慢,而感官评分和质构指标水平下降减缓,说明复合涂膜有效地抑制了微生物的生长繁殖,延缓了脂肪氧化和蛋白质分解,提高了海鲈鱼鱼片的贮藏品质。
