草鱼鱼鳞抗菌肽与肉桂精油联合抑菌作用及机理
2020-12-31王雪燕张嘉敏施永清
王雪燕,陈 瑛,张嘉敏,施永清*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
抗菌肽的化学本质是多肽,具有非特异性抗细菌、真菌和病毒的作用[1]。不同于传统抗生素的作用机制,抗菌肽不易诱导耐药菌株的产生,且抗菌谱广,对细菌、真菌、病毒、原生动物和癌细胞均有作用[2]。它还具有稳定性好、水溶性好、对高等动物正常细胞几乎无伤害、在体内无残留等特点[3],是化学防腐剂、抗生素等防腐抗菌药物很好的替代品[4-5],抗菌肽乳酸链球菌素Nisin已成功作为天然食品防腐剂应用于食品防腐保鲜领域中[6-9]。关于鱼类抗菌肽的相关报道很多,如Lin等[10]从石斑鱼(Epinephelus coioides)中得到的抗菌肽Epinecidin-1分别对副溶血性弧菌(Vibrio parahaemolyticus)、大肠杆菌(Escherichia coli)DH5α均显示抑菌作用;Lauth等[11]研究表明源自条纹鲈(Morone saxatilis)皮肤和鳃的抗菌肽Moronecidin对所有的G+细菌和大多数G-细菌均有抑制作用。本项目团队经过数年酶解鱼鳞研究获得鱼鳞抗菌肽,其对G+细菌和G-细菌都有不同程度的抑菌效果[12]。天然植物精油也具有广谱抑菌活性,Friedman等[13]发现,肉桂醛、香芹酚、丁香酚和百里香酚这4 种物质具有较强的抑菌活性,对肠出血性大肠杆菌(enterohemorrhagicE.coli)O157:H7、鼠伤寒沙门菌(Salmonella typhimurium)、金黄色葡萄球菌(Staphylococcus aureus)等多种病原菌都表现出较强的体外抑菌活性[14-15]。但是,添加精油会使食品感官品质受到较大影响。将精油和抗菌肽复配使用,可以降低精油使用过多造成的感官影响[16]。
目前,国内外关于抗菌肽、精油的抑菌机制已有较多报道。抗菌肽通过破坏细胞膜完整性导致细胞裂解,或者通过与膜的相互作用形成瞬态孔隙,将抗菌肽运输到胞内并作用于胞内物质[17]。香辛料植物精油成分对微生物细胞抗菌作用机理为:降解细胞壁,破坏细胞质膜,破坏膜蛋白,使胞内成分渗出、胞质凝结,以及损耗分子主动运输力[18]。
目前关于草鱼鱼鳞抗菌肽和肉桂精油复配抑菌研究尚鲜见报道。本研究以草鱼鱼鳞抗菌肽、肉桂精油为原料,采用棋盘稀释法测定二者联合抑菌效果。通过对受试菌生长曲线、细胞膜渗透性、胞外乳酸脱氢酶活性测定以及分析菌膜穿膜效率等探究复配抑菌剂的抑菌机理,以期为研制抑菌联合制剂提供理论依据和数据参考。
1 材料与方法
1.1 菌株、材料与试剂
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella choleraesuis)、副溶血性弧菌(Vibrio parahaemolyticus)、黑曲霉(Aspergillus niger)、产黄青霉(Penicillium chrysogenum)、毛霉(Mucor wutungkiao)、根霉菌(Rhizopus)、酵母菌(Saccharomycetes)由浙江工商大学食品与生物工程学院微生物实验室提供。
草鱼鱼鳞抗菌肽由浙江工商大学食品与生物工程学院食品加工与活性包装实验室提供;肉桂精油 江西省吉水县益康天然香料油提炼厂。
NB培养基、NA培养基 杭州微生物试剂有限公司;碘化丙啶 上海麦克林生化科技有限公司;丙酮酸钠 阿拉丁试剂(上海)有限公司;烟酰胺腺嘌呤二核苷酸磷酸 上海源叶生物科技有限公司;宽分子质量标准蛋白Marker 日本TaKaRa公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Mini电泳仪、电泳槽、Gel Doc XR+凝胶成像系统美国Bio-Rad公司;YXQ-LS-18SI自控型手提式灭菌器、SPX-250B-Z生化培养箱 上海博迅医疗生物仪器股份有限公司;TGL-16gR台式高速冷冻离心机 上海安亭科学仪器厂;HYG-IIa回转式恒温调速摇瓶柜 上海欣蕊自动化设备有限公司;DDSJ-308A电导率仪 上海仪电科学仪器股份有限公司;UV-2600紫外-可见分光光度计 日本岛津公司;CytoFLEX流式细胞仪 美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 草鱼鱼鳞抗菌肽的制备及分子质量测定
参考顾晨涛[19]的方法并略作修改,采用酸性蛋白酶酶解鱼鳞,经葡聚糖凝胶Sephadex G-15、Sephadex G-50凝胶过滤层析和纤维素DEAE-52阴离子交换层析分离纯化制备草鱼鱼鳞抗菌肽,采用Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)法[20]测定其分子质量。
1.3.2 最小抑菌浓度测定
采用微量肉汤试管稀释法[21]测定鱼鳞抗菌肽和肉桂精油对金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、大肠杆菌、黑曲霉、产黄青霉、毛霉、根霉菌、酵母菌的最小抑菌浓度(minimal inhibitory concentration,MIC)。取200 μL生长至对数期(1×106CFU/mL)的菌液依次加入稀释后的试液中,分别得到质量浓度梯度256、128、64、32、16、8、4、2、1 μg/mL的鱼鳞抗菌肽试液,32、16、8、4、2、1、0.5、0.25 μL/mL的精油试液,每组做3 组平行。以只加入受试菌液为阴性对照,只加入抗菌肽或精油为阳性对照。将细菌置于37 ℃培养24 h,真菌28 ℃培养48 h,以管中出现弥散浑浊、底部有圆形或丝网状沉淀现象作为菌体生长观察指标[22],以无肉眼可见沉淀的试管所对应浓度为抗菌肽、肉桂精油的最小抑菌浓度。
1.3.3 联合抑菌效果评价
根据上述最小抑菌浓度测定结果,采用棋盘稀释法[23]进行联合抑菌实验。用含吐温-80的无菌水稀释经0.22 μm膜过滤灭菌的肉桂精油,分别得到剂量梯度为4 MIC、2 MIC、1 MIC的肉桂精油乳液(A)。用一定质量的草鱼鱼鳞抗菌肽配制质量浓度梯度为4 MIC、2 MIC、1 MIC的草鱼鱼鳞抗菌肽溶液(B)。取9 支含3 mL肉汤培养基的无菌试管,按照横排3 管纵列3 管的顺序排布,根据三因子二次正交法复配后,使得A、B的最终质量浓度分布如图1所示。在各组试管中分别加入200 μL受试菌悬液,漩涡振荡混匀,细菌置于37 ℃培养24 h,真菌28 ℃培养48 h,按1.3.2节法对各试管内菌株生长情况进行检验,实验重复3 次,取平均值。

图1 棋盘稀释法示意图Fig.1 Sketch map of checkerboard method
以分级抑菌浓度(fractional inhibitory concentration,FIC)指数作为复配抑菌实验结果评价的判定依据。计算公式如式(1)所示。

式中:MICA复配为A和B联用时A对应的最小抑菌浓度;MICB复配为A和B联用时B对应的最小抑菌浓度;MICA为A单独使用时的最小抑菌浓度;MICB为B单独使用时的最小抑菌浓度。
FIC指数判定标准为:FIC指数<0.5时为协同作用;0.5<FIC指数<1时为相加作用;1<FIC指数<2时为无关作用,FIC指数>2时为拮抗作用。
将实验结果显示协同作用的菌株继续测定生长曲线、细胞膜渗透性、胞外乳酸脱氢酶活性变化,并且采用流式细胞仪分析穿膜效率。
1.3.4 复配抑菌剂对菌体生长曲线的绘制
采用分光光度法[24]分析抑菌剂对受试菌生长曲线的影响。将受试菌株培养至对数生长期(1×106CFU/mL),分别加入1/4 MIC复配抑菌剂,以吐温-80水溶液作为空白对照。将对照组和实验组放入摇床中进行同步培养,每隔2 h取出对应的试管,振荡器上振荡8 s,立即用紫外-可见分光光度计测定OD600nm,连续测定24 h,记录实验结果,平行3 次取平均值。以抑菌时间为横坐标,OD600nm为纵坐标,绘制复配抑菌剂作用下受试菌的生长曲线。
1.3.5 电导率的测定
用磷酸盐缓冲液清洗活化后的受试菌体并使之混匀,使复配抑菌剂在菌悬液中的终质量浓度为1 MIC。取5 mL菌悬液,3 000 r/min离心15 min,取上清液,置于37 ℃(细菌)或28 ℃(真菌),120 r/min的摇床中,每隔2 h取样1 次,离心,取上清液3 mL测定其电导率[25]。最后121 ℃灭菌20 min,冷却后离心,测定上清液的电导率,以不加复配抑菌剂的吐温-80水溶液作为空白对照。实验重复3 次,取平均值。按式(2)计算相对电导率,以相对电导率反映细胞膜渗透性,相对电导率越高,细胞膜渗透性越强。

式中:K为某时刻电解质相对电导率/%;J0为摇床孵育前电导率/(mS/cm);J1为某时刻电导率/(mS/cm);J2为灭菌、冷却至室温后电导率/(mS/cm)。
1.3.6 胞外乳酸脱氢酶活力测定
参考陈惠等[26]方法并略作修改。在复配抑菌剂中加入培养至对数生长期的受试菌株至终质量浓度为1 MIC,以不加复配抑菌剂组为对照。置于37 ℃(细菌)、28 ℃(真菌),120 r/min的摇床中培养,每隔4 h取样,离心(8 000 r/min,10 min),将35 mg烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)用10 mL 0.2 mol/L pH 8.0的磷酸缓冲液稀释,得到NADH溶液(现配现用)。将5.0 mg丙酮酸钠用58 mL 0.2 mol/L pH 8.0的磷酸缓冲液稀释,得到丙酮酸钠溶液(现配现用),并于25 ℃水浴中提前预热。取适量0.2 mol/L pH 8.0的磷酸缓冲液于340 nm波长处调零后,将10 μL上述离心上清液加入至5.8 mL NADH及0.2 mL丙酮酸钠溶液中,用紫外-分光光度计于340 nm波长处测定吸光度,重复3 次,取平均值,以吸光度为纵坐标、时间为横坐标作标准曲线以计算每分钟吸光度的变化值;通过考马斯亮蓝法测定样品中蛋白质的质量浓度,再按照公式(3)计算胞外乳酸脱氢酶的比活力。

式中:L为乳酸脱氢酶比活力/(U/mg);ΔA340nm/min为每分钟吸光度变化值;B为稀释倍数;V1为上清液体积/μL;ρ为蛋白质量浓度/(mg/mL)。
1.3.7 流式细胞仪分析菌膜完整性及穿膜效率
将受试菌液培养至对数生长期,离心(8 000 r/min、10 min),用生理盐水洗涤2~3 次,再重悬为1×106CFU/mL的菌悬液。加入经50 μg/mL碘化丙啶染液标记的复配抑菌剂溶液,至终质量浓度为1 MIC,漩涡振荡混匀[27]。细菌置于37 ℃、真菌于28 ℃避光孵育2 h,同时以等体积生理盐水作阴性对照。结束后,离心(8 000 r/min、15 min),用生理盐水洗涤2~3 次以洗去多余的荧光染料,离心洗涤后用生理盐水重悬,用流式细胞仪检测菌体穿膜效率[28]。实验做3 组平行,取平均值。
1.4 数据分析
实验结果采用Excel 2010软件进行处理,并用Origin 8.0软件对实验数据进行作图。
2 结果与分析
2.1 Tricine-SDS-PAGE结果
将经酸性蛋白酶酶解、Sephadex G-15、Sephadex G-50和DEAE-52层析柱分离纯化后得到的草鱼鱼鳞抗菌肽进行Tricine-SDS-PAGE分析,结果见图2。

图2 草鱼鱼鳞抗菌肽Tricine-SDS-PAGE图谱Fig.2 TSDS-PAGE electrophoregram of antimicrobial peptide from grass carp scale
由图2可知,分离纯化后的草鱼鱼鳞抗菌肽只显示出单一条带,说明草鱼鱼鳞抗菌肽已达到电泳纯。利用凝胶成像系统软件分析得出其分子质量约为14.3 kDa。
2.2 联合抑菌效果分析
以金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、大肠杆菌、黑曲霉、产黄青霉、毛霉、根霉菌、酵母菌为受试菌,测定草鱼鱼鳞抗菌肽与肉桂精油联合抑菌效果,结果如表1所示。草鱼鱼鳞抗菌肽对金黄色葡萄球菌、沙门氏菌的MIC为16 μg/mL,对副溶血性弧菌、大肠杆菌、产黄青霉的MIC为32 μg/mL,对黑曲霉、毛霉、根霉菌、酵母菌的MIC为64 μg/mL,表现出广谱抑菌活性。其中,对金黄色葡萄球菌类革兰氏阳性菌及沙门氏菌等革兰氏阴性菌的抑菌效果相较于Li Chunlei等[29]所研究的AI-Hemocidin 2抗菌肽对革兰氏阳性和革兰氏阴性菌的抑菌效果(MIC为37.5~300.0 μg/mL)好;且抑菌效果明显优于王洁等[30]所研究的Cn-AMP2抗菌肽对革兰氏阳性和革兰氏阴性菌的抑菌效果(MIC为50~100 μg/mL)。
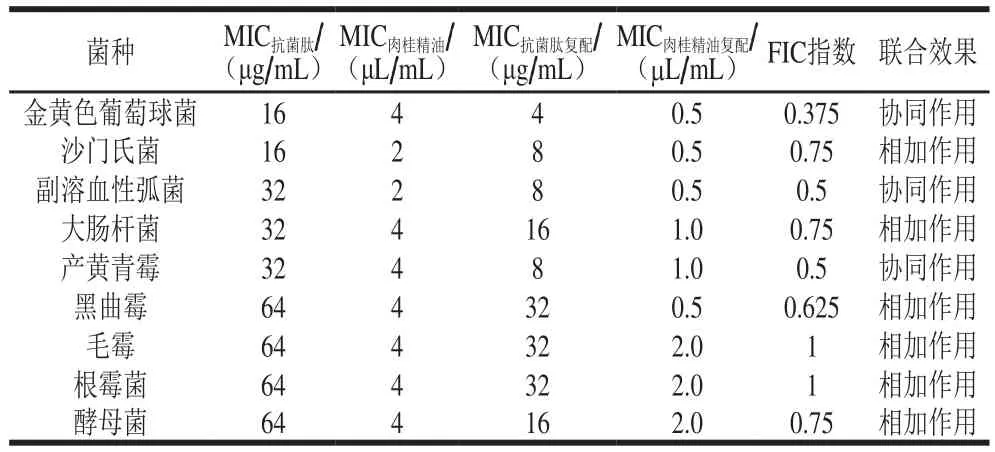
表1 抗菌肽和肉桂精油联合抑菌MIC及联合效果评价Table 1 Minimal inhibitory concentration and antimicrobial effects of antimicrobial peptide combined with cinnamon essential oil
肉桂精油对受试细菌的MIC范围为2~4 μL/mL,对真菌的MIC为4 μL/mL。相较于王一非等[31]研究所得留兰香微乳体系对大肠杆菌、金黄色葡萄球菌、酵母菌的MIC为8~32 μL/mL,肉桂精油表现出了较强的抑菌活性。
草鱼鱼鳞抗菌肽与肉桂精油联用时对金黄色葡萄球菌、副溶血性弧菌、产黄青霉的FIC指数分别为0.375、0.5、0.5,表现为协同作用;对沙门氏菌、大肠杆菌、黑曲霉、毛霉、根霉菌、酵母菌的FIC指数大于0.5,表现为相加作用;对所有受试菌均无拮抗作用。复配抑菌剂中鱼鳞抗菌肽MIC范围为4~32 μg/mL,肉桂精油为0.5~2.0 μL/mL,均优于单独使用的效果。
2.3 复配抑菌剂对菌体生长曲线的影响
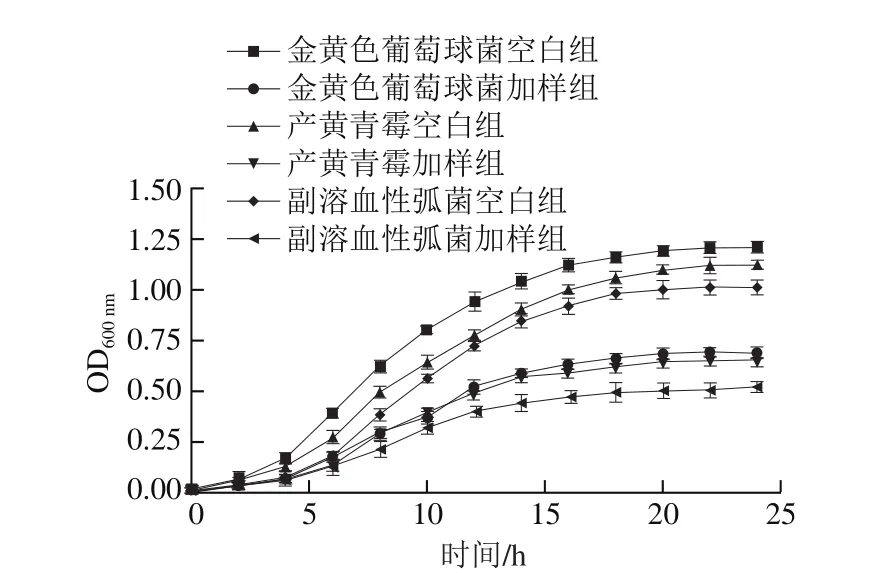
图3 肉桂精油复配剂对受试菌生长曲线的影响Fig.3 Effect of antimicrobial combination on growth curve of tested strains
由图3可以看出,复配剂对受试菌的生长曲线产生了不同程度的影响。在0~2 h内,空白组与加样组菌体的生长速率相差不明显,2~16 h加样组生长速率明显较慢,16~24 h内两组的菌体生长速率都有所减慢,且样品组减慢的速率更快,该现象与卢晓等[32]研究发现0.2 mg/mL没食子酸对金黄色葡萄球菌生长曲线的影响相似。可能是复配抑菌剂的存在一定程度上影响了受试菌的生长周期,导致菌体对数生长期缩短、衰亡期加快以及生长速率缓慢,从而达到抑菌作用。
2.4 复配抑菌剂对细胞膜渗透性分析结果

图4 肉桂精油复配剂对受试菌细胞膜渗透性的影响Fig.4 Effect of antimicrobial combination on cell membrane permeability of tested strains
由图4可以看出,加入复配抑菌剂的菌体细胞相对电导率明显高于对照组,在处理2 h后相对电导率变化明显加快,8 h后变化相对减缓。这说明在抑菌剂的作用下,细胞膜的渗透性发生改变,使胞内钾离子、钠离子等电解质的不断外漏,相对电导率持续增加。而经过长时间的处理后,由于大量离子的丢失导致菌体胞内稳定环境被破坏,相对电导率变化减缓。本实验中4~8 μg/mL鱼鳞抗菌肽与肉桂精油复配对各受试菌相对电导率为50%~75%,与刘俊义等[33]所研究的0.45~0.50 mg/mL文冠果种仁甾醇相比效果更明显(对受试菌相对电导率为25%~35%)。
2.5 复配抑菌剂对胞外乳酸脱氢酶活力分析结果

图5 肉桂精油复配剂对受试菌乳酸脱氢酶比活力的影响Fig.5 Effect of antimicrobial combination on lactic dehydrogenase specific activity of tested strains
由图5可知,加样组的胞外乳酸脱氢酶比活力均明显高于对照组,在4~12 h内胞外乳酸脱氢酶比活力增加明显,12 h后相对减缓。可能是抑菌剂作用于受试菌体细胞膜上的某些靶点,使得细胞膜受到一定程度的损伤后原先存在于细胞质中的乳酸脱氢酶外泄至膜外。随着作用时间的延长,由于胞内的乳酸脱氢酶不断地溢出,严重影响了细胞正常的糖酵解及呼吸代谢过程,从而达到了抑菌作用。
2.6 复配抑菌剂对菌膜穿膜效率分析结果

图6 流式细胞仪分析复配抑菌剂处理对金黄色葡萄球菌细胞的影响Fig.6 Flow cytometry analysis of the effect of antimicrobial combination on Staphylococcus aureus cells

图7 流式细胞仪分析复配抑菌剂处理对产黄青霉细胞的影响Fig.7 Flow cytometry analysis of the effect of antimicrobial combination on Penicillium chrysogenum cells
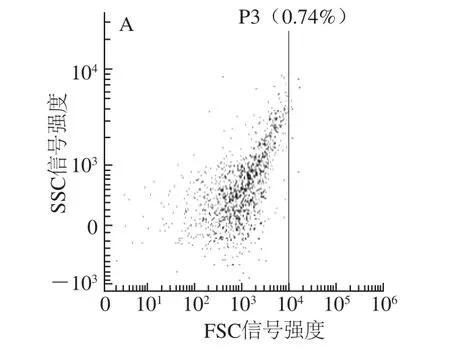
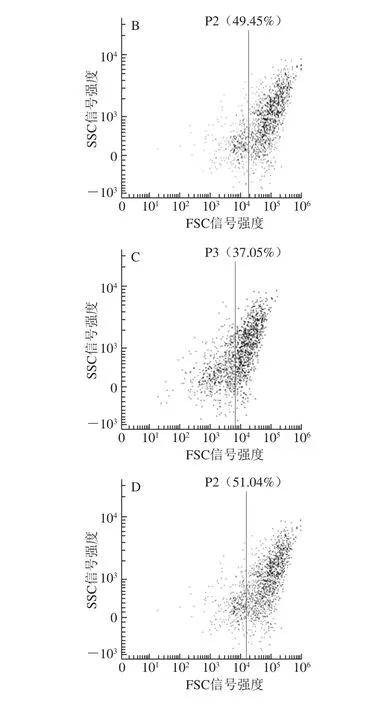
图8 流式细胞仪分析复配抑菌剂处理对副溶血性弧菌细胞的影响Fig.8 Flow cytometry analysis of the effect of antimicrobial combination on Vibrio parahaemolyticus cells
由图6~8可知,经复配抑菌剂处理的金黄色葡萄球菌穿膜效率达到了72.76%,与单独使用肉桂精油(57.61%)、鱼鳞抗菌肽(38.16%)相比有明显差异。产黄青霉穿膜效率达到了61.56%,与单独肉桂精油(51.04%)、鱼鳞抗菌肽(30.08%)相比有明显差异。副溶血性弧菌穿膜效率达到了51.04%,与单独使用肉桂精油(49.45%)、鱼鳞抗菌肽(37.05%)相比,有一定提升效果。与卢佳等[34]所研究的少棘蜈蚣抗菌肽Scolopin 2-NH2(穿膜效率41.28%、43.05%)相比抑菌效果明显。
可见,草鱼鱼鳞抗菌肽与肉桂精油复配剂对于产黄青霉、金黄色葡萄球菌、副溶血性弧菌抑制效果明显,且比单独使用时增效明显。
3 结 论
本研究结果表明分子质量约为14.3 kDa的草鱼鱼鳞抗菌肽与肉桂精油联用对金黄色葡萄球菌、副溶血性弧菌、产黄青霉表现为协同作用;对沙门氏菌、大肠杆菌、黑曲霉、毛霉、根霉菌、酵母菌表现为相加作用,对所有受试菌均无拮抗作用。复配抑菌剂的抑菌机理可能是通过影响菌体的生长周期,致使菌体出现对数生长期的缩短以及衰亡期的加快;通过改变细胞膜通透性,使得胞内电解质物质、乳酸脱氢酶不断地溢出到胞外,细胞生长受到抑制进而导致死亡。但其具体的抑菌机制尚有待于进一步研究,希望本实验能为进一步研究抗菌肽与精油复配剂的抑菌机制和开发高效安全、绿色环保的抑菌剂提供理论依据。
