二甲双胍联合醋酸环丙孕酮治疗多囊卵巢综合征的价值分析*
2020-12-31李雪丽王鑫丹杨兴兴刘春明
李雪丽,王鑫丹,高 干,杨兴兴,刘春明
(广西壮族自治区柳州市妇幼保健院医学检验科,广西 柳州 545001)
多囊卵巢综合征(PCOS)属常见内分泌代谢综合征,育龄期女性多发,表现为长期无排卵、雄激素异常增多及胰岛素抵抗(IR),是造成女性不孕的重要原因,且子宫内膜癌发病风险高[1],延续至中老年阶段可能增加糖尿病、高血压、心血管病等患病风险[2]。目前,尚未完全阐明PCOS 发病机制,公认其为多因素诱导复杂性疾病,常伴IR、糖脂代谢异常。以往对PCOS 血脂代谢紊乱报道多集中于三酰甘油、总胆固醇等方面[3]。近年来发现,载脂蛋白 B(ApoB)、载脂蛋白 A1(ApoA1)等均参与PCOS IR 过程[4],载脂蛋白 E(ApoE)参与代谢综合征发病过程[5]。最新研究表示,PCOS 胰岛素敏感性降低引起的代偿性高胰岛素血症与PCOS 代谢及生育障碍存在密切联系[6]。目前,主张对PCOS 的治疗需在传统促排卵基础上辅以纠正IR,预防代谢综合征,改善脂代谢紊乱,纠正糖代谢异常[7]。醋酸环丙孕酮系国内外治疗高雄激素血症的一线药物,国内已作为PCOS 促排卵及超排卵前期常用药物,可提高排卵率[8]。但药理研究发现,醋酸环丙孕酮长期用药可能加重IR 及患者脂代谢紊乱[9],故加用胰岛素增敏剂联合干预纠正IR 以提高胰岛素敏感性。二甲双胍为胰岛素增敏药物,降糖作用明显[10]。本研究中探讨了二甲双胍联合醋酸环丙孕酮治疗PCOS对脂质代谢、性激素及胰岛素抵抗指数(HOMA-IR)的改善效应,为胰岛素增敏剂用于PCOS 治疗提供临床证据。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:已婚;年龄大于20 岁;符合中华医学会妇产科学会通过的PCOS 诊断及治疗专家共识中PCOS诊断条件[11];稀发排卵或无排卵,有高雄激素表现,超声提示多囊卵巢,单侧或双侧卵巢小卵泡发育超过12 个月,单个直径约为2 ~10 mm 或卵巢体积超过10 mL;经证实输卵管通畅,无宫腔病变;病例资料完备。
排除标准:分泌性激素肿瘤、先天性肾上腺皮质增生等其他病因所致高雄性激素水平;卵巢早衰、闭经、甲状腺功能异常或高泌乳素血症等所致排卵障碍;近期有性激素药物应用史;严重心、肝、肾、肺功能障碍;严重糖尿病;全身恶性肿瘤;过敏体质。
病例选择与分组:选取医院门诊2016 年1 月至2019 年2 月收治的接受醋酸环丙孕酮及其联合二甲双胍治疗的患者100 例,按治疗方式的不同分为A 组(41 例)和 B 组(59 例)。两组患者一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表 1。
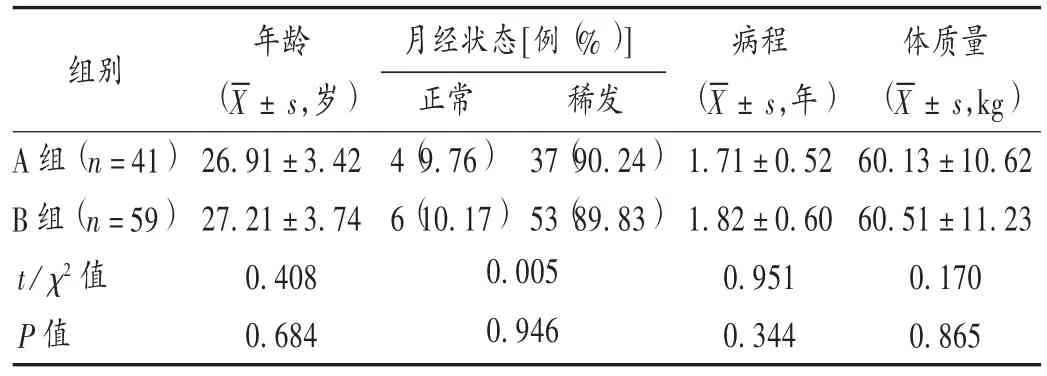
表1 两组患者一般资料比较
1.2 方法
A 组患者自月经期或黄体酮撤退性出血第5 日开始服用醋酸环丙孕酮片(湖北葛店人福药业有限责任公司,国药准字 H20056637,规格为每片50 mg),1 次 1 片,连服3 周后停药1 周,以此为1 个周期,连续用药3 个周期。B 组患者在此基础上加用盐酸二甲双胍肠溶片(上海上药信谊药厂有限公司,国药准字H20050699,规格为每片 0.5 g)治疗,初始剂量为 0.5 g / d,晚餐后服用,随后每周增加0.5 g,最大日剂量不超过2.0 g,根据血糖及病情调整用量,连续用药12 周。治疗12 周后,两组停药,行排卵诱导治疗,自第4 个月经周期第5 日开始,肌肉注射促性腺激素(75 ~150 U)低剂量渐进性增量方式诱导排卵,阴道彩超监测卵泡生长情况,优势卵泡直径约为19 ~21 mm 时肌肉注射人绒毛膜促性腺激素(5 000 ~10 000 U),继续监测排卵情况。
1.3 观察指标
脂质代谢:分别于治疗前、治疗12 周采集患者的外周静脉血,采用免疫比浊法测定 ApoA1,ApoB,ApoE 水平,试剂盒购自美国雅培公司,严格按试剂使用说明操作,并计算ApoB / ApoA1 比值。
性激素:分别于治疗前、治疗12 周月经期或撤退性出血第2 日至第5 日采集空腹外周静脉血3 mL 检测性激素水平,采用化学发光法测定促卵泡生成素(FSH)、黄体生成激素(LH)、睾酮(T)、雌二醇(E2)水平,化学发光仪购自美国雅培公司,并使用配套试剂。
IR 情况:分别于治疗前、治疗12 周行口服葡萄糖耐量试验及胰岛素释放试验,禁食10 h 后,服无水葡萄糖溶液,采用葡萄糖氧化酶法测定空腹血糖(FBG)水平、放射免疫法测定空腹胰岛素(FINS)水平,参照胰岛素稳态模型(HOMA)[12]计算胰岛素敏感指 数 (ISI)及 HOMA -IR,ISI =1 / (FBG × FINS),HOMA -IR =FINS × FBG /22.5。
排卵及卵巢形态:治疗前、治疗12 周月经或撤退性出血第2 日至第5 日经阴超监测卵泡生长情况,优势卵泡直径不小于16 mm 视为可能排卵,记录卵泡数及排卵率。观察卵巢形态,取卵巢最大切面,勾画卵巢及间质范围,自动计算卵巢间质面积(SA)、卵巢总面积(TA)及两者比值(SA / TA)。
安全性:统计患者用药期间的不良反应发生情况。
1.4 统计学处理
采用SPSS 19.0 统计学软件分析。计数资料以构成比(%)表示,组间差异对比用 χ2或 Fisher 确切概率分析;计量资料均经检验满足正态性与方差齐性要求,以表示,行 t 检验。P < 0.05 为差异有统计学意义。
2 结果
结果见表2 至表6。
3 讨论
PCOS 存在异质性,其发病机制尚未完全明确,PCOS 血脂异常与生殖功能异常密切相关[13]。朱亚莉等[14]发现,合并代谢综合征的PCOS 患者三酰甘油、低密度脂蛋白胆固醇水平远高于正常人,且伴ApoB/ApoA1 调节紊乱。本研究结果显示,治疗前,PCOS 患者ApoA1,ApoB/ApoA1,ApoE 均异常升高,ApoB 水平异常降低,提示PCOS 伴明显脂质代谢紊乱现象,与文献[14]的研究结果一致,推测血脂异常可能参与PCOS 代谢紊乱过程。最新研究显示,PCOS 常伴IR,伴不同程度糖代谢紊乱,且伴IR 的PCOS 病例常有较高的心血管病、糖尿病发病风险[15]。PCOS 生殖障碍与 IR 密切关联,IR 引起胰岛素异常上升,诱发高胰岛素血症,导致卵泡膜细胞增厚,抑制卵泡排出[16]。持续异常高胰岛素水平影响机体肝脏性激素结合球蛋白生成,造成游离雄激素水平升高,促进卵泡膜细胞雄激素合成,诱导高雄激素血症[17]。而高雄激素经外周脂肪作用转化为雌酮,引起机体雌激素水平异常上调,刺激LH 分泌,进一步影响卵泡发育,表现为排卵障碍。本研究结果显示,PCOS患者治疗前性激素水平LH 及T 水平均异常升高,E2水平异常降低,同时伴糖代谢异常,呈明显IR 表现,胰岛素敏感性降低,FINS 和FBG 水平升高,卵泡数异常增多,与文献[16-17]的研究结果一致。上述因子水平高于正常同龄女性。分析IR 可能为PCOS 代谢异常的关键机制,主要原因:1)IR 影响PCOS 胰岛素肝脏、脂肪、肌肉组织葡萄糖利用及转运,影响脂质降解障碍,且持续增高胰岛素,可与垂体周围相关受体结合,进一步促进LH生成,强化卵泡内膜17-羟化酶作用,促成雄激素合成;同时,刺激卵巢、肾上腺素雄激素合成,加重IR[18];2)持续异常高雄激素水平抑制卵泡成熟,造成下丘脑-垂体-卵巢轴功能障碍,导致优势卵泡缺乏,影响受孕。
表2 两组患者脂质代谢指标比较()

表2 两组患者脂质代谢指标比较()
组别ApoA1(g/L) ApoB(g/L) ApoE(mg/dL) ApoB/ApoA1 A 组(n=41)B 组(n=59)t 值P 值治疗前1.13 ± 0.22 1.15 ± 0.21 0.459 0.647治疗 12 周1.11 ± 0.15 0.89 ± 0.11 8.463< 0.001治疗 12 周1.10 ± 0.25 0.67 ± 0.16 10.488< 0.001治疗前0.99 ± 0.21 1.00 ± 0.23 0.221 0.825治疗 12 周1.01 ± 0.12 1.32 ± 0.14 11.533< 0.001治疗前4.12 ± 1.01 4.09 ± 0.97 0.150 0.881治疗12 周4.06 ± 0.97 3.56 ± 0.71 2.977 0.004治疗前1.14 ±0.13 1.15 ±0.15 0.346 0.730
表3 两组患者性激素水平比较()

表3 两组患者性激素水平比较()
组别A 组(n=41)B 组(n=59)t 值P 值FSH(U/L) LH(U/L) T(nmol/L) E2(pmol/L)治疗前6.95 ± 1.66 6.98 ± 1.73 0.086 0.931治疗 12 周6.57 ± 2.01 6.49 ± 1.87 0.204 0.838治疗前5.51 ± 1.23 5.53 ± 1.19 0.081 0.935治疗前13.76 ± 4.65 13.82 ± 4.83 0.062 0.950治疗 12 周8.78 ± 0.91 7.37 ± 0.62 9.221< 0.001治疗12 周2.53 ± 0.67 1.26 ± 0.42 11.646< 0.001治疗前126.75 ± 14.14 129.52 ± 13.65 0.983 0.327治疗 12 周141.65 ± 9.25 135.26 ± 7.52 3.800< 0.001
表4 两组患者胰岛素抵抗情况比较()
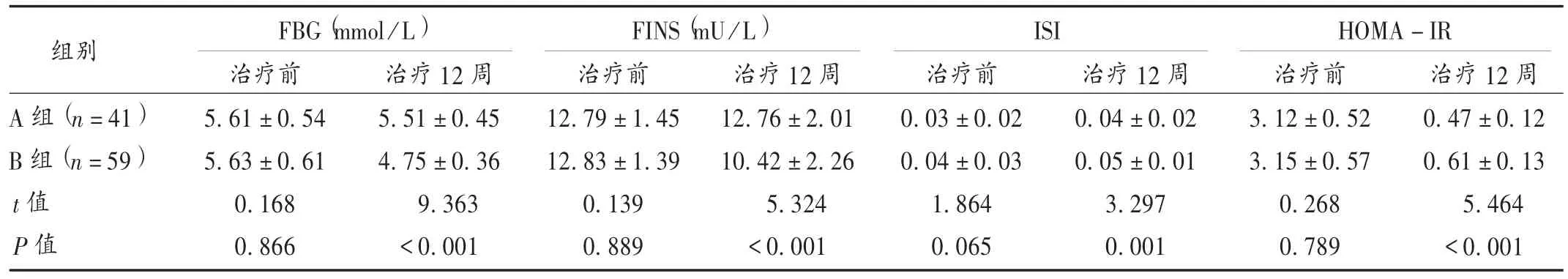
表4 两组患者胰岛素抵抗情况比较()
组别A 组(n=41)B 组(n=59)t 值P 值FBG(mmol/L) FINS(mU/L) ISI HOMA-IR治疗前5.61 ± 0.54 5.63 ± 0.61 0.168 0.866治疗 12 周5.51 ± 0.45 4.75 ± 0.36 9.363< 0.001治疗 12 周12.76 ± 2.01 10.42 ± 2.26 5.324< 0.001治疗 12 周0.47 ± 0.12 0.61 ± 0.13 5.464< 0.001治疗前12.79 ± 1.45 12.83 ± 1.39 0.139 0.889治疗前0.03 ± 0.02 0.04 ± 0.03 1.864 0.065治疗12 周0.04 ± 0.02 0.05 ± 0.01 3.297 0.001治疗前3.12 ±0.52 3.15 ±0.57 0.268 0.789
表5 两组患者排卵及卵巢形态学参数比较()
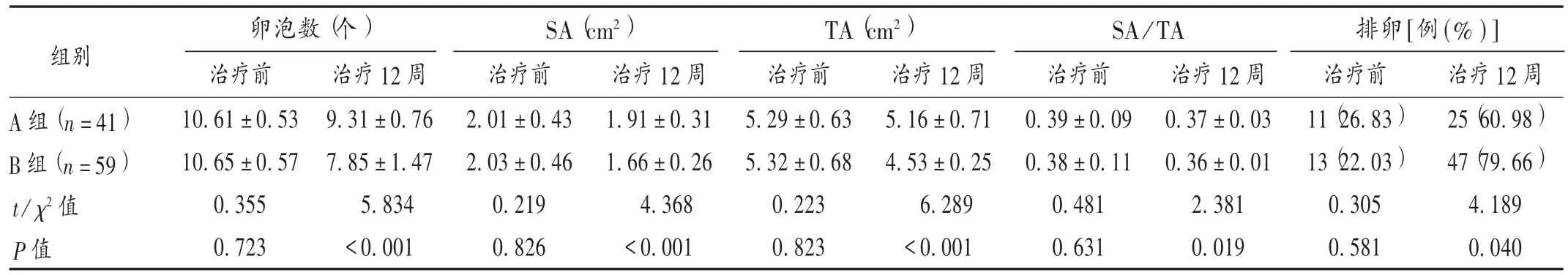
表5 两组患者排卵及卵巢形态学参数比较()
卵泡数(个) SA(cm2) TA(cm2) SA/TA 排卵[例(% )]组别A 组(n=41)B 组(n=59)t/ χ2 值治疗 12 周9.31 ±0.76 7.85 ±1.47 5.834< 0.001治疗 12 周25(60.98)47(79.66)4.189 0.040治疗前10.61 ±0.53 10.65 ±0.57 0.355 0.723治疗前2.01 ±0.43 2.03 ±0.46 0.219 0.826治疗 12 周1.91 ±0.31 1.66 ±0.26 4.368< 0.001治疗前5.29 ±0.63 5.32 ±0.68 0.223 0.823治疗12 周5.16 ±0.71 4.53 ±0.25 6.289< 0.001治疗前0.39 ±0.09 0.38 ±0.11 0.481 0.631治疗 12 周0.37 ±0.03 0.36 ±0.01 2.381 0.019治疗前11(26.83)13(22.03)0.305 0.581 P 值
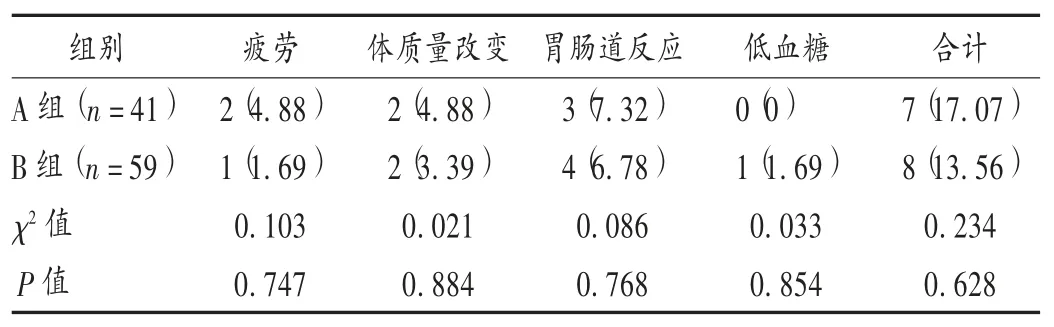
表6 两组患者不良反应发生情况比较[例(%)]
临床治疗中必须重视PCOS 脂代谢紊乱、高雄性激素水平及IR 的纠正。二甲双胍、噻唑烷二酮类药物均为常用降胰岛素药物,但二甲双胍相较传统噻唑烷二酮类药物耐受性更高,不良反应更少。其可通过抑制肝糖原异生及输出,强化外周组织对葡萄糖的利用率,提升胰岛素的敏感性,进而改善机体IR[19]。二甲双胍可抑制细胞色素P450 活性,抑制雄激素合成效应[20]。醋酸环丙孕酮系人工合成类17-孕酮衍生物,通过负调控作用影响垂体释放促性腺激素,减少雄激素及LH 分泌;同时可抑制5α-还原酶活化,抑制睾酮释放;炔雌醇可抑制细胞色素P450 活性,提升性激素结合蛋白浓度,抑制游离T 释放[21]。醋酸环丙孕酮存在一定的糖皮质激素激动作用,对肾上腺皮质激素活性存在抑制效应,可减少肾上腺雄激素释放[22]。已证实醋酸环丙孕酮治疗PCOS 疗效优于妈富隆等其他类型避孕药物[23]。本研究结果显示,B 组患者脂代谢紊乱改善情况优于A 组,治疗 12 周后的 ApoA1,ApoB/ApoA1,ApoE 均较 A 组低,ApoB 上升,而A 组无明显改变,推测二甲双胍存在一定的调脂作用。分析可能与二甲双胍可通过激活磷酸腺苷活化蛋白激酶途径,调节能量代谢,抑制PCOS 脂肪合成,诱导脂质氧化,提升周围组织对葡萄糖摄取率作用,减轻肝脏糖原异生,提高胰岛素敏感性,提升脂肪组织、肌肉组织及胰岛素受体络氨酸激酶活性,改善机体脂质紊乱有关。本研究中,发现B 组患者性激素水平改善情况优于A 组,突出表现为LH 和T 水平降低,E2水平上升,同时 FBG,FINS,HOMA-IR 均下降,ISI 上升,表明联合治疗有助于调节PCOS 性激素水平,改善IR现象。二甲双胍可作用于胰岛素靶组织肝细胞、平滑肌细胞及脂肪细胞,提升以上组织对胰岛素的敏感性,降低LH 和胰岛素水平,抑制T 合成;二甲双胍直接作用于卵巢,抑制雄激素合成所需细胞色素羟化酶活性,降低雄激素表达;醋酸环丙孕酮与胰岛素增敏剂二甲双胍联合应用可抑制垂体释放LH,降低卵巢源性雄激素生成,减少游离T,改善内分泌环境,促进卵巢微环境恢复,有助于排卵,改善生殖障碍[24]。
本研究结果还显示,B 组患者干预12 周后排卵情况改善,卵泡数、SA、TA、SA/TA 比值均较 A 组低,卵巢形态改善,体积缩小。两者药物联合应用可恢复内分泌调节轴功能,减少其对排卵的干扰,有助于促排药物发挥作用,利于优质卵泡生成,抑制高雄激素、高LH 及高胰岛素水平所致卵泡膜间质细胞增生,改善卵巢微环境,促进排卵及受孕。两组患者治疗期间均未发生严重不良反应,前期不良事件以胃肠道反应、疲劳为主,停药后可改善,表明联合应用安全性好。
综上所述,采用二甲双胍联合醋酸环丙孕酮治疗PCOS,可改善脂质代谢紊乱,减轻胰岛素抵抗,增加胰岛素敏感性,降低雄激素水平,纠正性激素紊乱,改善卵巢微环境,促进排卵,改善生殖功能。
