前列腺素E2受体拮抗剂对肝癌细胞增殖迁移及EP4R/Snail 和EP4R/c-myc表达的影响观察
2020-12-31陆玉宋莎莎章礼久
陆玉,宋莎莎,章礼久
安徽医科大学第二附属医院,合肥230601
肝癌是世界上最恶性的肿瘤之一,也是导致癌症相关死亡的第3大原因[1]。尽管手术和药物治疗有所改善,但复发和转移导致肝癌患者的预后较差[2]。肝癌的发生是一个多细胞、多分子、多基因的复杂过程。目前已经发现一些分子通路参与了肝癌的发生、发展、血管生成和转移。前列腺素E2(PGE2)是由环氧合酶-2 (COX-2)和前列腺素E合酶产生的花生四烯酸代谢物[3]。研究[4,5]表明,PGE2通过与不同前列腺素E(EP)受体亚型结合,诱导肿瘤细胞的生长和细胞增殖,增强肿瘤细胞入侵和迁移,抑制肿瘤细胞凋亡,并促进肿瘤血管生成,参与乳腺癌、胃癌、胰腺癌、肺癌、肝癌、前列腺癌和其他癌症的发展。PGE2通过介导四种亚型(EP1~4)的EP受体发挥多种生物学作用,其中EP4受体(EP4R)与多种人类癌细胞的增殖和侵袭密切相关[6,7]。
Snail是近年发现的一种转录因子,通过影响细胞间黏附分子的表达从而促进肿瘤细胞转移和侵袭[8]。此外,肝癌的发生发展也与原癌基因的激活或过表达有关[9]。c-myc原癌基因是禽骨髓细胞瘤病毒癌基因(v-myc)的人类细胞同源物,它编码转录因子c-myc蛋白,上调许多靶基因的表达,从而促进细胞增殖和肿瘤发生。PGE2/EP4R信号通路在肝癌发生发展中发挥着重要的作用,同时c-myc和Snail是肿瘤微环境环节中的重要调节因子,他们之间可能存在相互作用,但目前其之间的相互关系在肝癌中的报道少见。2017年10月~2019年5月,本研究观察了前列腺素E2受体拮抗剂CJ-42794对肝癌细胞增殖迁移及Snail和c-myc表达的影响,以探讨PGE2/EP4R信号通路在肝癌细胞增殖、迁移中的作用及与c-myc、Snail之间的相互关系,为肝癌的临床诊治提供新的靶点。
1 材料与方法
1.1 细胞、试剂及仪器 HepG2和Huh7细胞系购自中国科学院细胞库(上海)。细胞在含有10%胎牛血清(FBS)的DMEM和1%青霉素/链霉素的完整培养基(高糖)中培养,培养基温度为37 ℃,加5% CO2的湿化培养箱。 PGE2和EP4R选择性拮抗剂(CJ-42794)购自德国 MCM公司,DMEM、血清、胰酶均购自美国 Gibco 公司,EP4 单克隆抗体购自英国 Abcam 公司,c-myc和Snail一抗购自美国 Affinity 公司,山羊抗兔和山羊抗鼠二抗购自美国 Affinity 公司。
1.2 细胞分组及药物处理 收集对数期生长的HepG2和Hum7细胞,常规消化后,以含10% FBS的DMEM 培养液重悬细胞,调整细胞浓度至5×104个/mL。将HepG2和Hum7细胞分别分为对照组、PGE2组、观察组。以每孔100 μL(3×103个)细胞接种于96孔培养板中(重复3块),每组6个复孔,37 ℃、5% CO2条件下过夜。更换培养基,对照组加入相同体积溶媒,PGE2组分别加1、2、5 μmol/L 的PGE2(A,B,C组),观察组加入5 μmol/L的 PGE2 +5 μmol/L的 cj-42794 ,37 ℃,5% CO2条件下分别培养24 h和48 h。
1.3 各组细胞增殖、迁移能力观察 细胞增殖能力:采用MTT法。各组加药培养结束后,每孔加入10 μL的0.5% MTT溶液(终浓度0.5 mg/mL),继续37 ℃,5% CO2条件下孵育4 h。4 h后吸取96孔板中的混合液,再添加150 μL异丙醇,振荡10 min。将96孔板置于酶标仪中,于570 nm (630 nm作为参考)处测各孔吸光度值(OD值) ,计算细胞增殖情况。细胞相对增殖率 = 实验组OD均值/对照组OD均值 × 100%。细胞迁移能力:采用Transwell法。取130 μL DMEM滴于上室内使膜亲水。取各组处理24 h后的HepG2细胞和Huh7细胞常规消化离心,用1 mL无血清DMEM培养基重悬细胞并计数,取2×104个细胞加入600 μL 含30% FBS DMEM 培养液,即每组最后的细胞数相同。吸去上室内无血清DMEM培养基,将含有2×104个细胞的细胞悬液混匀,缓慢逐滴垂直加入小室中,置于细胞培养箱内培养,期间动态观察细胞穿膜情况。约48 h后取出小室,吸去下室内的培养基,每孔加800 μL 4%多聚甲醇固定30 min,于双蒸水清洗后置于空气中自然干燥, 结晶紫染液染色25 min,再于双蒸水中清洗3次, 并用棉球擦去表面细胞。在倒置相差显微镜 (100倍) 上取上下左右中5个视野拍片计数,计算5个视野的平均值作为穿膜细胞数。
1.4 各组Snail和c-myc的检测 采用Western blotting法。细胞加药处理24 h后,收集细胞采用 RIPA 裂解液提取蛋白,4 ℃裂解30 min,13 200 r/min离心25 min,得到上清液。然后用 BCA 试剂盒检测蛋白浓度。采用 10% SDS 聚丙烯酰胺凝胶电泳分离蛋白,并将蛋白转移到PVDF膜,将PVDF膜放于5%脱脂奶粉室温封闭 1 h ,随后添加一抗(c-myc 1∶1 000;Snail 1∶1 000)和小鼠单克隆anti-β-actin(1∶500) 4 ℃ 过夜孵育,然后将膜与辣根过氧化物酶标记的二抗在室温下孵育1 h, ECL 显色,以 β-actin为内参,采用Image J软件分析图像,计算目的蛋白的相对表达水平。实验重复3次。
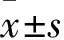
2 结果
2.1 两种细胞中各组细胞增殖率、迁移细胞数比较 HepG2细胞中,培养24 h时:观察组、A组、B组、C组、对照组细胞增殖率分别为0.14±0.01、0.11±0.01、0.13±0.02、0.16±0.01、0.10±0.01;培养48 h时分别为0.10±0.01、0.10±0.00、0.11±0.01、0.13±0.02、0.10±0.00。培养24 h时,与对照组比较,B、C组和观察组的细胞增殖率升高,且C组升高最显著(P均<0.05);与B组比较,观察组细胞增殖率降低(P>0.05)。培养48 h时,与对照组比较,B、C组细胞增殖率升高,且C组升高最显著(P均<0.05);分别与B、C组比较,观察组的细胞增殖率降低(P均<0.05)。Huh7细胞中,培养24 h时,观察组、A组、B组、C组、对照组细胞增殖率分别为0.14±0.00、0.11±0.01、0.15±0.02、0.19±0.04、0.10±0.00;培养48 h时,分别为0.09±0.01、0.11±0.01、0.11±0.00、0.12±0.02、0.10±0.01。培养24 h,与对照组比较,B、C组和观察组的细胞增殖率升高,C组升高最显著(P均<0.05);与C组比较,观察组细胞增殖率低(P<0.05)。培养48 h时,与对照组相比,C组的细胞增殖率升高(P<0.05);与B、C组比较,观察组的细胞增殖率降低(P<0.05)。
HepG2细胞中,观察组、A组、B组、C组及对照组迁移细胞数分别为(460±12)、(233±9)、(635±37)、(667±27)、(100±6)个/HP。与对照组比较,PGE2各刺激组的迁移细胞数均增多(P均<0.05);与B、C组比较,观察组的细胞迁移细胞数低(P均<0.05)。Huh7细胞中,观察组、A组、B组、C组及对照组迁移细胞数分别为(108±2)、(99±2)、(144±2)、(189±5)、(100±2)个/HP。与对照组比较,B、C组的迁移细胞数增多(P均<0.05);与B、C组比较,观察组的迁移细胞数减少(P均<0.05)。
2.2 两种细胞中各组c-myc、Snail蛋白表达比较 HepG2细胞中,观察组、A组、B组、C组、对照组细胞c-myc蛋白相对表达量分别为0.58±0.02、0.60±0.01、0.95±0.01、0.76±0.02、0.56±0.00,Snail蛋白相对表达量分别为0.34±0.01、0.47±0.00、0.63±0.01、0.78±0.02 、0.20±0.00。Huh7细胞中,观察组、A组、B组、C组、对照组细胞c-myc蛋白相对表达量分别为0.51±0.03、0.52±0.02、0.61±0.00、0.66±0.01、0.42±0.00,Snail蛋白相对表达量分别为0.48±0.01、0.56±0.01、0.59±0.01、0.70±0.02、0.42±0.01。
两种细胞中,与对照组比较,PGE2 组c-myc、Snail蛋白表达水平均升高(P均<0.05)。与 PGE2 组比较,观察组c-myc、Snail 蛋白表达水平下调(P均<0.05)。
3 讨论
目前,原发性肝癌的治疗方法较多,主要有手术治疗、局部消融、经肝动脉化疗栓塞术、放射治疗、药物治疗和免疫疗法等[10]。虽然单个治疗方法效果不太理想,多个治疗方案的联合应用可以有效延长患者的生存时间,然而,肝癌的治疗仍然是一个挑战,主要是因为大多数被诊断出肝癌的患者已处于晚期阶段,治疗方法上存在局限性,此外,治疗后患者的5年生存率仍然较低,仅为10%左右。因此有必要深入研究肝癌致病原因及发生发展过程中的分子机制,为肝癌的致病病因、治疗方法及预后等过程提供新的发现与思路。
COX-2和PGE2在许多癌组织中表达上调,参与肿瘤的迁移和进展[11,12]。PGE2 通过结合EP受体发挥多种生物学作用,目前,EP受体包括EP1、EP2、EP3和EP4四个亚型。G蛋白偶联受体(GPCR)超家族,与多种细胞内信号通路相关[13]。GPCRs是包含7个跨膜螺旋区的一个超家族,结合广泛的配体,包括Gα亚基和Gβγ-二聚体。Gα亚单位具有内源性GTPase,对Gβγ二聚体的功能知之甚少,两者都通过多种效应分子启动细胞内信号转导途径[14]。EP1受体与Gαq偶联,与蛋白激酶C(PKC)激活相关,而EP2受体与Gαs和蛋白激酶A(PKA)/腺苷酸环化酶(AC)相互作用,介导细胞内环腺苷酸单磷酸(cAMP)的升高。EP3受体有多个剪接变体,能够与不同的G蛋白偶联,从而促进EP3作用的广泛性。EP4R通过与Gαs和PKA相结合来增加细胞cAMP[15]。EP4R对肿瘤细胞的增殖、侵袭与转移具有重要的作用。在结肠癌中,活化的EP4R通过mTORC1信号通路促进肿瘤细胞的增殖和VEGF生成。EP4R还可通过形成EP4/β-arrestin/c-Src/EGFR信号复合物,激活下游PI3K/Akt信号转导通路而促进结肠癌细胞的迁移与转移。肿瘤中,EP4R也是被研究的最为广泛和深入的EP受体亚型。
我们前期研究发现,肝癌患者肿瘤组织中PGE2及其受体(尤其是EP4)的表达水平高于正常组织[14]。为进一步验证 EP4R在 PGE2 介导肝癌中的作用,我们采用 EP4R选择性拮抗剂 CJ-42794。结果显示,EP4R选择性拮抗剂CJ-42794 显著抑制了 PGE2 对肝癌细胞增殖和侵袭的影响,影响肝癌细胞的凋亡。提示,EP4R在 PGE2 介导肝癌中具有重要作用。
肝癌最重要的特征是快速复发和转移,这与EMT和Snail的上调有关[16,17]。PGE2作为COX-2的主要产物在前列腺癌小鼠模型中上调了Snail的表达,促进了EMT的表达[18];然而,在肝癌细胞中,PGE2对Snail的调节作用尚不明确。本研究我们采用Western blotting 法检测肝癌细胞中 Snail 的表达情况,试图探索 PGE2 是否可能通过 EP4R/Snail 通路调节肝癌的侵袭与转移,促进肝癌的发展。本研究结果显示,肝癌细胞中 Snail 的蛋白表达水平显著升高。此外,EP4R选择性拮抗剂对肝癌细胞的 Snail 表达具有一定影响,提示PGE2 通过EP4R/Snail通路介导肝癌的增殖、侵袭转移等,参与肝癌的发生与发展。
c-myc 是一种多功能的早期反应基因,具有广泛的生物学效应,调节细胞的增殖、分化和凋亡等过程。研究表明 c-myc 在多种恶性肿瘤中异常表达,影响肿瘤的增殖和转移,参与肿瘤的发生与进展。基于以上基础和课题组前期研究基础,本研究我们采用 Western blotting 法检测肝癌细胞 c-myc 。结果显示,c-myc 在肝癌细胞中的表达水平显著升高。此外,EP4R选择性拮抗剂对肝癌细胞的 c-myc 表达具有一定影响,提示 PGE2 可能通过 EP4R/c-myc 通路介导肝癌的发生与发展。因此,研究Snail和c-myc在肝癌中活化的分子机制至关重要。在本研究中,我们发现PGE2通过EP4R/Snail 或EP4R/c-myc通路加速了肿瘤的转移和侵袭。
综上所述,前列腺素E2受体拮抗剂CJ-42794可抑制肝癌细胞的增殖迁移,并抑制EP4R/c-myc和EP4R/Snail的表达,提示PGE2可能通过EP4R介导的c-myc和(或)Snail信号来影响肝癌细胞的生物学行为,从而参与调节肝癌的发生与发展,具体通过何种机制有待进一步研究证实。
