组蛋白甲基化转移酶2在糖尿病肾病小鼠肾组织中的表达变化及其意义
2020-12-31简久莹张妮余婷王笑笑伍聪聪徐卫卫郭兵刘丽荣
简久莹 张妮 余婷 王笑笑 伍聪聪 徐卫卫 郭兵 刘丽荣
1贵州医科大学附属医院临床检验中心(贵阳550004);2贵州医科大学医学检验学院临床血液学教研室(贵阳550004);3贵阳市第一人民医院输血科(贵阳550002);4贵州医科大学贵州省常见慢性疾病发病机制及药物研究重点实验室(贵阳550025)
糖尿病是一种临床上常见的糖代谢障碍性疾病。根据国际糖尿病联盟最新报道,中国糖尿病患病率为10.9%,糖尿病患者数量约为1.14亿,位居世界第一[1]。糖尿病肾病(diabetic nephropathy,DN)是其最严重的微血管并发症之一,最终发展至终末期肾衰竭[2]。上皮细胞-间充质细胞转化(epithelial-mesenchymal transformation,EMT)是导致DN肾脏纤维化发生的机制之一,其特点是上皮表面标志物的丢失,间充质标志物的获得和细胞骨架重塑[3-6]。众所周知,转化生长因子β1(transforming growth factor-β1,TGF-β1)是EMT发生的重要诱导因子[7-8],但其具体作用机制仍知之甚少。
研究发现[9-10],在TGF-β1诱导的肾小球系膜细胞中,细胞外基质的沉积与组蛋白H3第4位赖氨酸甲基化(H3K4me)水平增加有关,可见组蛋白甲基化是促纤维化的一个关键因素。组蛋白甲基化转移酶2(SET and MYND domain containing 2,SMYD2)是一种含有SET结构域的组蛋白甲基化转移酶。有研究[11]表明,SMYD2在正常肾组织中低表达,在肾癌组织中高表达,提示其参与肾癌的发生发展。SMYD2在肾囊肿组织中呈高表达状态,其通过甲基化核转录因子κB和信号转导与转录激活因子3使其磷酸化活化,促进囊性上皮细胞分泌多囊蛋白和炎性细胞因子,进而促进囊肿的生长[12-13]。由此可见SMYD2与肾脏疾病密切相关,但SMYD2在DN研究领域尚未见报道。因此,本研究构建了DM模型小鼠,探讨SMYD2在DM肾组织中的表达变化,为临床治疗DN提供新的思路。
1 材料与方法
1.1 药物与试剂蛋白提取试剂盒购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒购自碧云天生物有限公司;STZ(S0130)、α-SMA(A5228)和Vimentin(V5255)购自sigma公司;β-actin(bs-0061R)购自北京博奥森生物技术有限公司;SMYD2(D14H7)购自Cell signaling公司;E-cadherin(20874-1-Ap)购自Proteintech公司;TGF-β1(ab92486)购自abcam公司。
1.2 实验动物与分组24只无特定病原体(SPF)级健康雄性C57BL/6小鼠,体质量(20±2)g,6周龄,购买于斯贝福(北京)生物技术有限公司[许可证号:SCXK(京)2016-0002]。随机将24只小鼠分为正常对照(NC)组、DM12周组、DM24周组、DM28周组,每组6只。按55 mg/kg剂量腹腔注射链脲佐菌素复制DM小鼠模型,1次/d,连续注射5 d。48 h后尾静脉取血测随机血糖,血糖>16.7 mmol/L且尿糖阳性者判定为造模成功,NC组给予相同剂量STZ溶媒。各组小鼠给予标准饲料喂养,自由饮水,分别于造模后第12周、24周和28周处死DM各组小鼠,于第28周处死NC组小鼠。小鼠处死前6 h禁食不禁水,麻醉后眼球摘除法取血,3 500 r/min离心5 min分离血清,冻存于-80 ℃冰箱保存。将肾组织一分为二,1/2浸泡在含4%多聚甲醛,用于观察肾组织病理学改变;另1/2冻存于-80 ℃冰箱,用于相关蛋白的检测。
1.3 全自动生化分析仪检测生化指标全自动生化分析仪检测各组小鼠血糖(blood glucose,BG)、血肌酐(serum creatinine,Scr)和尿素氮(blood urea nitrogen,BUN)。
1.4 HE、Masson 染色观察肾脏病理学改变HE染色:将浸泡在含4%多聚甲醛的肾组织进行石蜡包埋,再用切片机制作厚度约为3 μm的石蜡切片,脱水透明后进行HE染色,光学显微镜下进行分析。Masson染色:采用Masson三色染色试剂盒对已制备好的石蜡切片进行染色,光学显微镜下进行分析。
1.5 Western blot 检测肾组织中SMYD2、E-cadherin、α-SMA、Vimentin 和TGF-β1 蛋白水平的变化蛋白上样工作液的制备:将0.02 g肾组织和200 μL蛋白裂解液置于玻璃匀浆器内,研磨后离心,吸出上清液;采用BCA蛋白浓度测定试剂盒测定上清液的蛋白浓度;将一定量蛋白原液和5×蛋白上样缓冲液按比例制备1×蛋白上样工作液。Western blot:制备SDS- PAGE凝胶,将制备好的上样工作液上样进行电泳、转膜和封闭。分别加入一抗:SMYD2(1∶500)、E-cadherin(1∶10 000)、α-SMA(1∶1 000)、Vimentin(1∶1 000)、TGF-β1(1∶1 000)和β-actin(1∶5 000),4 ℃摇床孵育过夜。取出PVDF膜,室温孵育二抗1 h,TBST洗膜3次,ECL化学发光显影。Image J 1.44软件计算各条带的灰度值,以β-actin为内参,以目的蛋白与β-actin的比值表示目的蛋白的相对表达量。
1.6 统计学方法所有数据均采用SPSS 25.0统计软件进行分析,数据以均数±标准差表示,组间比较采用方差分析,采用Spearman秩相关检验进行相关性分析。P <0.05为差异具有统计学意义。
2 实验结果
2.1 各组小鼠血糖水平生化检测结果显示:与NC组 相 比,DM12周 组、DM24周 组、DM28周 组BG、Scr和BUN水平均明显增高(P <0.05,表1)。
表1 各组小鼠BG、Scr 和BUN 的变化Tab.1 The results of BG,Scr and BUN in each group ±s
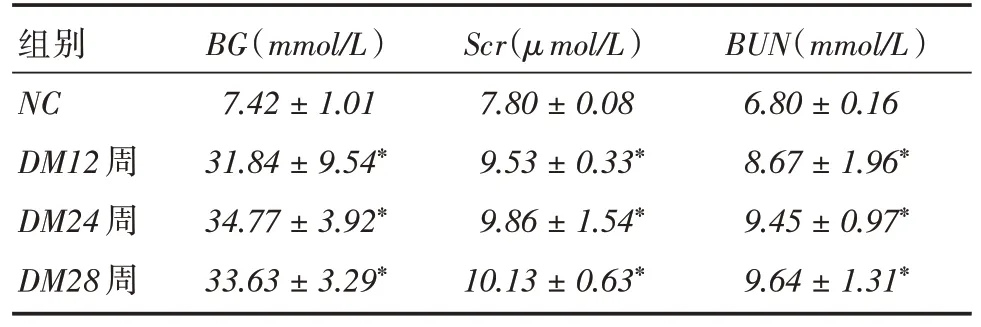
表1 各组小鼠BG、Scr 和BUN 的变化Tab.1 The results of BG,Scr and BUN in each group ±s
注:与NC 相比,*P <0.05
组别NC DM12 周DM24 周DM28 周BG(mmol/L)7.42±1.01 31.84±9.54*34.77±3.92*33.63±3.29*Scr(μmol/L)7.80±0.08 9.53±0.33*9.86±1.54*10.13±0.63*BUN(mmol/L)6.80±0.16 8.67±1.96*9.45±0.97*9.64±1.31*
2.2 各组小鼠肾组织病理学变化HE染色结果显示:NC组小鼠肾小球形态、结构完整,肾小管基底膜完整,上皮细胞排列整齐,未见炎性细胞浸润;DM12周组小鼠的肾组织病理学改变不明显;DM24周组小鼠少量肾小球出现系膜细胞增生,偶见肾小管空泡变性;DM28周组小鼠肾组织中部分肾小球出现系膜细胞增生,且有少量基底膜增厚,肾间质出现炎性细胞浸润,部分肾小管发生颗粒变性和空泡样变(图1)。Masson染色结果显示:NC组小鼠肾间质无纤维增生;DM12周组小鼠肾间质纤维增生不明显,DM24周组小鼠肾间质出现少量纤维增生,DM28周组小鼠纤维增生程度明显(图1)。
2.3 各组小鼠肾组织中E-cadherin、α-SMA、Vimentin 的蛋白水平变化与NC组相比,DM组小鼠E-cadherin蛋白在12周时表达下降不明显,在24周和28周时明显下降,α-SMA、Vimentin蛋白在一直维持在较高水平(P <0.05,图2)。
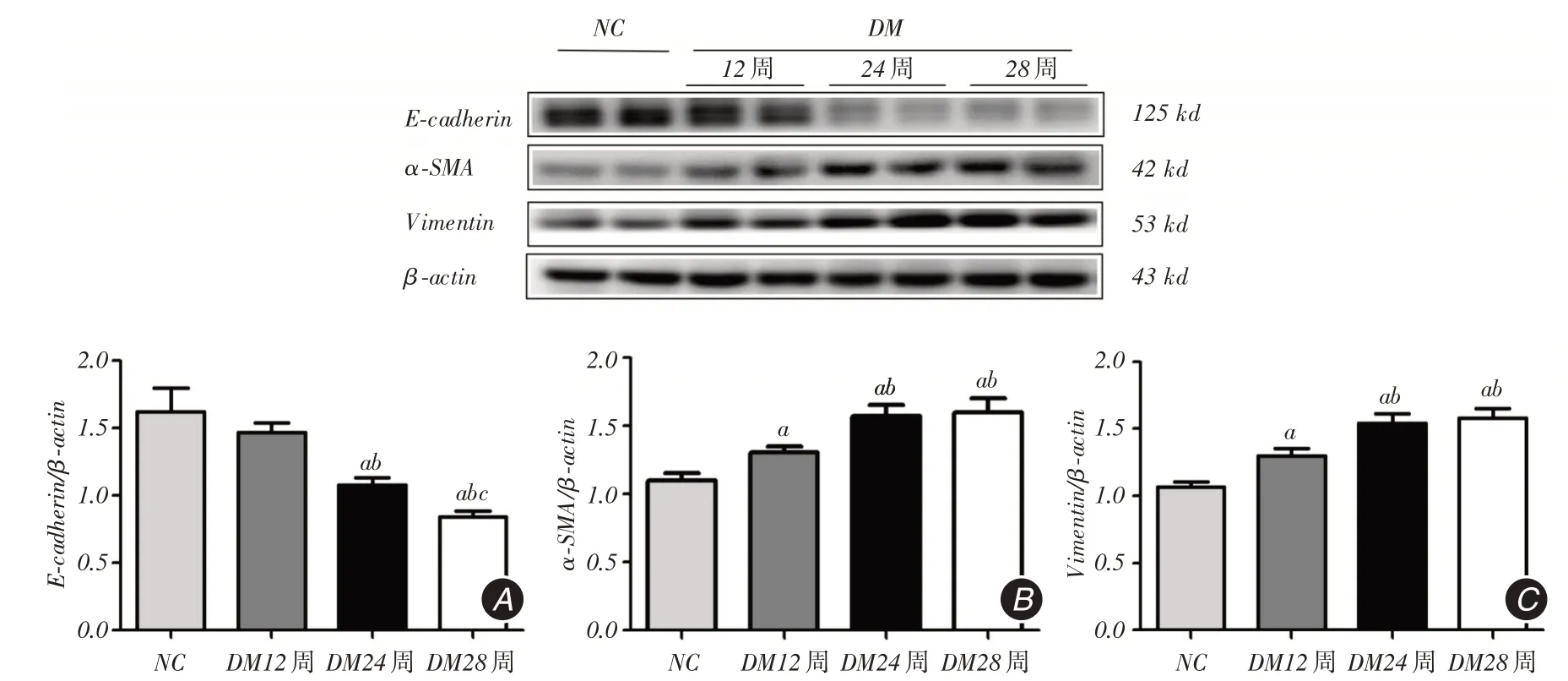
图2 Western blot 检测小鼠肾组织E-cadherin、α-SMA 和Vimentin 蛋白水平Fig.2 Detection of E-cadherin,α-SMA and Vimentin protein expression in renal tissue of mouse by Western blot
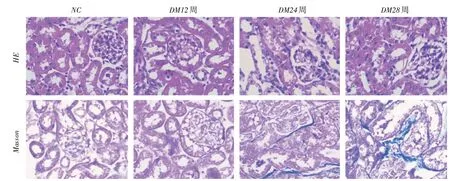
图1 HE 和Masson 染色示各组小鼠肾组织形态学变化(400×)Fig.1 Histological change of kidney tissue in each groups by HE and Masson staining(400×)
2.4 各组小鼠肾组织中SMYD2、TGF-β1 蛋白表达变化与NC组小鼠相比,DM组SMYD2蛋白表达逐渐增加(P <0.05);TGF-β1在NC组有少量表达,DM组从24周开始可见TGF-β1蛋白表达明显增加(P <0.05,图3)。
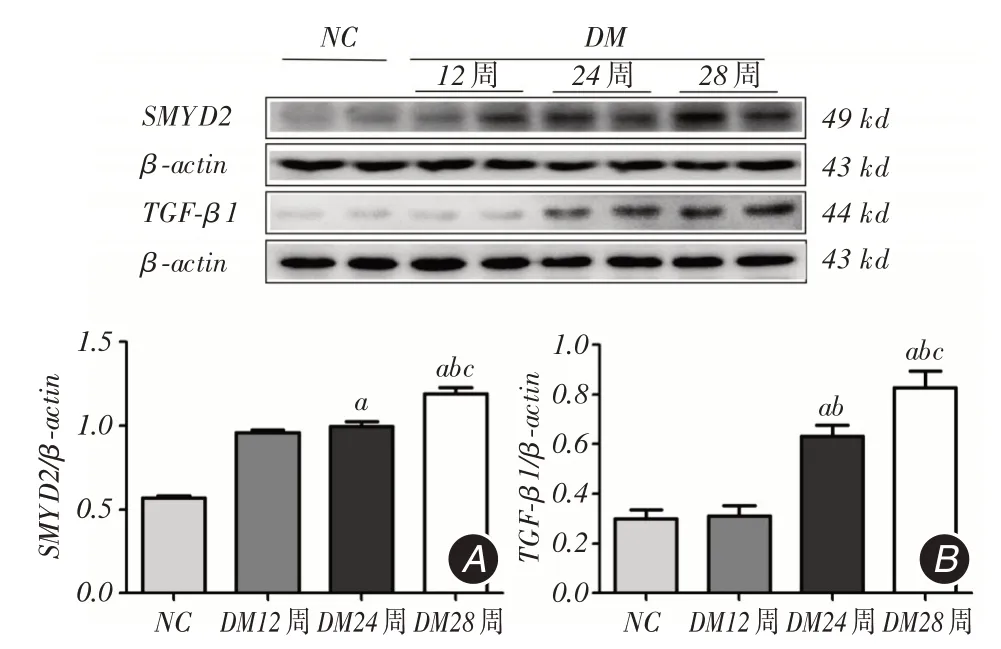
图3 Western blot 检测小鼠肾组织SMYD2、TGF-β1 蛋白水平Fig.3 Detection of SMYD2、TGF-β1 protein expression inrenal tissue of mouse by Western blot
2.5 相关性分析SMYD2与E-cadherin的蛋白表达量呈负相关(r =-0.846),与α-SMA、Vimentin和TGF-β1的蛋白表达量呈正相关(r = 0.601,P <0.05;r=0.608,P <0.05,r=0.769,P <0.05)。
3 讨论
有研究[14]表明肾小管上皮细胞EMT在DN肾脏纤维化中扮演了重要的角色,其特点是上皮表面标志物的丢失,间充质标志物的获得和细胞骨架重塑。除此之外,众多研究者发现应用多种药物或细胞因子抑制肾小管上皮细胞EMT能有效减轻DN肾脏纤维化[15-18]。这些研究背景表明了EMT在DN肾脏纤维化中占据重要地位。在本实验研究中,HE染色结果显示DM小鼠在24周和28周时肾脏病理学改变较为明显,Masson染色结果显示DM小鼠在24周和28周时肾间质有纤维沉积,并且上皮表面标志物E-cadherin蛋白表达明显下降,间充质标志物α-SMA、Vimentin蛋白表达明显增加,表明小鼠发生了EMT。TGF-β1主要通过激活Smad信号通路诱导EMT的发生[19-21],同时也可激活其它非Smad信号通路来发挥生物学效应。本研究发现,与NC组相比,DM小鼠肾组织TGF-β1蛋白水平表达明显增加。
越来越多的研究表明,组蛋白甲基化在肾脏疾病中发挥了重要的作用。LIU等[22]研究结果显示,在单侧输尿管梗阻(UUO)诱导肾脏纤维化小鼠模型和TGF-β1诱导的肾小管上皮细胞和成纤维细胞中,组蛋白甲基转移酶DOT1L表达增加,H3K79me2水平增加,给予高选择性的DOT1L抑制剂EPZ5676干预可以缓解小鼠肾脏纤维化、肾小管上皮细胞发生EMT和肌成纤维细胞活化。SASAKI等[23]研究显示,在UUO小鼠中,TGF-β1通过Smad3途径诱导组蛋白甲基转移酶SET7/9表达上调,应用siRNA SET7/9和其抑制剂sinefungin干预后能改善UUO小鼠的肾脏纤维化。ZHOU等[24]研究发现,组蛋白甲基转移酶Zeste homolog-2(EZH2)和H3K27me3在UUO小鼠肾组织和TGF-β1诱导的肾小管上皮细胞中高表达,用EZH2抑制剂3-deazaneplanocin A和siRNA EZH2干预后可以减轻小鼠肾脏纤维化和肾小管上皮细胞发生EMT。因此组蛋白甲基化在肾脏纤维化中占据重要地位。本研究发现SMYD2在链脲佐菌素诱导的DM小鼠肾组织中高表达,DM28周时蛋白水平增加尤为明显。相关性分析结果显示,SMYD2与E-cadherin呈明显负相关,与α-SMA和Vimentin呈明显正相关,以上结果足以说明SMYD2是DM小鼠肾脏发生EMT的关键分子,且SMYD2与TGF-β1的蛋白表达呈明显正相关,提示本模型中SMYD2高表达可能与TGF-β1有重要联系,但具体作用机制有待进一步研究。
综上所述,在链脲佐菌素诱导DM小鼠模型中,肾组织SMYD2表达上调,推测其可能和TGF-β1表达上调共同参与EMT的发生,进而参与调控DN的发生发展。然而在DN的发展过程中,SMYD2和TGF-β1之间到底有何联系以及其表达的上调还受哪些因素的影响有待进一步研究证实。
