Mus81基因沉默对Hep3B人肝癌细胞系增殖和凋亡的影响
2020-12-31张芳雍谭国钳曾裕文吴帆
张芳雍 谭国钳 曾裕文 吴帆
暨南大学医学院附属广州红十字会医院肝胆外科(广州510220)
Mus81(甲磺酸盐及紫外线敏感性81号基因)是近年来发现的一种DNA修复基因,在维持细胞基因组稳定性中发挥重要的生物学功能[1-2],因而曾被认为是一个肿瘤抑制基因[3]。然而最近的研究发现,Mus81的生物学功能具有多样性,也可发挥促进肿瘤发展的作用[4]。YIN等[5]研究就发现Mus81可通过调控上皮间质转化(EMT)促进胃癌细胞系的迁移。笔者前期研究也发现,Mus81沉默可逆转人肝癌和结肠癌细胞系的化疗耐药性[6-7],并可抑制人结肠癌细胞系HCT116的增殖、促进其凋亡[8],提示Mus81可能是一个潜在的肿瘤治疗靶点,但Mus81在人肝癌细胞系增殖凋亡中的作用尚未明确。为此,本研究以慢病毒介导的小干扰RNA(siRNA)沉默人肝癌细胞系Hep3B中Mus81基因的表达,观察Mus81对肝癌细胞增殖凋亡的影响。
1 材料与方法
1.1 材料Hep3B肝癌细胞系、siRNA慢病毒载体GV248、293T细胞、包装质粒pGC-LV、pHelper1.0和pHelper2.0均购自上海吉凯基因化学技术有限公司;实时定量聚合酶链反应(Real-time PCR)试剂盒购自日本TaKaRa公司(TP800);MTT试剂购自北京鼎国生物技术有限责任公司;Giemsa染液购自美国chemicon公司;凋亡试剂盒购自美国Ebioscience公司;碘化丙锭(PI)染色试剂盒购自德国Sigma公司。
1.2 慢病毒介导的siRNA设计针对Mus81基因的短发卡RNA(shRNA)序列如下(由上海吉凯基因化学技术有限公司合成):正义链:5′-CCGGGAGTTGGTACTGGATCACATTCTCGAGAATGTGAT -CCAGTACCAACTCTTTTTG-3′;反义链:5′-AATTCAAAAAGAGTTGGTACTGGATCACATTCTCGAGAATGTGATCCAGTACCAACTC-3′;阴性对照序列为:正义链:5′-CCGGTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTG-3′;反义链:5′-AATTCAAAAATTCTCCGAACGTGTCACGTAAGTTCTCTACGTGACACGTTCGGAGAA-3′。将上述shRNA序列形成的DNA双链与siRNA慢病毒质粒GV248连接,再利用Lipofectamine 2000将上述质粒分别与pGC-LV、pHelper1.0和pHelper 2.0慢病毒包装载体共转染至293T细胞,生成Mus81-siRNA和及阴性对照慢病毒。将感染上述2种慢病毒的肝癌Hep3B细胞系分别命名为Mus81-siRNA组(实验组)和siRNA-NC组细胞(阴性对照组)。感染3 d后采用荧光倒置显微镜(micropublisher 3.3RTV,日本奥林帕斯公司)观察两组细胞的慢病毒感染效率。
1.3 qRT-PCR 检测Mus81 基因干扰效率根据Invitrogen公司的Trizol操作说明书提取Mus81-siRNA组和siRNA-NC组细胞的总RNA,在荧光定量PCR仪行PCR检测,反应条件为:95 ℃预变性15 s,然后95 ℃变性5 s,60 ℃退火延伸30 s,共进行45个循环。Mus81基因引物:上游引物:5′-CTACAGCACTTCGGAGACG-3′;下游引物:5′-GGTAGAGCACCAGCAGTATCA-3′。内参管家基因甘油醛-3-磷酸脱氢酶(GAPDH)引物:上游引物:5′-TGACTTCAACAGCGACACCCA-3′;下游引物:5′-CACCCTGTTGCTGTAGCCAAA-3′。采用2-ΔΔCT法分析Mus81基因表达水平。
1.4 MTT检测将处于对数生长期的Mus81-siRNA组和siRNA-NC组细胞经胰酶消化后重悬成细胞悬液,以2 000个细胞/孔接种于96孔板,每组设5个复孔。铺板后置37 ℃5%CO2培养箱培养,于第2天开始每孔加入10 μL的MTT(5 mg/mL),无需换液。于检测前4 h,吸弃培养液,每孔加入100 μL二甲基亚砜(DMSO)终止反应,酶标仪490 nm检测吸光度(OD)值,绘制两组Hep3B细胞系的生长曲线。
1.5 细胞克隆形成检测两组细胞以800个细胞/孔接种于6孔板培养板中,每个实验组设3个复孔,将接种细胞培养到14 d,中途每隔3 d进行换液。实验终止时磷酸盐缓冲液(PBS)洗涤细胞1次后每孔加入1 mL多聚甲醛,固定细胞30 ~60 min,PBS再次洗涤后加入GIEMS染液500 μL,染色20 min。ddH2O洗细胞至洗净板上背景,克隆计数。
1.6 细胞凋亡检测取两组细胞于5 mL离心管中,每组设三个复孔,以1×binding buffer洗涤细胞,1 500 r/min离心5 min后收集细胞。以1 × staining buffer重悬细胞后取细胞悬液100 μL(1 × 105细胞),加入5 μL annexin V-APC染色,室温避光10 ~15 min,转移至流式上机管中行流式细胞检测。
1.7 细胞周期检测收集两组细胞于5 mL离心管中,每组设三个复孔,4 ℃预冷的PBS洗涤细胞沉淀1次,1 500 r/min离心5 min,收集细胞于4 ℃预冷的70%乙醇固定细胞2 h。以1 500 r/min离心5 min去固定液,PBS洗涤细胞沉淀一次,加入PI染色液重悬细胞沉淀,上机行流式细胞检测。
1.8 统计学方法应用SPSS 13.0统计软件进行分析,计量资料以均数±标准差表示,采用Student′s t检验。生长曲线采用重复测量资料的方差分析。所有分析均为双侧检验,P <0.05为差异具有统计学意义。
2 结果
2.1 Mus81 干扰效率荧光显微镜下观察Mus81-siRNA和siRNA-NC两组细胞慢病毒感染效率均高于80%。qRT-PCR检测Mus81沉默后Hep3B细胞发现Mus81-siRNA组Mus81基因的表达水平仅为siRNA-NC组的23.58%[(0.236 ± 0.008)vs.(1.001± 0.059),t = 14.977,P <0.001],即Mus81基因干扰效率为76.42%,见图1。
2.2 Mus81 沉默对Hep3B 细胞生长的影响MTT法绘制出的生长曲线提示Mus81-siRNA组的生长速度明显低于siRNA-NC组(F=2 056.758,P <0.001),见图2。
2.3 Mus81 沉默对Hep3B细胞增殖能力的影响平板克隆形成实验显示,Mus81-siRNA组Hep3B细胞形成的克隆数量明显少于siRNA-NC组[(2±1)vs.(54±3),t=29.133,P <0.001],见图3。
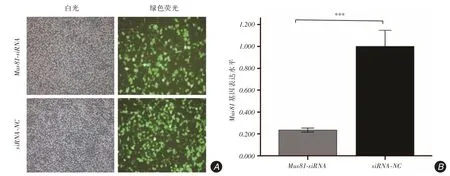
图1 慢病毒感染Hep3B 细胞的感染效率及干扰效率Fig.1 Infection efficiency and interference efficiency of lentivirus infected Hep3B cells
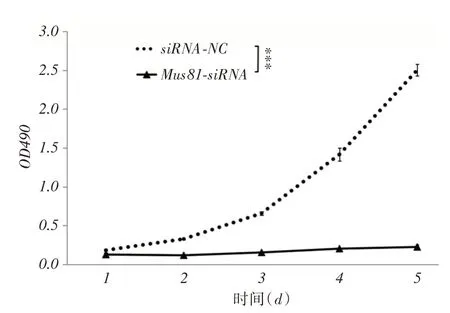
图2 MTT 检测结果Fig.2 Results of MTT test
2.4 Mus81 沉默对Hep3B 细胞凋亡的影响流式细胞仪检测结果显示,Mus81-siRNA组Hep3B细胞的凋亡率是siRNA-NC组细胞的30.25倍[(20.87 ±0.82)%vs.(0.69±0.09)%,t=-42.543,P <0.001],见图4。
2.5 Mus81沉默对Hep3B细胞周期的影响Mus81-siRNA组细胞的G1、S和G2/M期细胞比例分别为(33.77±1.61)%、(36.96±3.09)%和(29.27±2.64)%,siRNA-NC组分别为(42.06±0.40)%、(33.84±0.88)%和(24.10 ± 0.50)%。Mus81-siRNA组G1期细胞比例低于siRNA-NC组(t = 8.657,P <0.05),而两组间S和G2/M期细胞比例差异无统计学意义(P >0.05],见图5。
3 讨论
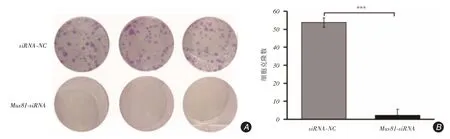
图3 平板克隆形成实验结果Fig.3 Results of plate clone formation experiment
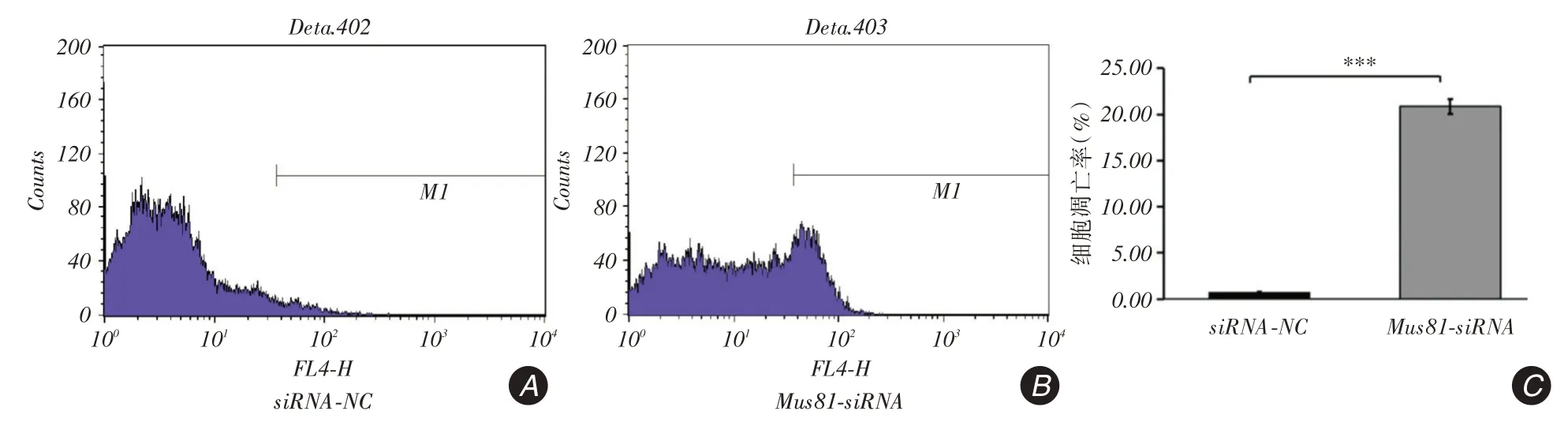
图4 Annexin V-APC 染色法检测结果Fig.4 Results of Annexin V-APC staining method

图5 细胞周期分布结果Fig.5 Results of cell cycle distribution
肝癌是目前全球最常见的恶性肿瘤之一,高居我国恶性肿瘤病死率的第二位[9]。尽管肝癌的手术治疗及靶向药物等取得了很大的进步,但其长期存活率仍不能令人满意[11-12]。而筛选潜在的肝癌治疗靶点可能是提高肝癌治疗疗效、改善患者预后的关键[13-14]。许多研究表明,DNA修复基因与肝癌的易感性和预后密切相关[15],而靶向抑制这些DNA修复基因可作为肝癌的潜在治疗策略[16-17]。Mus81是定位于人11号染色体长臂的DNA修复基因,属于核酸内切酶超家族,在同源重组修复和非同源末端链接过程中发挥极其重要的作用。MCPHERSON等[3]发现Mus81基因敲除的小鼠中可自发淋巴瘤、乳腺癌和卵巢癌等多种恶性肿瘤,据此曾认为Mus81是一个肿瘤抑制基因。但YIN等[5]新近的研究结果显示Mus81可通过调控上皮间质转化(EMT)而促进胃癌细胞的迁移。而吴云路等[18]的研究则发现Mus81过表达可抑制SKBR3乳腺癌细胞系的增殖能力并降低该细胞系的侵袭迁移能力。笔者前期的研究也发现Mus81基因沉默后可抑制人结肠癌细胞系HCT116的生长并促进其凋亡[8],且敲减Mus81基因可逆转人肝癌和结肠癌细胞系的化疗耐药性[6-7],提示其是一个潜在的肿瘤治疗靶点。上述研究提示Mus81在恶性肿瘤中的作用存在多样性和差异性,在部分肿瘤中发挥着促癌作用,但其在肝癌增殖凋亡中的作用尚未明确[19],还有待于进一步研究。
本研究首先采用慢病毒介导的siRNA构建沉默Mus81的Hep3B人肝癌细胞系,荧光显微镜观察结果显示Mus81敲减慢病毒的细胞感染效率高于80%,qRT-PCR检测结果显示Mus81基因干扰效率高达76.42%,提示该慢病毒感染和敲减Mus81的效果均很理想,Mus81基因敲减的Hep3B肝癌细胞系已构建成功。为进一步研究Mus81沉默对Hep3B肝癌细胞生物学功能的影响,采用MTT法对Hep3B细胞的生长情况进行检测,结果显示Mus81-siRNA组的生长速度明显低于siRNA-NC组,且Mus81-siRNA组细胞的增殖倍数在每个检测时间点上均低于siRNA-NC组,提示Mus81基因沉默抑制了Hep3B肝癌细胞系的增殖,这与笔者前期研究在HCT116结肠癌细胞系中得到的结果相一致[8],提示Mus81确实可促进肿瘤细胞的生长。但最近YIN等[5]的研究则发现Mus81沉默对SGC7901和BGC823胃癌细胞系的生长没有明显的影响,提示Mus81沉默对不同的恶性肿瘤细胞的生长具有不同的影响,推测这可能与Mus81在不同恶性肿瘤中的功能存在差异性有关,就如同目前的研究发现Mus81可促进胃癌细胞的迁移却抑制乳腺癌细胞的侵袭迁移一样[5,18],但这尚待进一步研究。
为探索Mus81沉默抑制Hep3B肝癌细胞生长的机制,采用平板克隆形成实验检测Mus81敲减对Hep3B细胞增值能力和凋亡水平的影响,结果显示Mus81-siRNA组细胞形成的克隆数明显少于siRNA-NC组,仅为后者的3.70%,提示Mus81沉默可明显抑制Hep3B肝癌细胞系的增殖能力,这可能也是Mus81沉默导致Hep3B肝癌细胞生长速度下降的原因之一。鉴于细胞周期的阻滞也可导致细胞生长速度的降低,采用流式细胞仪检测了两组Hep3B细胞的细胞周期分布,结果显示Mus81-siRNA组Hep3B细胞中G1期细胞比例低于siRNANC组,而S和G2/M期细胞比例则无明显差异,提示Mus81沉默可引起Hep3B肝癌细胞系G2/M期阻滞,这与既往研究中发现Mus81沉默可引起HCTll6结肠癌细胞系轻微G2/M期阻滞的结果一致[8],不仅进一步证明Mus81的确参与了G2/M期的调控,也提示Mus81沉默导致的G2/M期阻滞可能是其抑制Hep3B细胞生长的原因之一。但考虑到Mus81沉默导致的G2/M期阻滞的程度并不足以解释其对Hep3B细胞生长增殖能力的抑制,我们也分析了Mus81沉默对Hep3B细胞凋亡的影响,结果发现Mus81-siRNA组的细胞凋亡率明显高于siRNANC组,是后者的30.25倍,这与既往研究中HepG2、SMMC-7721肝癌细胞系和HCTll6结肠癌细胞系的结果一致[8,19],显示促进细胞凋亡可能是Mus81沉默抑制Hep3B肝癌细胞生长的重要原因。既往研究通过实时定量PCR检测Mus81敲减组HCT116结肠癌细胞系中凋亡相关基因的表达,发现Mus81可能通过调控Bax、Bcl-2和p53等凋亡相关基因的表达而促进结肠癌细胞凋亡[8]。STC2基因可在Mus81介导下调控肝癌细胞的增殖和凋亡[19]。Mus81是否通过上述信号通路或其他信号通路实现其对Hep3B肝癌细胞系增殖凋亡的调控目前尚不清楚,仍有待进一步的研究。
综上所述,本研究发现Mus81基因沉默可明显抑制Hep3B肝癌细胞系的生长增殖并促进其G2/M期阻滞及凋亡,提示Mus81是一个潜在的肝癌治疗靶点。
