黑色素瘤靶向及免疫治疗新进展*
2020-12-30陈欣琪综述康晓静审校
陈欣琪 综述,康晓静 审校
830054 乌鲁木齐,新疆医科大学 研究生学院(陈欣琪);830001 乌鲁木齐,新疆维吾尔自治区人民医院 皮肤性病科(康晓静);830001 乌鲁木齐,新疆皮肤病研究重点实验室(XJYS1707)(康晓静)
黑色素瘤(malignant melanoma,MM)是起源于神经嵴的黑素细胞恶性肿瘤,其起病隐匿、发展迅速、转移性强、预后差,伴有全身转移的患者生存率不超过1年[1]。传统的治疗方法有手术、化疗和放疗,对于远处转移者,放化疗均不敏感。无法切除的Ⅲ期、Ⅳ期肿瘤患者的预后较差。在过去几年中,靶向治疗和免疫治疗在延长患者生存期及改善患者生存质量方面取得了显著进展。
靶向治疗包括BRAF抑制剂或BRAF抑制剂联合丝裂原活化胞外信号调控激酶(mitogen-activated extracellular signal regulated kinase,MEK)抑制剂等。免疫治疗包括免疫检查点抑制剂、细胞免疫疗法、溶瘤免疫疗法或免疫治疗之间相互联合应用等。本文拟对上述黑素瘤的靶向及免疫治疗进行综述。
1 靶向治疗
研究发现,超过90%的黑素瘤致癌基因突变发生在丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中。MAPK通路包括3条信号途径:胞外信号调节激酶(extracellular signal-regulated kinase,ERK)途径、c-Jun N端激酶途径和P38途径,其中ERK途径(RAS-RAF-MEK-ERK信号级联通路)为MAPK通路中最主要的一条途径。BRAF属于RAF家族成员之一,通常由RAS家族激酶激活,引起下游分子MEK和ERK激酶的活化[2]。MEK(包括同系物MEK1和MEK2)作为BRAF的次级蛋白激酶,可通过磷酸化激活MAPK/ERK通路,继而通过信号转导促使正常细胞转化为肿瘤细胞。因此,BRAF抑制剂和MEK抑制剂都可通过降低相关蛋白激酶活性达到抗肿瘤的目的。
1.1 BRAF抑制剂:维罗非尼(vemurafenib)
2011年8月美国食品及药物管理局(Food and Drug Administration,FDA)批准维罗非尼用于治疗Ⅲc/Ⅳ期BRAF V600突变MM患者。在欧美白种人中BRAF V600E突变的MM患者约占50%,维罗非尼可改善最常见的BRAF V600E突变患者和少见BRAF V600K突变患者的生存率。McArthur等[3]设计了一项关于BRAF V600E和BRAF V600K突变黑素瘤中的安全性和有效性的Ⅲ期、随机、非盲的延长随访研究。来自12个国家104个中心的675名符合条件的患者入选,337名患者接受维罗非尼治疗,338名患者接受达卡巴嗪治疗。维罗非尼、达卡巴嗪组的中位随访时间分别为12.5和9.5个月。维罗非尼组的中位总生存期(overall survival,OS)和中位无进展生存期(progression free survival,PFS)均显著长于达卡巴嗪组(OS:13.6个月vs9.7个月;P<0.001),(PFS:6.9个月vs1.6个月;P<0.001)。该研究表明,维罗非尼较达卡巴嗪更能延长患者PFS和OS。对于其中598例(91%)BRAF V600E和57例(9%)BRAF V600K突变的患者,维罗非尼组的中位OS和中位PFS仍高于达卡巴嗪组。表明BRAF抑制剂维罗非尼可提高患有最常见BRAF V600E突变的患者和较少见的BRAF V600K突变患者的生存率。
尽管BRAF突变患者对维罗非尼敏感,治疗的前3年中,80%的患者产生耐药[4]。其次,与治疗相关的不良事件频繁发生,导致约一半患者的剂量中断或改变,约15%的患者中止治疗[5],临床获益短暂。也有研究者发现激活MEK1外显子3与BRAF V600E/K同时突变不会导致MM对BRAF抑制剂产生耐药性(表1)[6]。Feddersen等[7]发现BRAF抑制剂耐药性与DBL/RAC1/PAK信号转导轴有关。saracatinib可以阻断DBL轴驱动的耐药性,这可能使基因筛查在鉴定新药组合以对抗获得性BRAF抑制剂耐药性方面产生指导作用。Menzies等[8]发现耐药细胞的PD-L1表达升高,可能诱导MM细胞更具侵袭性。表明免疫检查点抑制剂与BRAF或MEK抑制剂联合使用可能是一种有效的方法。伊匹单抗(ipilimumab)联合vemurafenib的I期试验由于严重的肝毒性已经结束,但其他一些靶向治疗、检查点抑制剂和细胞因子联合治疗的试验仍在进行[9]。
1.2 靶向治疗的联合应用:BRAF抑制剂联合MEK抑制剂
1.2.1达拉非尼(dabrafenib)(BRAF抑制剂)联合曲美替尼(trametinib)(MEK抑制剂) 2013年5月FDA批准达拉非尼用于单药治疗不能手术切除或转移的恶性MM伴BRAF V600E突变患者,同时也是首个被批准用于MM脑转移治疗的药物。同年FDA批准了首个用于治疗MM的MEK抑制剂曲美替尼。2014年1月FDA批准达拉非尼与曲美替尼联用治疗不可手术切除的和伴有远处转移的恶性MM患者。选择性BRAF抑制剂在50%的转移性BRAF V600E突变型MM患者中产生反应,添加MEK抑制剂可将该反应率提高到70%[10]。Long等[4]设计的双盲、安慰剂对照的Ⅲ期临床试验,用来评估联合治疗对患者生存期的影响。研究者随机选取了870名完全切除的Ⅲ期BRAF V600E或V600K突变的MM患者,438例接受口服达拉非尼150 mg每日两次联合曲美替尼2 mg每日一次的联合治疗,432名患者接受相匹配的安慰剂治疗。在2.8年的中位随访中,联合治疗组3年无进展生存率约为58%,安慰剂组为39%;联合治疗组3年总生存率为86%,安慰剂组为77%,与安慰剂组相比,联合治疗组的无进展生存率和未复发率也更高。研究表明联合应用BRAF抑制剂达拉非尼和MEK抑制剂曲美替尼可提高BRAF V600突变的Ⅲ期MM患者的生存率。当前正在进行的KEYNOTE-022研究,初步证据表明,pembrolizumab联合达拉非尼和曲美替尼的组合(也称为“三联疗法”)对BRAF突变型MM具有抗肿瘤活性,因为三联疗法治疗组患者的PFS和反应持续时间更长,但三联疗法的毒性似乎也比单独使用BRAF/MEK抑制剂联合疗法或单独的免疫疗法明显更高。尽管可能有多个试验正在进行,但现有数据不足以推荐三联疗法[11]。因此三联疗法有待临床学者进一步研究。
1.2.2Encorafenib(BRAF抑制剂)联合Binimetinib(MEK抑制剂) Dummer等[12]设计了一项多中心、非盲、随机、Ⅲ期试验。该试验(COLUMBUS)对比encorafenib联合binimetinib与维罗非尼单药或encorafenib单药对于BRAF突变的不可手术或远处转移的MM患者的OS的影响。COLUMBUS分为两部分,第1部分为2013年12月30日至2015年4月10日之间,随机抽取1 345名患者中的577名接受encorafenib联合binimetinib(n=192),encorafenib单药(n=194)或维罗非尼单药治疗(n=191)。总的中位随访时间为36.8个月,encorafenib联合binimetinib的中位OS为33.6个月,维罗非尼为16.9个月。encorafenib加binimetinib组合疗效具有临床意义,且耐受性良好,与维罗非尼单药相比,PFS和OS均有延长,与其他抗BRAF/MEK靶向疗法相比,具有明显的安全性[13]。研究表明,encorafenib加binimetinib的组合可能成为BRAF突变型MM患者治疗的重要选择[14]。COLUMBUS研究的第2部分是应美国食品和药物管理局要求,将每天一次encorafenib 300 mg联合每天两次45 mg binimetinib与每天一次encorafenib 300 mg进行比较,以更好地了解binimetinib对联合治疗的贡献。第2部分试验正在进行中(NCT01909453),(2017年9月的最新报道)与encorafenib单药治疗相比,联合治疗方案PFS显着改善(12.9个月vs9.2个月)[15]。
Consoli等[16]将3种不可手术或伴有远处转移的MM一线治疗的临床试验进行了比较,3项3期试验:维罗非尼和考比替尼(cobimetinib),达拉非尼和曲美替尼,Columbus研究(encorafenib和binimetinib)共纳入1 230名患者。在所有研究中,对照组均为维罗非尼。分析表明3项试验OS,PFS和客观缓解率在统计学上均无差异,而3对药物疗效相似且安全性略有不同。研究表明与单用BRAF抑制剂相比,BRAF抑制剂和MEK抑制剂联合使用方案更有助于改善BRAF V600突变型MM患者的预后,其具有更大的抗肿瘤活性。联合治疗或许更能提高MM患者的临床治疗效果(表1)。

Table 1. Advantages and Disadvantages of Targeted Therapies
2 免疫治疗
2.1 免疫检查点抑制剂
细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)和程序性死亡受体1(programmed cell death protein-1, PD-1)是T细胞表面共表达的抑制受体,与程序性死亡配体1/2(programmed death protein-ligand 1/2, PD-L1/2)结合后抑制T细胞功能,产生肿瘤逃逸,阻断上述结合可促进抗肿瘤免疫反应。因此,免疫检查点抑制剂为黑素瘤免疫治疗提供了新的方向。
2.1.1Ipilimumab 2011年3月25日,FDA批准了首个免疫检查点抑制剂ipilimumab(Yervoy)用于治疗之前接受过治疗的无法切除的III期和IV期MM。Ipilimumab是一种抗CTLA-4单克隆抗体,CTLA-4是一种在T细胞膜表面表达的抑制性受体,而T细胞的激活依赖于抗原-抗体复合物形成和B7介导的双活化信号。而CTLA-4与B7结合将产生抑制性信号而抑制T细胞活化。Ipilimumab能阻断CTLA-4与B7结合,使免疫抑制去除,从而调动特异性抗肿瘤免疫反应[17]。10年前,转移性MM被认为是致命的,预后通常是6个月或更少。靶向药物的开发,如ipilimumab和nivolumab,已经彻底改变了MM患者的预后。单一治疗提高了转移性疾病的存活率,但联合治疗提供了更大的优势,58%的患者在3年后仍然存活[18]。Theurich等[19]将82名患者接受ipilimumab治疗,45名患者接受ipilimumab联合放疗对比疗效。结果ipilimumab联合放疗显著延长了OS(中位OS:93周vs42周,P<0.05),而联合治疗不会增加不良反应。在调整BRAF状态,肿瘤分期和中枢神经系统转移等因素后,联合放疗后对OS的影响仍然具有统计学意义(调整后的P=0.05)。该研究表明,无论临床疾病特征和已知的危险因素如何,向患有转移性黑素瘤的患者中联合放疗对ipilimumab是安全有效的。英国国家健康和护理卓越研究所委员会建议ipilimumab作为先前未治疗的伴有转移的MM患者的一种治疗选择[20]。然而目前MM的治疗缺乏预后的生物标志物。最新研究显示,内皮抑素和Gal3BP可能是ipilimumab治疗转移性MM患者预后的生物标志物[21]。
2.1.2PD-1/PD-L1抑制剂 Pembrolizumab是人源抗PD-1单克隆抗体,可选择性地与T细胞表面的PD-1受体结合,阻止PD-1与PD-L1结合,促进T细胞活化,增强机体免疫应答,诱导肿瘤细胞死亡。nivolumab是人源IgG4单克隆抗体,可与PD-1受体结合,阻断PD-1与PD-L1和PD-L2的相互作用,使T细胞活性增强,促进抗肿瘤反应。有随机试验显示,对于未经治疗的转移性MM患者或ipilimumab作为一线和二线治疗相比,nivolumab和pembrolizumab单药治疗在反应率、PFS和OS方面优于化疗,且相比之下毒性更少。2年的存活率在50%左右,两种PD-1抑制剂的反应率均为37%~44%[22]。随着ipilimumab,nivolumab,pembrolizumab和数种其他检查点抑制剂的成功推出,惊人的持久反应和治疗效果已将免疫检查点抑制剂确立为可用于转移性MM的最有希望的治疗方法[8]。
2.1.3免疫检查点抑制剂的联合应用 2014年9月,FDA首次批准由Merck Sharp & Dohme Corp生产的PD-1/PD-L1阻断剂pembrolizumab(Keytruda)联合CTLA-4抑制剂ipilimumab(Yervoy)治疗MM患者。PD-1/PD-L1抑制剂的根本目的在于阻断PD-1/PD-L1信号通路在肿瘤细胞和CD8+T细胞间的相互作用。通过抗体使T细胞解除PD-1的抑制信号并触发自身免疫消除肿瘤细胞。抑制PD-L1的表达以及PD-1/PD-L1通路可以有效抑制肿瘤的生长。CTLA-4与PD-1/PD-L1通路阻断剂的联合使用可以激活淋巴结和周围组织的免疫细胞活性,逆转T细胞衰竭[23]。但抗PD-1/PD-L1单药治疗与CTLA-4联合PD-1阻断剂的长期疗效比较仍有待进一步研究(表2)[24]。
目前MM全身免疫治疗的一线用药包括ipilimumab和nivolumab联合或nivolumab、pembrolizumab单用。PD-1抑制剂联合抗血管生成靶向药(贝伐珠单抗、阿西替尼、乐伐替尼、卡博替尼等)已有不错的初步数据。PD-1抑制剂联合溶瘤免疫疗法(talimogene laherparepvec,T-VEC),在IIIB~IV期MM患者中,总体反应率为90%,非常有前景[25]。PD-1抑制剂联合黑素瘤疫苗已有初步的成功经验,可以预防肿瘤复发。这些治疗方法都为MM患者提供了新的治疗策略。
2.2 细胞免疫疗法
在各种免疫治疗方法中,自体细胞因子诱导杀伤细胞(cytokine-induced killer,CIK)已成为细胞免疫治疗的一种有前景的方法,是目前抗肿瘤过继细胞免疫治疗的首选方案。CIK是将人外周血单个核细胞在体外用多种细胞因子(如IFN-γ、CD3单克隆抗体和IL- 2等)共同培养一段时间后获得的一群异质细胞。由于该种细胞同时表达CD3+和CD56+两种膜蛋白分子,故又被称为自然杀伤细胞(nature killer,NK)样T淋巴细胞,兼具有T淋巴细胞强大的抗肿瘤活性和NK的主要组织相容性复合体不受限制的抗肿瘤活性[26-29]。
目前已有研究证明CIK免疫治疗延长了大肠癌[30]、肝癌[31]、乳腺癌[32]患者的生存期,改善了患者预后。Li等[33]回顾性分析和评估CIK细胞治疗后不同阶段的MM患者的免疫状况和临床获益情况。其中55名患者接受了常规疗法(包括手术、化疗、放疗、生物疗法)联合CIK细胞治疗。49名患者仅接受常规治疗,作为对照组。经过长达40个月的随访,与对照组的49名患者相比,CIK组的55名MM患者中,输注CIK细胞可显著延长Ⅰ、Ⅱ期MM患者的OS。但在Ⅲ、Ⅳ期MM患者中无明显差异。CIK细胞治疗可能有助于预防MM复发和早期转移。该研究表明,至少在OS方面,Ⅰ、Ⅱ期MM患者可受益于辅助性CIK细胞治疗。Zhang等[34]设计了一项回顾性研究,以评估自体CIK细胞免疫疗法治疗未行化疗和放疗的IV期MM患者的临床效果。其中68例仅接受CIK细胞免疫治疗,45例接受CIK细胞免疫治疗联合达卡巴嗪和顺铂化疗。研究发现CIK细胞组中位生存时间较联合治疗组长(21个月vs15个月,P=0.07)。研究表明,CIK细胞免疫治疗可能延长IV期MM患者的生存时间。血清血红蛋白水平,单核细胞比例和淋巴细胞计数可能作为判断MM预后的指标。相比之下CIK细胞免疫治疗联合化疗并不一定能给患者带来更多的临床获益。总之,无论对于MM还是其他肿瘤,CIK细胞免疫治疗是治疗恶性肿瘤的一种有前景且安全的治疗方法,值得进一步研究。
2.3 T-VEC
溶瘤病毒通过选择性感染和裂解肿瘤细胞以增强抗肿瘤免疫反应。T-VEC是一种单纯疱疹病毒1型(herpes simplex virus type 1,HSV1)溶瘤免疫疗法,它可以在肿瘤细胞内复制并表达免疫激活蛋白粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)。将其直接注射到MM病灶中可造成肿瘤细胞的裂解,并释放出肿瘤源性抗原和GM-CSF,加速抗肿瘤的免疫应答[35]。T-VEC是2015年10月由FDA批准的第1个并且是目前唯一用于治疗不能手术的III期和IV期MM的溶瘤病毒,是第1种在MM患者中产生临床优势的溶瘤病毒。为了防止毒性,HSV1已被基因修饰[36]。
T-VEC具有副作用小,安全性好,局部给药方便的优势。其作用模式有两种:既可以通过细胞溶解诱导局部效应又可以通过增强抗原呈递和促进T细胞毒性细胞应答来介导全身肿瘤特异性免疫应答[37]。Kaufman等[38]在不可切除的IIIc期和IV期转移性MM患者皮损中注射T-VEC发现,特异性CD8+T细胞中MART-1(T细胞识别的MM相关抗原)增加,抑制性免疫细胞显著减少。表明肿瘤微环境中的这些变化可能是治疗有效的决定因素。Andtbacka等[39]设计的一项随机,非盲的Ⅲ期临床试验(OncovexGM-CSFPivotal Trial in Melanoma, OPTiM)中,将436例IIIB~IV期未行手术切除的MM患者以2∶1的比例随机分配到病灶内注射T-VEC或皮下注射GM-CSF组。研究发现,用T-VEC治疗的患者的持久反应率明显高于GM-CSF组(分别为16.3%vs2.1%)。T-VEC和GM-CSF的中位OS分别为23.3个月和18.9个月。该研究表明,溶瘤免疫治疗可以改善不可切除或转移MM患者的总体存活率[40]。T-VEC疗效在IIIB、IIIC或IVM1a期MM患者和未接受过治疗的患者中最为明显。因为这项研究,FDA批准T-VEC用于治疗不能手术的III期和IV期MM患者。
虽然T-VEC的作用机制尚不完全清楚,但其安全性和促进免疫反应的能力表明未来与其他免疫治疗方法联合研究,包括PD-1、PD-L1和CTLA-4检查点阻断成为临床研究的重中之重。联合治疗可能会为伴有远处转移的MM患者提供更多的治疗选择。Chesney等[41]设计的一项随机、非盲、II期试验用来评估T-VEC联合抗CTLA-4抗体ipilimumab与ipilimumab单药治疗无法切除的MM患者的疗效和安全性研究。研究显示,联合治疗较单药治疗的缓解率更高。研究表明,与ipilimumab单药治疗相比,该组合具有更高的抗肿瘤活性而没有额外的安全性问题(表2)。而溶瘤病毒与放疗、BRAF抑制剂、MEK抑制剂或其他的联合治疗还有待进一步研究。此外,进一步的研究可能不仅可以评估溶瘤病毒在MM患者治疗中的应用,还可以评估其他的皮肤肿瘤,如Merkle细胞瘤、鳞状细胞癌或基底细胞癌等。
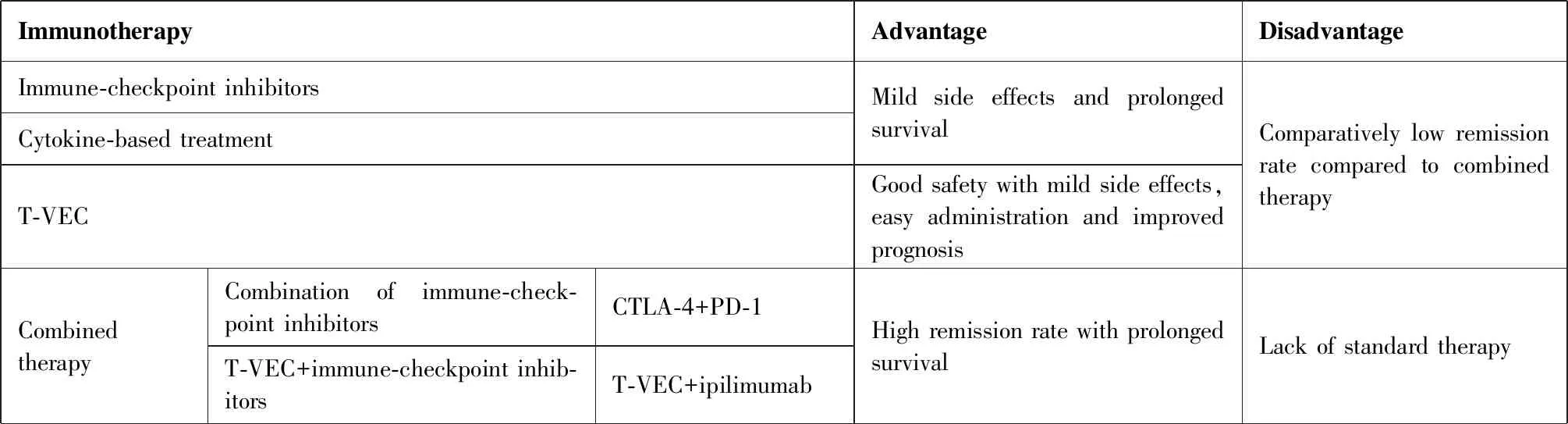
Table 2. Advantages and Disadvantages of Immunotherapy
3 结 语
本文综述了MM的不同治疗方案。然而,免疫检查点抑制剂、细胞免疫疗法缓解率低,但患者PFS久;靶向药物治疗精准且缓解率高,但维持时间短暂且不能避免耐药情况发生。联合治疗可能有协同作用,具有不良反应发生率低、耐药率低、缓解率高等优势,但目前缺乏标准的联合治疗方案。因此,如何发展合理的联合治疗方案将是我们不断研究的方向之一。这些对于正确识别可能受益于此类治疗的患者至关重要,也可以为临床试验提供更好的选择。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
