提高肿瘤光动力疗效的新策略
2020-12-29胡学超缪文俊
陶 佩,王 聪,胡学超,缪文俊,黄 和
(1. 南京工业大学 生物与制药工程学院,江苏 南京 211800;2. 南京工业大学 药学院,江苏 南京 211800)
光动力疗法(photodynamic therapy,PDT)是一种新兴的肿瘤治疗手段,它已经在皮肤癌、鼻咽癌和乳腺癌等肿瘤治疗中取得了良好的治疗效果[1-2]。PDT具体是指一种特殊的化学物质——光敏剂(photosensitizer,PS),它在组织部位有O2存在的条件下,会被特定波长的光照射后生成活性氧(ROS),造成局部肿瘤细胞死亡的一种方法[3]。在没有光照的条件下,光敏剂的毒性很低,因此可以降低PDT治疗中的系统毒性,降低对健康组织的毒副作用。与传统的手术治疗、化疗、放疗相比,PDT具有时间空间双重可控性,有望提高治疗指数与病人的顺应性[4-5]。PDT的治疗效果高度依赖于ROS的产量,同时这还与光敏剂的类型、靶细胞内的氧浓度、光剂量、靶细胞中光敏剂的摄取量以及肿瘤细胞对PDT的抗性密切相关。
尽管PDT在肿瘤治疗中有许多优点,但是由于PDT本身的特性,导致它在临床上应用仍受限制,如由于缺乏能够在肿瘤部位富集、产生足够的ROS并在发挥作用后完全从体内清除的光敏剂;缺乏能够充分穿透组织达到肿瘤部位并对正常组织没有损伤的光源;肿瘤细胞的快速增殖造成实体瘤缺氧微环境等。此外,目前大部分PDT的应用涉及O2的大量消耗,而缺氧不仅与肿瘤恶化、化疗和放疗抗性密切相关,还会导致不良的预后和肿瘤转移可能性的增加。因此,开发安全有效的新策略来解决这些问题非常有必要。本篇综述就PDT在肿瘤治疗中存在的局限性,尤其是针对肿瘤缺氧环境,介绍了通过各种手段克服或者利用缺氧环境增强PDT治疗并讨论PDT在未来临床应用中的一些挑战。
1 光动力疗法(PDT)
1.1 光动力疗法的基本原理
PDT具体原理如图1所示,处于基态(S0)的光敏剂被合适波长的光照射后,吸收能量变成单激发态(S1)。处于激发态的光敏剂可以通过系间跨越转移到能级更低的长寿命激发三重态(T1)。激发三重态的光敏剂可以和周围的分子反应,通过2种途径产生活性氧(ROS)[6-7]。第1种途径是处于激发态的光敏剂和底物之间转移一个氢原子或者一个电子,生成游离的自由基,然后再和氧气反应,产生ROS,如超氧化物自由基、羟基自由基等(Ⅰ型反应)。第2种途径是被激发的光敏剂和基态中的分子氧(3O2)之间进行能量转移,形成单线态氧(1O2)(Ⅱ型反应)。由这2种不同途径产生的ROS都会对肿瘤细胞或者组织造成不可逆的损伤。但是由于ROS和单线态氧物质半衰期短,因此在PDT治疗中,只有那些在产生细胞毒性物质附近的肿瘤区域组织或者细胞才会直接受到影响,健康组织则不会受到伤害。此外,处于激发态的光敏剂除了系间跨越快速转移能量外,还可以通过热能或荧光发射的方式回到基态。这种转换可以用来成像或者光检测。

图1 光动力疗法(PDT)原理示意Fig.1 Schematic illustration of the mechanism of photodynamic therapy
1.2 PDT在肿瘤治疗中的局限性
1.2.1 缺乏理想的光敏剂
一个理想的光敏剂要求其能有效地聚集在肿瘤部位,并且在发挥作用后能够在体内被降解,排出体外,同时具有较小的暗毒性[8]。由于实体瘤的高通透性和滞留效应(EPR效应),会促进大分子物质在肿瘤部位的聚集,同时增加药效,减少全身的副作用[9]。光敏剂一般是大分子结构,所以它能够优先富集于肿瘤部位。现在临床上应用的光敏剂大部分是具有近红外吸收、成分明确、简单稳定的物质。
应用于PDT治疗的第一代商业用有机光敏剂是血卟啉衍生物(HpD)和它的提纯活性物质光敏素(photofrin)[10]。第二代光敏剂包括卟啉类化合物和非卟啉类化合光敏剂物,比如血卟啉单甲醚、金属酞菁、5-氨基乙酰丙酸(ALA)及其衍生物。为了克服上述光敏剂半衰期短、易自我聚集和在皮肤组织蓄积等缺点,研究人员在第二代光敏剂上引入具有生物活性或者分子识别功能的官能团,开发了第三代光敏剂,如氨基酸偶联光敏剂、蛋白质或糖偶联光敏剂等[11],从而能够被有效递送到靶部位。除了上述有机光敏剂外,无机光敏剂由于稳定性好,容易被化学修饰,也引起了广泛关注,比如一些金属氧化物和上转换纳米粒子(UCNPs)[12-14]。但是由于它们难以在体内降解,容易对正常组织产生毒性,因此也难以得到广泛应用。现在临床上常用的光敏剂如表1所示。
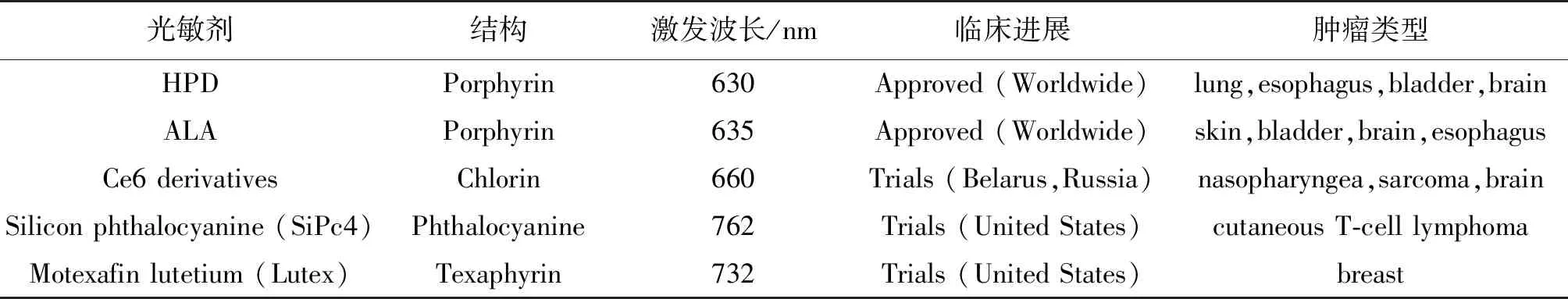
表1 临床应用的光敏剂Table 1 Photosensitizers applied in clinics
1.2.2 光源及其组织穿透度低
光源就像是控制PDT的开关一样,当光源打开以后,要求光源能够充分穿透正常组织达到病灶部位。理想的光给药剂量是指能够有效激活光敏剂、造成靶部位细胞死亡、但是对正常细胞没有伤害的剂量。然而在现实应用上,这种光剂量的选择效果基本上很难实现。对于有效的PDT,光源至少应满足以下2个条件[15]:①适当的光谱特性,即与所用的光敏剂最大吸收波长范围一致;②足够的穿透深度,即用最小的光散射,最大可能激活光敏剂。大部分的光敏剂在可见光区域具有强吸收,然而由于生物组织具有许多内源性发色团,如血红蛋白、肌红蛋白和细胞色素等,它们在很大程度上可以吸收可见光,导致光能迅速衰减[16]。而且这些具有内源性发色团的组织结构一般都不均匀,容易导致光在传播中改变方向,不能到达深部组织以获得有效的PDT。通常紫外和可见光的穿透深度仅为1~3 mm,不能满足实体瘤或者深部肿瘤治疗的要求[17]。被称为生物组织的光学窗口的近红外光(NIR,700~1 300 nm)可在一定程度上增强组织的穿透厚度[18]。此外,光的剂量、强度和照射时间都与PDT治疗效果有关,选择合适的光源和治疗参数对有效的PDT至关重要。
1.2.3 肿瘤缺氧
PDT是一种氧依赖性的治疗方式,通过消耗大量的组织O2来产生ROS,导致或加重肿瘤区域缺氧。产生的ROS会损伤血管内皮细胞,导致血管功能部分或者完全损伤,引起严重的缺氧环境[19]。此外,由于肿瘤新生血管结构功能的异常,导致实体瘤中心处于缺氧状态。缺氧不仅与肿瘤恶化、化疗和放疗抗性密切相关,还会导致不良的预后和肿瘤转移的增加。已经有研究发现这些副反应是由缺氧相关基因被激活介导的,例如,缺氧诱导因子(HIF)-1 被过度表达,氧调节相关的缺氧基因的主要转录因子被激活[20]。这些不足之处在一定程度上限制了PDT在临床上的应用。
2 克服肿瘤缺氧环境提高PDT疗效
由于PDT具有非入侵性和高选择性等优点,成为治疗多种良性、恶性疾病的一种新兴治疗方式。但是由于PDT会造成组织局部缺氧,进而导致PDT在常规的放疗及化疗中效果较差。为了提高PDT的抗肿瘤效果,利用纳米粒子来改善肿瘤缺氧环境得到了广泛关注。比如,通过改善肿瘤部位的血液灌注[21]、开发供氧纳米粒子[22]和增强原位肿瘤区域氧浓度[23]等(图2)。
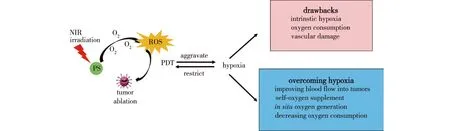
图2 克服PDT造成的缺氧微环境的方法Fig.2 Strategies for overcoming hypoxia microenvironment for enhanced PDT
2.1 改善瘤内血液灌注
改善血液流动被认为是提高瘤内氧浓度,增强PDT疗效的有效方法。近年来,通过增加肿瘤局部温度提高肿瘤内的血流量来缓解肿瘤缺氧的方法已经得到充分的证明[24]。光热疗法[25](PTT)是一种已经被广泛研究的肿瘤消融方法,通常利用具有光热性质的纳米粒子将近红外光能转换为热能。因此,利用轻度PTT手段提高肿瘤部位血流,增加瘤内O2水平,将有利于缓解肿瘤缺氧。Feng等[26]制备了含有光敏剂二氢卟吩e6(Ce6)和光热剂DiR的脂质体DiR-hCe6-liposome,在785 nm激光照射下激活DiR产生光热效应,促进肿瘤内血流,减轻肿瘤缺氧;在660 nm发光二极管照射下激发活Ce6触发PDT效应。体内实验发现,与hCe6-liposome相比,DiR-hCe6-liposome在光照后,明显改善瘤内血流,缓解肿瘤缺氧,增强PDT治疗效果(图3)。

图3 通过改善瘤内血液灌注克服肿瘤缺氧[26]Fig.3 Overcoming tumor hypoxia via improving blood flow into tumors[26]
除了利用高温来暂时改善肿瘤血流量外,利用具有抗血管生成功能的化药(如紫杉烷、吉西他滨、环磷酰胺和顺铂等)能够使结构功能异常的肿瘤血管正常化,从而有利于瘤内血液和氧气的灌注[27]。例如,Wang等[28]最近开发了一种光敏剂四羟基苯基卟啉(THPP)和前药(顺铂)交联的聚合物用于肿瘤治疗,由于肿瘤区域谷胱甘肽水平降低,可以使顺铂在此环境中释放,降低血管内皮生长因子的表达,使血管正常化,从而减轻肿瘤缺氧程度并增加PDT疗效。
2.2 肿瘤递氧
利用能够运输O2的纳米载体,将O2输送到肿瘤区域是另一种克服肿瘤缺氧的方法。已经发现被修饰过的红细胞(RBCs)、血红蛋白(Hb)以及全氟化碳(PFC)等可以有效递送O2。游离的Hb由于它本身稳定性差以及半衰期短等缺点,一般通过物理包封或化学缀合可以增加游离Hb在体内的循环时间以及其递氧能力。在Wang等[29]的工作中,利用聚合物包封Hb与光敏剂酞菁锌(ZnPc)复合物,在光照条件下,可以有效缓解肿瘤缺氧区域,提高PDT治疗效果。然而,由于Hb的O2负载率较小(每个Hb负载4个O2分子),具有更高氧亲和力的PFC被更多用于O2输送。比如,Cheng等[30]开发了一种负载IR780近红外染料的PFC纳米滴,不仅可以增加NIR染料的单线态氧产率,还可以增加肿瘤部位的O2,在动物体内研究表明这种PFC/ IR780纳米药物完全抑制肿瘤生长,增强PDT治疗,为肿瘤患者提供一种简单有效的治疗选择(图4)。

图4 递送O2到肿瘤部位克服肿瘤缺氧[30]Fig.4 Overcoming tumor hypoxia via delivering oxygen into tumors[30]
2.3 肿瘤原位产氧
与正常的组织相比,肿瘤区域中内源性的H2O2的水平更高,因此可以通过催化瘤内H2O2分解产生O2缓解瘤内缺氧情况。此外,肿瘤细胞内H2O2水平的高低与DNA损伤、细胞增殖、转移和血管生成等息息相关[31]。因此,利用可以有效包封过氧化氢酶或类酶的纳米粒子,催化肿瘤部位H2O2生成O2,提高光动力治疗效果。比如,Cheng等[32]将过氧化氢酶和光敏剂同时包封在多孔沸石咪唑酯骨架(ZIF-8)中,利用癌细胞膜形成CAT-PS-ZIF@Mem纳米粒。由于肿瘤内H2O2浓度高,会被过氧化氢酶催化产生O2,用于有效的PDT治疗。除了过氧化氢酶之外,其他可以催化H2O2生成O2的MnO2、KMnO4、金纳米簇、铂纳米酶、介孔氧化铈纳米粒等物质也被广泛研究用于肿瘤的缺氧治疗。
除了利用H2O2生成O2外,Zheng等[33]利用水作为O2来源用于增强PDT治疗,他们将量子点附着在C3N4上,再与PpIX复合物和靶向癌细胞的RGD结合,红光照射后在水中能够有效产生O2,克服由PDT引起的缺氧,最终提高治疗效果。
3 利用肿瘤缺氧提高PDT疗效
除了利用各种手段克服肿瘤缺氧以提高PDT治疗疗效外,还可以利用这种缺氧环境提高PDT的疗效。PDT治疗后加重的缺氧环境可以作为高度特异性的触发条件,允许药物在肿瘤区域被选择性递送或活化,从而产生更好的抗癌效果,同时具有最小的全身毒性。
生物还原性药物是一类在生物体内还原生成具有细胞毒性的物质[34],特别是在缺氧环境中能够高度杀伤肿瘤细胞,为肿瘤缺氧治疗提供了一种新手段。
3.1 生物还原性药物的分类
在缺氧条件下,可以被酶还原活化的化合物分为五类,分别是硝基咪唑类、芳香族氮氧化物、脂肪族氮氧化物、醌和金属络合物(图5)。这些生物还原性药物大部分经由单电子或双电子还原反应生成超氧化合物、前药自由基,产生细胞毒性药物。

图5 生物还原性药物的结构Fig.5 Structures of the bioreductive drugs
3.1.1 硝基咪唑类
硝基咪唑类化合物,如米索硝唑、依他硝唑和尼莫唑等药物最初主要作为放射增敏剂而被设计,后来逐渐被用于选择性缺氧细胞[35]。PR-104是一种水溶性磷酸酯前药前体,可在体内迅速被水解为前药PR-104A[36]。PR-104A是一种二硝基苯甲酰胺氮芥,可以被各种氧化还原酶还原为PR-104H和PR-104M。这些代谢产物会引起DNA链断裂,诱导产生DNA自由基,杀死肿瘤细胞[37]。
3.1.2 芳香族N-氧化物
迄今为止,氮氧化物替拉扎明[38](TPZ)是临床上使用最广泛的生物还原性药物。TPZ于1986年首次被报道,并在体外研究中发现它在缺氧条件下比在正常氧分压条件下显示出高200倍的细胞毒性。在缺氧环境中,TPZ由细胞色素P450经由单电子还原生成TPZ自由基,再自发转换生成苯并三嗪自由基,最终导致DNA链断裂,造成细胞死亡[39]。而当有氧气存在时,TPZ经历无效循环回到母体化合物,同时生成超氧化物。TPZ的双电子还原反应是对机体的一种保护过程,因为在此过程中不产生TPZ自由基,而只产生单一无毒性的代谢物N-氧化物。在一部分临床III期试验中,TPZ没有显示出比传统治疗更高的疗效。III期试验中的非预期结果可能反映了TPZ需要在具有高水平肿瘤缺氧的患者群体中才能得到更好的治疗效果。SN30000是TPZ的类似物,相比较于TPZ,它到达缺氧肿瘤细胞区域的浓度更高。
3.1.3 脂肪族N-氧化物
AQ4N(banoxantrone)是一种蒽醌类化合物,在缺氧条件下被代谢为AQ4[40]。AQ4是一种具有高亲和力的DNA嵌入剂,能抑制拓扑异构酶Ⅱ的作用[41]。与芳香族N-氧化物不同,AQ4N被细胞色素P450同工酶或氧化氮合酶进行双电子还原[42]。由于这些酶在氧气存在条件下会被抑制,因此它们具有缺氧选择性。体外实验证明,AQ4N与放疗或化疗联合展现出良好的前景,这为AQ4N能够进入临床试验提供依据[43]。
3.1.4 醌类化合物
醌类化合物丝裂霉素C(MMC)早在1980年就发现在缺氧肿瘤细胞中会被激活[44]。但是MMC在缺氧条件下被激活的效率是有限的,后来又有研究发现对缺氧细胞具有更高选择性的醌类化合物,比如甲基丝裂霉素和EO9(apaziquone)等。在缺氧条件下,这类醌类化合物是通过单电子还原酶被还原成半醌自由基,再进一步被还原酶被激活产生氢醌[45],最终导致DNA分子内和分子间链的交联[46],达到肿瘤治疗的目的。其中,吲哚醌EO9[47]对缺氧细胞的选择性最高,但是由于它半衰期短,限制了其在临床上的应用。
3.1.5 金属络合物
过渡金属的复合物有可能为缺氧靶向剂使用,尽管至今尚未用于临床研究。从1993年开始,一系列氮芥络合物首先作为缺氧选择剂使用[48]。这类化合物的细胞毒性取决于氮芥的电子密度。氮孤对电子与钴(Co,III)的配位抑制了烷基化反应。在低氧条件下,Co(III)可以被单电子还原为Co(II),解离生成细胞毒性配体。目前金属络合物作为缺氧细胞杀伤剂只处于体外研究阶段。
3.2 生物还原性药物增效PDT疗法
最近,缺氧特异性的生物还原性药物联合PDT在肿瘤治疗中引起了极大的关注。Liu等[49]设计了硅-壳上转换纳米粒子(UCNPs)共同递送光敏剂和生物还原前药TPZ(图6(a)),在正常O2环境下首先通过基于UC-PDT实现了光动力作用,随后立即激活TPZ,生成具有细胞杀伤作用的自由基,最终产生协同肿瘤治疗效果。与单独使用UC-PDT相比,TPZ-UC/PS在NIR激光治疗后可有效抑制肿瘤生长,这意味着UC-PDT和TPZ的联合使用在深部肿瘤治疗中显示出巨大的潜力。
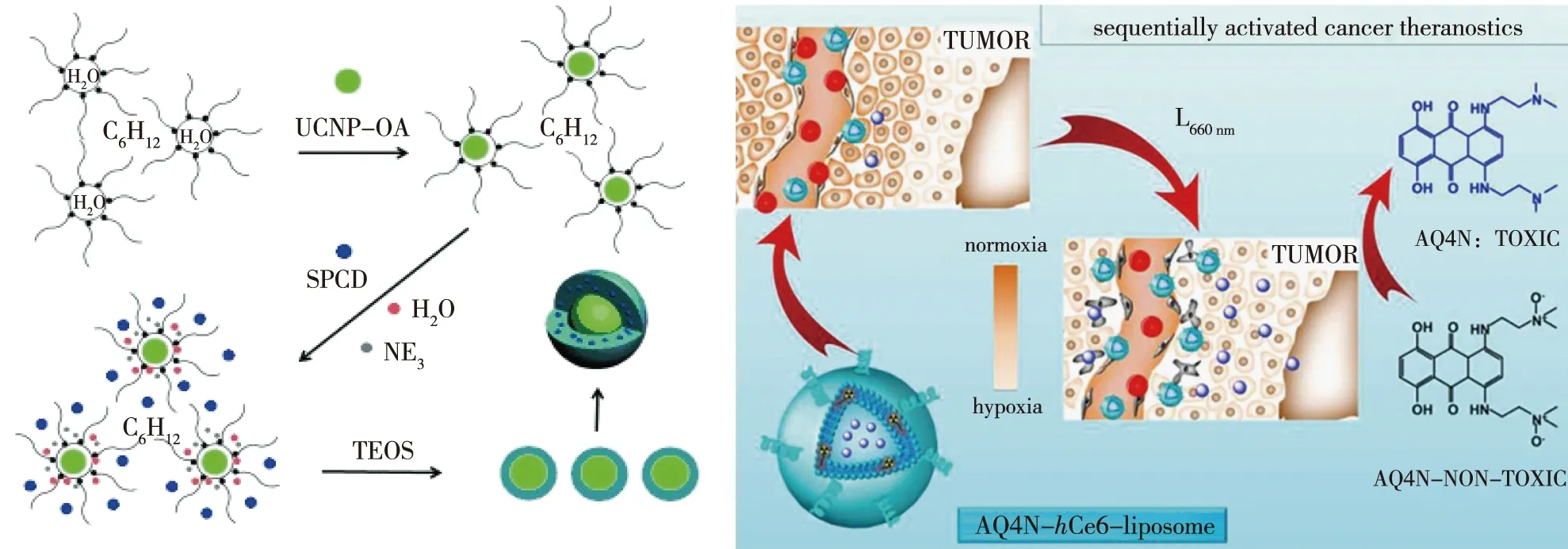
(a)基于上转换的光动力疗法诱导的缺氧[49] (b)包裹缺氧激活前药脂质体用于肿瘤治疗[50]图6 利用肿瘤缺氧环境提高PDT疗效Fig.6 Utilizingtumor hypoxia for improving the efficacy of PDT
然而,UCNPs中金属物质在体内难以降解,限制了它的进一步使用。Feng等[50]利用脂质体包裹二氢卟吩和生物还原前药AQ4N(图6(b)),所制备得到的AQ4N-hCe6脂质体具有明显的缺氧依赖性细胞毒性和有效的光动力细胞杀伤能力。该研究为生物还原性药物增强PDT治疗在未来临床上的应用提供依据。
4 其他手段调整肿瘤缺氧微环境提高PDT治疗疗效
除了上述提到的一些改善肿瘤缺氧环境提高PDT治疗外,肿瘤缺氧微环境还与缺氧诱导因子(HIFs)的过表达和透明质酸等相关[51-52]。缺氧诱导因子(HIFs)由HIF-1α(氧调节亚基)和HIF-1β(稳定亚基)组成,其中HIF-1α的表达被认为是缺氧的主要转录调节因子。HIF-1在肿瘤血管生成、葡萄糖代谢、肿瘤干细胞的发育、肿瘤细胞的侵袭与转移、多药耐药性(MDR)等起到重要作用[53-56]。Broekgaarden等[57]利用阳离子脂质体负载HIF-1抑制剂(acriflavine)和光敏剂(ZnPC),在体外研究时发现,经该脂质体处理可有效降低HIF-1表达,导致在低氧条件下PDT诱导的表皮样癌细胞死亡程度增加。
透明质酸是一种阴离子糖胺聚糖,是肿瘤细胞外基质的主要成分之一,被认为与恶性肿瘤的进展和不良预后相关。在乳腺癌和前列腺癌中都已经发现透明质酸的表达比较高[58-59]。透明质酸酶是能使透明质酸产生低分子化作用酶的总称,是一种能够降低体内透明质酸的活性、从而提高组织中液体渗透能力的酶。Gong等[52]利用透明质酸酶增加微血管密度改善肿瘤内的灌注,在4T1荷瘤小鼠模型中有效缓解肿瘤的缺氧状态,提高PDT疗效。
5 结论与展望
在过去的30多年里,由于具有精确控制治疗区域、重复治疗等优点,PDT在肿瘤治疗中取得了重要进展。但是当前应用的大部分光敏剂在体内溶解度较低、生物利用度不高;激光本身对组织穿透力差,难以达到深层区域的肿瘤;肿瘤部位乏氧情况降低了PDT疗效,因此需要进一步开发安全有效的PDT治疗方式,减少治疗后的复发及转移。针对这些不足之处,已经有更多的近红外光光敏剂用于提高组织穿透力,改善PDT疗效。笔者主要介绍了通过不同的方法可以有效缓解或者利用肿瘤缺氧微环境,增强PDT治疗疗效,最终达到改善肿瘤治疗的目标。包括通过光热效应增加血流量,或者抗血管生成功能的药物,使肿瘤血管正常化;利用红细胞、血红蛋白以及全氟化碳等作为载体有效递送O2到肿瘤部位;通过H2O2催化酶、MnO2和KMnO4等导致H2O2的分解,在肿瘤原位区域生成氧气;利用生物还原药物联合PDT治疗以及一些新的策略调整肿瘤缺氧微环境提高PDT治疗疗效等。这些不同的治疗手段为PDT扩大治疗范围提供了基础。
然而,尽管以上策略在增效PDT的有效性方面得到了验证,但其在体内的生物相容性、安全性和药代动力学特征仍有待进一步研究。因此,仍需探索新的治疗手段和方法以有效精确地利用PDT,为其在临床研究中提供新方向。
