重组大肠杆菌分泌表达鼠源羧肽酶B及其培养基优化
2020-12-29於瑞梅顾正华李由然丁重阳石贵阳
於瑞梅,辛 瑜,顾正华,吴 松,李由然,丁重阳,石贵阳,张 梁
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122;3.苏州鲲鹏生物技术有限公司,江苏 苏州 215300)
羧肽酶B(carboxypeptidase B,CPB,EC 3.4.17.2)是一类含有锌离子的外肽酶,分子量为3.5×104,能够特异性地切除蛋白质或多肽C末端的碱性氨基酸,尤其是精氨酸和赖氨酸[1]。羧肽酶原B(proCPB)是羧肽酶B的酶原形式,胰蛋白酶通过在Arg95处切除前导肽可将羧肽酶原B激活,得到有活性的羧肽酶B[2]。羧肽酶B作为一个工具酶,在生物学、医学诊断和药物生产中有着重要的作用,已广泛应用于蛋白质、多肽的末端修饰[3],急性胰腺炎及胰腺植皮排斥的血清标记[4-6],尤其在胰岛素原活化为胰岛素的过程中,羧肽酶B是不可缺少的双酶之一[7]。此外,羧肽酶B的表达水平与一些疾病有关[8-9]。
早期常从胰腺组织中直接提取CPB,获得的CPB不仅产量低、成本高,而且还可能混有感染物质或其他蛋白酶[10]。基因工程可以有效地解决上述问题。CPB作为一种蛋白水解酶,对表达宿主存在蛋白毒性,而且在没有前导肽辅助的情况下正确折叠率低,因此常以proCPB的形式进行重组表达。Eaton等[11]和Ventura等[12]在巴斯德毕赤酵母中分别表达了人血浆羧肽酶原B和猪胰腺羧肽酶原B;王德解[13]在毕赤酵母中利用pAOX1系统表达了鼠羧肽酶原B,比酶活可达110 U/mg;汪海洋[14]在粟酒裂殖酵母中表达了人源羧肽酶B,但表达量和酶活均很低。
除了在真核系统中进行异源表达,也有研究利用大肠杆菌进行原核表达。Li等[15]在大肠杆菌中以包涵体形式表达了大鼠proCPB;辛爱洁等[16]、张晓彦等[17]对鼠羧肽酶原B包涵体的变复性条件进行了研究;张映新等[18]在Li等[15]的研究基础上对诱导条件进行优化,首次实现了鼠羧肽酶原B在大肠杆菌中的可溶性表达。
总体来说,羧肽酶原B在大肠杆菌中的表达大多以包涵体形式存在,需经过变性、复性步骤才能得到有活性的CPB。为了简化纯化步骤,节约生产成本,本研究中笔者在鼠羧肽酶原B的N端添加信号肽OmpA,以实现鼠羧肽酶原B在大肠杆菌中的胞外分泌表达,并进一步通过单因素和正交试验对培养基组成(碳源、氮源、金属离子与培养基添加剂)及发酵条件(诱导温度与诱导时间)进行优化,以期提高CPB的可溶性表达。
1 材料与方法
1.1 材料与试剂
大肠杆菌BL21(DE3)、表达载体pET-28a(+)保藏于笔者所在实验室。
马尿酰-L-精氨酸(hippuryl-L-arginine),美国Sigma公司;一抗CPB(D-3),圣克鲁斯生物技术(上海)有限公司;二抗goat-anti-mouse IgG-HRP,爱必信(上海)生物科技有限公司;T4DNA连接酶,TaKara公司;蛋白胨、酵母提取物,英国Oxoid公司;质粒小量提取试剂盒、DNA片段纯化试剂盒、DNA凝胶回收试剂盒,美国Axygen公司;其他试剂均为国产分析纯。
LB液体培养基:蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L,LB固体培养基另加入质量分数2%的琼脂粉,121 ℃高压灭菌20 min。在质粒构建、种子培养及发酵过程中添加的氨苄青霉素终质量浓度为100 μg/mL。
1.2 仪器与设备
BoltTMMini Gel Tank、iBlot®2 Gel Transfer Device、iBindTMWestern Device,美国Thermo Fisher Scientific公司;SCG蛋白纯化系统,苏州赛谱仪器有限公司;S100D型PCR仪,美国Bio-Rad公司;CF16RX Ⅱ型冷冻离心机,日本HITACHI公司;V-1200型分光光度计,上海美谱达仪器公司;HYL-C型组合式摇床,太仓市实验设备厂。
1.3 方法
1.3.1 重组表达质粒的构建
NCBI中查询得到鼠源proCPB的mRNA序列(NCBI Reference Sequence:NM_012533.2)和信号肽OmpA氨基酸序列(GenBank登录号:AAC74043.1,第1~21个氨基酸为信号肽OmpA序列),送往生工生物工程(上海)有限公司合成。分别以合成的信号肽OmpA和proCPB的cDNA为模板,proCPB-F/proCPB-R和OmpA-F/OmpA-R为引物(表1)进行PCR,得到片段OmpA和A-proCPB-6*His,二者进行融合PCR,获得融合片段OmpA-proCPB-6*His。

表1 引物Table 1 Primers
将融合片段OmpA-proCPB-6*His通过T/A克隆连入pMD19-TSimple,获得重组质粒pMD19T-OmpA-proCPB,并将重组质粒转化到克隆宿主E.coliJM109中,菌落PCR筛选阳性转化子,提取质粒并委托上海生工测序。用EcoR Ⅰ 和Hind Ⅲ 对测序正确的重组质粒进行双酶切并胶回收融合片段,用T4DNA连接酶将融合片段与经相同酶切后的载体pET28a连接,获得重组表达质粒pET28a-OmpA-proCPB,并将重组表达质粒转入表达宿主E.coliBL21(DE3)中,菌落PCR筛选阳性转化子,提质粒酶切验证并测序。
1.3.2 种子培养
挑取甘油管保藏的重组表达菌株,在LB固体平板上划线,置于37 ℃培养箱中过夜培养。次日,挑取长出的单菌落转接至50 mL LB液体培养基中,置于37 ℃、200 r/min摇床中培养10 h左右,作为种子液。
1.3.3 发酵培养
将培养好的种子液按2%接种量转接至50 mL LB液体培养基中,37 ℃、200 r/min培养至OD600为0.6左右,然后加入终浓度为0.1 mmol/L的β-D-异丙基硫代半乳糖苷(IPTG),置于20 ℃、200 r/min摇床中诱导培养30 h。
1.3.4 羧肽酶原B的纯化
将诱导表达后的发酵液在4 ℃下12 000 r/min离心10 min,收集上清粗酶液。用5 mL镍柱对粗酶液进行纯化。先用30 mL A液(25 mmol/L Tris-HCl,0.5 mol/L NaCl,50 mmol/L咪唑,pH 7.4)平衡镍柱,然后进样120 mL,进样时流速为1 mL/min,进样结束后,先用50 mL A液进行柱冲洗,再用84%A液和16%B液(25 mmol/L Tris-HCl,0.5 mol/L NaCl,0.5 mol/L咪唑,pH 7.4)洗脱杂蛋白,最后以100%B液洗脱目的蛋白,收集蛋白峰洗脱液,进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)分析。得到的上述proCPB洗脱液用含有0.5 mol/L NaCl的25 mmol/L Tris-HCl溶液(pH 8.0)进行透析,去除高浓度咪唑。
1.3.5 羧肽酶原B的酶解
胰蛋白酶通过在Arg95处切除前导肽可将羧肽酶原B激活,得到有活性的羧肽酶B。根据Bradford法[19]测定透析后proCPB酶液的蛋白浓度,并按照1∶ 50的质量比向proCPB酶液中加入胰蛋白酶,37 ℃酶解2 h,每隔30 min取1次样并做SDS-PAGE分析。
1.3.6 羧肽酶B的纯化
酶解后得到的CPB酶液含有前导肽和胰蛋白酶,需再进行一次镍柱纯化。用1 mL镍柱对酶解液进行纯化。先用10 mL A液平衡镍柱,然后进样10 mL,进样时流速为0.5 mL/min,进样结束后,先用10 mL A液进行柱冲洗,再以100%B液洗脱目的蛋白,收集蛋白峰洗脱液,进行SDS-PAGE分析。得到的上述CPB洗脱液用25 mmol/L Tris-HCl缓冲液(含0.1 mol/L NaCl,pH 7.65)进行透析,以去除高浓度的咪唑。
1.3.7 羧肽酶B的活力测定
羧肽酶B能够将马尿酰-L-精氨酸水解成马尿酸,而马尿酰-L-精氨酸和马尿酸的吸收光谱具有差异。根据Folk等[20]的方法测定鼠羧肽酶B的活力:用25 mmol/L Tris-HCl缓冲液(含0.1 mol/L NaCl,pH 7.65)配制的0.001 mol/L马尿酰-L-精氨酸盐溶液为底物(现配现用),取光程为1 cm的带盖石英比色杯,加入25 ℃预热过的3 mL底物溶液,并精密吸取重组CPB酶液10 μL加入,立即摇匀并调零,在254 nm的波长处每隔30 s读取吸光度,共5 min。测定3次,取平均值。整个测定过程在室温(25 ℃)进行。pH 7.65、25 ℃下每1 min水解1 μmol底物所需的酶量定义为1个酶活力单位U。
酶活力(U/mL)计算:以吸光度为纵坐标,时间为横坐标作图,在吸光度对时间的关系图中,取呈直线部分的吸光度,按式(1)计算。

(1)
式中:ΔA254/t(min)为相关系数R2>0.99时的回归直线的斜率;0.36为在上述条件下,吸光度每分钟改变0.36即相当于一个羧肽酶B单位;3为底物溶液体积,mL;0.01为加入的酶液体积,mL。
1.3.8 单因素试验
选取碳源、氮源、金属离子和培养基添加剂作为考察因素,通过测定proCPB胞外表达量和菌体生长量来判断这些因素对产酶和菌体生长的影响,再通过单因素试验的结果确定正交试验的因素及水平。以下实验每个因素做3个平行,取平均值。
1)不同碳源对proCPB产量及菌体生长的影响。以LB培养基为基础发酵培养基,分别添加5 g/L的葡萄糖、乳糖、甘油、可溶性淀粉、麦芽糖和蔗糖,以原始LB培养基作为对照,发酵结束后考察菌体量和proCPB的胞外表达量,筛选出最佳碳源。
2)不同氮源对proCPB产量及菌体生长的影响。在最佳碳源的基础上,分别用15 g/L的蛋白胨、酵母粉、(NH4)2SO4、尿素、NH4Cl和NaNO3来替代LB培养基中的复合氮源(质量比2∶ 1的蛋白胨和酵母粉),并以复合氮源作为对照,发酵结束后考察菌体量和proCPB的胞外表达量,筛选出最佳氮源。
3)不同金属离子对proCPB产量及菌体生长的影响。在最佳碳源和最佳氮源的基础上,向发酵培养基中添加终浓度为1 mmol/L的Mg2+、Ca2+、Mn2+、Fe3+、Zn2+、Ni2+、Co2+和Cu2+,以不添加金属离子作为对照,发酵结束后考察菌体量和proCPB的胞外表达量,筛选出最佳金属离子。
4)不同培养基添加剂对proCPB产量及菌体生长的影响。在最佳碳源、最佳氮源和最佳金属离子的基础上,当添加诱导剂时,向培养基中加入终浓度为0.5 mol/L的山梨醇、质量分数2%Tween-80、0.5%甘氨酸、1%甜菜碱、0.5%Triton X-100和0.02%SDS,以不添加培养基添加剂为对照,发酵结束后考察菌体量和proCPB的胞外表达量,筛选出最佳培养基添加剂。
1.3.9 正交试验
以上述单因素试验为基础,结合诱导温度和诱导时间进行6因素5水平的正交试验,筛选出最佳的培养基组合和发酵条件,利用正交设计助手对结果进行分析。
1.3.10 Western blotting检测胞外proCPB的表达量
取2 mL发酵液,4 ℃、12 000 r/min离心20 min,从中取出1.5 mL上清液,加入(NH4)2SO4至75%饱和度(0.387 g)进行沉淀,4 ℃过夜。次日,将(NH4)2SO4沉淀液在4 ℃下12 000 r/min离心20 min,吸尽液体并加入40 μL的8 mol/L尿素重悬底部蛋白沉淀,即为蛋白样品。向蛋白样品中加入10 μL的5×上样缓冲液,混匀、煮沸并离心,然后点样进行SDS-PAGE分析。按照操作说明书组装NC膜、蛋白胶、滤纸等,并根据羧肽酶原B分子量大小(4.6×104)选择合适的程序(P0),用干转仪将蛋白胶上的条带转移至NC膜上。在室温下,利用iBindTM全自动蛋白印迹处理系统实现相应一抗和二抗的孵育、洗膜。最后通过ECL化学发光法显色,利用GelPro3软件进行蛋白条带灰度分析。
2 结果与讨论
2.1 重组表达质粒的构建
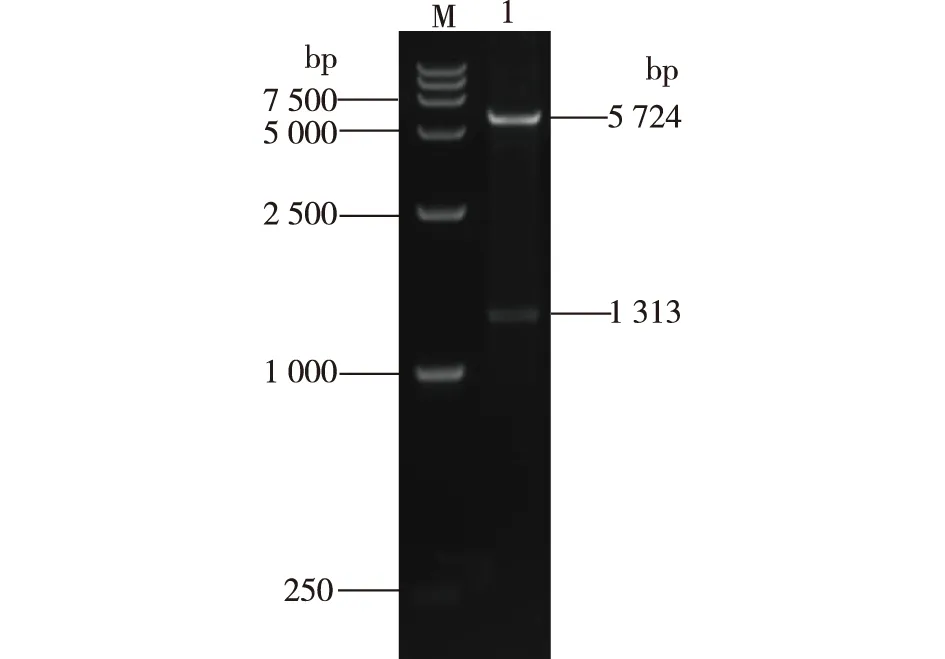
M—标准DNA;1—重组表达质粒pET28a-OmpA- proCPB经EcoRⅠ和HindⅢ双酶切图1 重组表达质粒pET28a-OmpA-proCPB双酶切验证Fig.1 Identification of pET28a-OmpA-proCPB by double restriction enzyme digestion
将构建得到的重组表达质粒pET28a-OmpA-proCPB用EcoRⅠ和HindⅢ酶切验证,结果如图1所示。由图1可见,大小为5 724和1 313 bp的条带,分别与pET28a线性化载体和OmpA-proCPB-6*His融合片段大小一致,且测序结果完全正确,说明重组表达质粒pET28a-OmpA-proCPB构建成功。
2.2 羧肽酶原B的分泌表达与纯化
将重组菌BL21(DE3)/pET28a-OmpA-proCPB进行摇瓶发酵,诱导表达30 h后取发酵液进行离心,所得上清液即为粗酶液。经镍柱分离纯化,并使用SDS-PAGE进行分析,结果如图2所示。由图2可知,条带2为单一条带,大小约为4.6×104,条带大小与重组蛋白理论分子量一致,说明羧肽酶原B在信号肽OmpA的引导下成功分泌到胞外。文献[21-22]报道,信号肽可以引导目的蛋白分泌到大肠杆菌胞外,常用的信号肽有OmpT、OmpA、PelB、PhoA和LamB等。越来越多的高效信号肽被研究者们挖掘出来,但目前并没有一个信号肽可以适合各种目标蛋白,同一个信号肽的分泌效果也因目标蛋白而异。王德解[13]在毕赤酵母中利用pAOX1系统分泌表达了鼠羧肽酶原B,发酵过程中需补加甲醇,操作不方便,成本增加,生产周期长,但毕赤酵母系统可对表达的蛋白进行加工和修饰,外源蛋白分泌效率高,外源蛋白占总蛋白的10%~30%;大肠杆菌生长快、营养要求低、发酵周期短,但胞内高表达易形成包涵体,本身分泌能力很弱,外源蛋白胞外表达只占0.3%~4%。
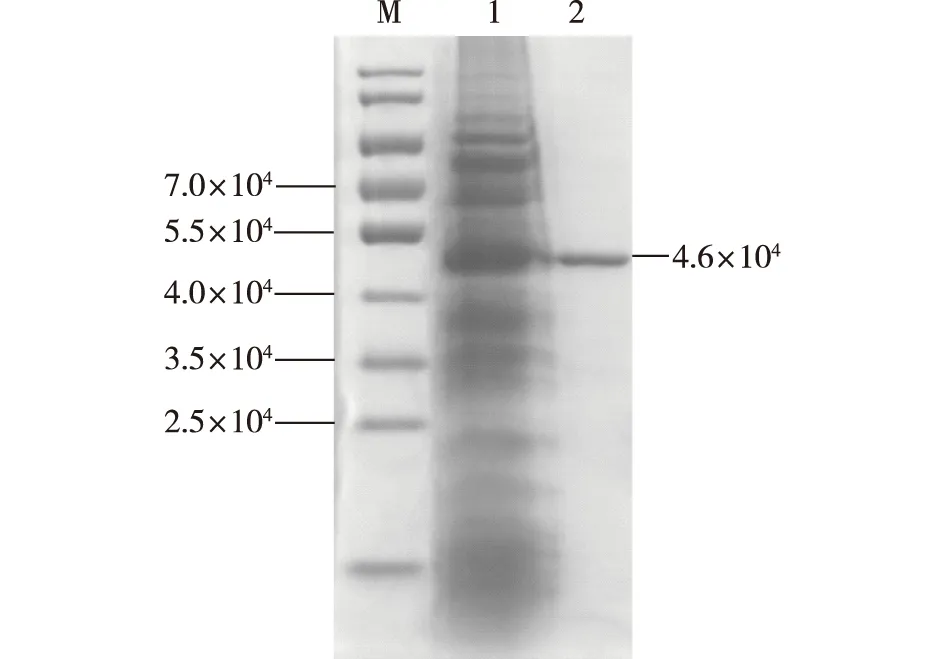
M—标准蛋白;1—重组菌BL21(DE3)/pET28a-OmpA- proCPB发酵液上清液;2—纯化后的proCPB图2 重组菌BL21(DE3)/pET28a-OmpA- proCPB 表达产物的SDS-PAGEFig.2 SDS-PAGE analysis of expression products of recom- binant strain BL21(DE3)/pET28a-OmpA-proCPB
2.3 羧肽酶原B的酶解
根据proCPB酶液的蛋白浓度,按照1∶50的质量比向透析后的proCPB酶液中加入胰蛋白酶,在37 ℃培养箱中分别酶解0.5、1、1.5和2 h时取样作SDS-PAGE分析,结果如图3所示。由图3可知,0.5 h时即有CPB条带出现,但proCPB并没有被酶解完全,随着酶解时间的延长,proCPB条带逐渐消失。直到2 h时,proCPB被全部酶解,酶解得到的CPB大小约为3.5×104,与理论的鼠羧肽酶B条带大小一致。
羧肽酶原B是羧肽酶B的酶原形式,胰蛋白酶通过在Arg95处切除前导肽可将羧肽酶原B激活,得到有活性的羧肽酶B。胰蛋白酶的酶解条件对羧肽酶B的酶活性至关重要。笔者在1∶ 50质量比的条件下,对胰蛋白酶的酶解时间进行优化,发现酶解时间过短,羧肽酶原B不能被完全酶解,只能得到部分羧肽酶B。有研究表明,酶解时间过长,则会将羧肽酶B也降解掉[23],因此酶解时间的选择至关重要。
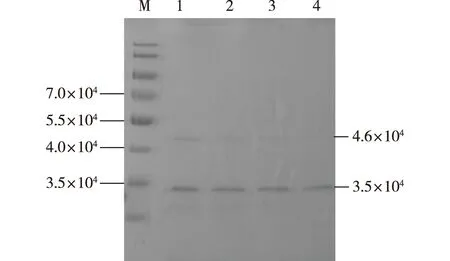
M—标准蛋白;1—0.5 h;2—1 h;3—1.5 h;4—2 h图3 胰蛋白酶最佳酶解时间的确定Fig.3 Determination of the optimum enzymatic hydrolysis time
2.4 羧肽酶B的纯化及酶活力测定
透析后的proCPB酶液经胰蛋白酶酶解2 h后,立即加入0.1 mmol/L的苯甲基磺酰氟(PMSF)终止反应,并进行镍柱分离纯化,对洗脱液进行SDS-PAGE分析,结果如图4所示。由图4可知,通过试验得到单一目的条带,大小约为3.5×104,经测定比酶活为131.22 U/mg。王德解[13]在毕赤酵母中也表达了鼠羧肽酶原B,比酶活为110 U/mg,相同的基因,比酶活却存在差异,这可能与酶的纯度有关,笔者采用两步镍柱亲和层析对产物进行纯化,王德解[13]采用两步疏水、两步离子交换层析进行纯化,纯化方式不同,获得的酶纯度可能不同,因此比酶活也会存在差异。
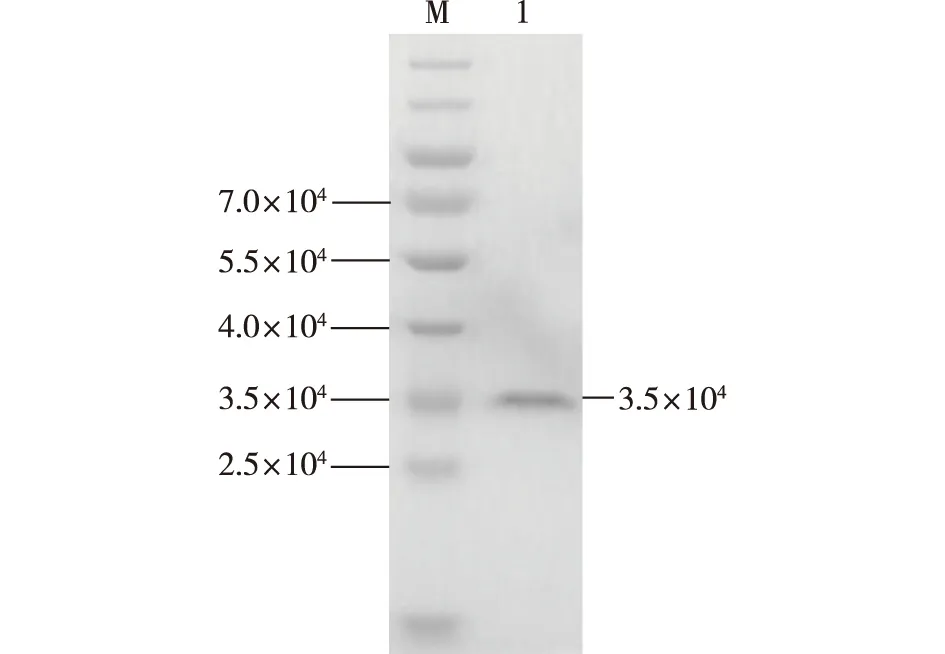
M—标准蛋白;1—纯化后的重组CPB图4 纯化后CPB的SDS-PAGEFig.4 SDS-PAGE analysis of purified CPB
2.5 碳源对proCPB胞外表达量及菌体生长的影响
碳源对微生物生长代谢有着重要的作用,能够提供细胞生长和合成产物的碳架以及细胞生命活动所需的能量。不同微生物所能产生的酶系不同,因而能够利用的碳源也不同。考察6种碳源对重组大肠杆菌的生长及proCPB胞外表达量的影响,结果如图5所示。由图5可知,以葡萄糖为碳源时,重组菌生长较差且目的蛋白proCPB几乎未表达。一方面原因在于,proCPB由T7启动子启动表达,葡萄糖的存在会产生代谢物阻遏效应,抑制目的蛋白表达;另一方面可能是重组菌消耗葡萄糖后会产酸,使pH下降,不利于生长。以蔗糖为碳源时,重组菌的生长量与对照基本一致,但胞外proCPB的相对表达量只有0.31。重组菌对麦芽糖的利用程度较差,无法较好地生长。以可溶性淀粉为碳源时,重组菌的生长量有所提高,但胞外proCPB的相对表达量却不足对照的一半。乳糖和甘油能够明显促进重组菌生长,但乳糖的产酶效果明显比甘油差,原因可能是乳糖会加快诱导表达速度,使目的蛋白来不及正确折叠,形成包涵体,从而使胞外表达量减少。以甘油为碳源时,胞外proCPB的相对表达量达到2.09,甘油既有利于重组菌生长又利于产酶,因此选择甘油为最佳碳源。

图5 不同碳源对菌体生长和产酶的影响Fig.5 Effects of different carbon sources on the growth and proCPB production
2.6 氮源对proCPB胞外表达量及菌体生长的影响
氮源主要用于菌体细胞物质和含氮代谢物的合成。为了研究不同氮源对菌体生长和产酶的影响,选取6种氮源进行单因素分析,结果如图6所示。由图6可知,分别以(NH4)2SO4、尿素、NH4Cl和NaNO3为氮源时,重组菌的生长情况较差,影响到目的蛋白proCPB的胞外表达,一方面可能是无机氮源营养相对较少,另一方面可能是重组菌利用无机氮源后会使培养基的pH下降,不利于菌体生长,从而不利于产酶。以酵母粉或蛋白胨为单一有机氮源时,菌体生长量和胞外proCPB表达量都不如复合氮源(对照),因此选择复合氮源作为最佳氮源。

图6 不同氮源对菌体生长和产酶的影响Fig.6 Effects of different nitrogen sources on the growth and proCPB production
2.7 金属离子对proCPB胞外表达量及菌体生长的影响
金属离子在维持细胞生长和酶活性构象方面具有重要作用,也是广泛酶反应的必要组成部分。为了研究不同金属离子对菌体生长和产酶的影响,分别向培养基中添加终浓度为1 mmol/L的MgSO4、CaCl2、MnSO4、FeCl3、ZnSO4、NiSO4、CoSO4和CuSO4,结果如图7所示。由图7可知,羧肽酶B的活性中心含有Zn2+,但Zn2+的添加并没有对菌体生长和proCPB的胞外表达起促进作用,反而产生了抑制,原因可能是虽然Zn2+能够提高proCPB的酶活力,但过量的Zn2+对细胞生长代谢具有毒性作用。Ni2+、Co2+和Cu2+明显抑制重组菌生长,Mg2+、Ca2+、Mn2+和Fe3+的添加对重组菌生长没有较大的影响,但Mg2+却能够促进产酶,添加Mg2+时胞外proCPB的表达量是对照的1.45倍。Mg2+为微量元素,是许多酶的重要辅助因子,对菌体生长和产酶具有不可或缺的作用。图7结果可知,Mg2+能够促进目的蛋白proCPB的表达,这与张文超等[24]的研究结果吻合。因此,选择Mg2+为最佳金属离子。

图7 不同金属离子对菌体生长和产酶的影响Fig.7 Effects of different metal ions on the growth and proCPB production
2.8 培养基添加剂对proCPB胞外表达量及菌体生长的影响
培养基添加剂在一定程度上能够改变细胞膜通透性从而促进目的蛋白的胞外分泌。已报道使用的培养基添加剂包括甘氨酸、Ca2+、有机溶剂(正戊醇,环己烷)、Tween-80、Tween-20、Triton X-100、SDS、Na+、Mg2 +、溴化十六烷基三甲铵(CTAB)、脯氨酸、甜菜碱、K-谷氨酸、蔗糖和山梨醇等[21]。因此选择考察山梨醇、Tween-80、甘氨酸、甜菜碱、Triton X-100和SDS这6种物质对proCPB胞外表达量及菌体生长的影响,结果如图8所示。由图8可知,分别向培养基中添加Tween-80、甘氨酸、甜菜碱和Triton X-100,重组菌的生长量略低于对照,但胞外proCPB的表达量却明显比对照少。SDS的添加对重组菌生长造成了很大的负面影响,胞外几乎没有目的蛋白。山梨醇对胞外proCPB表达量的提高具有一定促进作用,添加山梨醇时胞外proCPB的表达量是对照的1.22倍。山梨醇作为渗透压稳定剂,一方面能够促进目的蛋白的可溶性表达[25],另一方面能够维持环境渗透压稳定,从而有利于目的蛋白的胞外分泌。栗亚美等[21]研究发现,山梨醇对分泌表达具有明显促进作用,它能够提高外膜通透性,从而导致蛋白“渗漏”到培养基中。因此,选择山梨醇为最佳培养基添加剂。
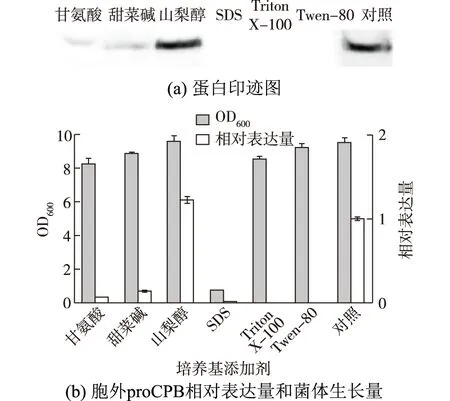
图8 不同培养基添加剂对菌体生长和产酶的影响Fig.8 Effects of different medium additives on the growth and proCPB production
2.9 正交试验结果
在单因素试验的基础上,采用正交试验对甘油、复合氮源、MgSO4、山梨醇、诱导温度和诱导时间6个因素各设5个水平进行分析。以原始LB培养基为对照,胞外proCPB的相对表达量为评价指标,正交试验结果与分析见表2和表3。由表2和表3可知,各因素对胞外proCPB表达量的影响从大到小为诱导时间、诱导温度、复合氮源、MgSO4、山梨醇、甘油,说明诱导时间对实验结果的影响最大,其次是诱导温度和复合氮源,甘油对实验结果的影响最小。由表3得出最佳组合为A3B3C5D2E4F1,即甘油7 g/L,复合氮源15 g/L、MgSO44 mmol/L、山梨醇0.3 mol/L、NaCl 10 g/L,诱导温度30 ℃,诱导时间24 h。在此优化条件下,胞外proCPB的相对表达量为6.35,是优化前的6.35倍,OD600为8.58,是优化前的2.64倍。
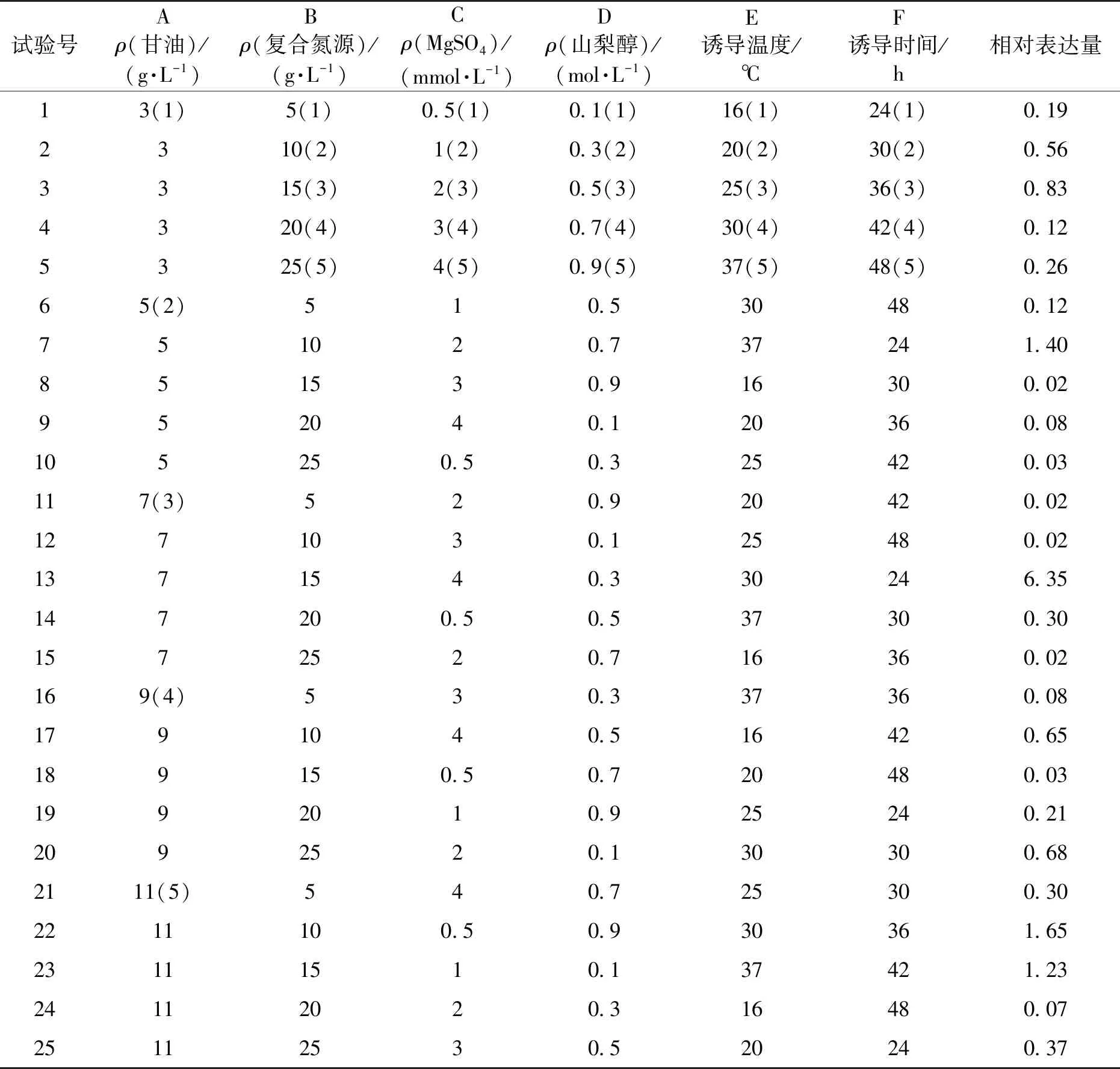
表2 正交试验设计与结果Table 2 Design and results of orthogonal experiments
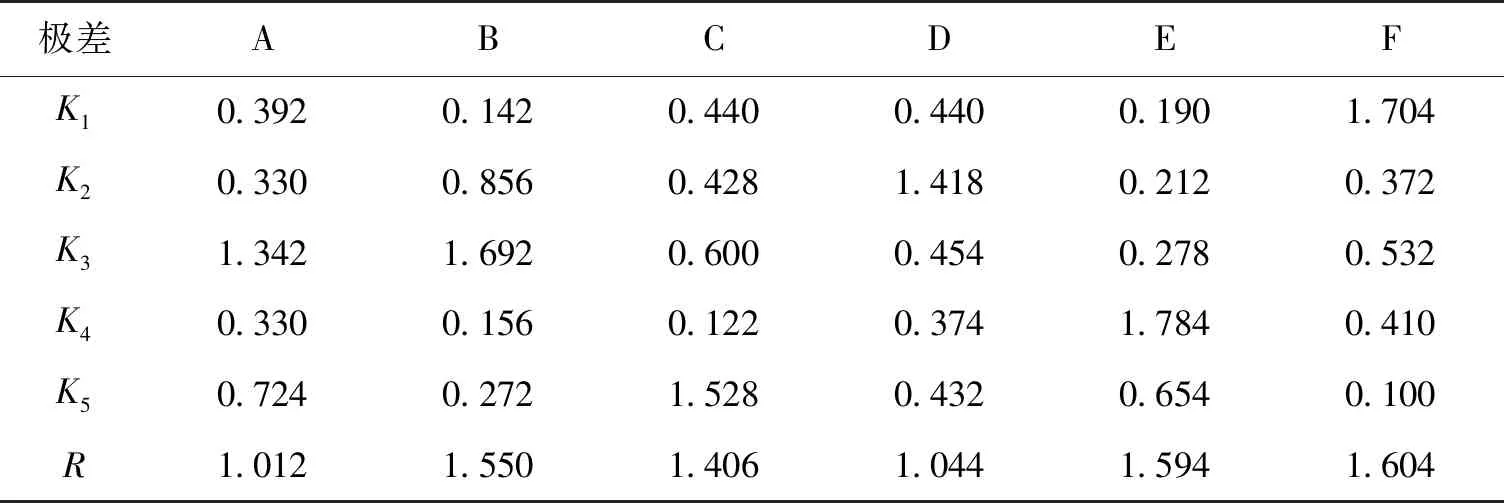
表3 正交试验极差分析Table 3 Range analysis of orthogonal experiment results
3 结论
在信号肽OmpA的引导下,鼠羧肽酶原B直接分泌到培养基中,首次实现了鼠源羧肽酶原B在大肠杆菌中的胞外分泌表达。经纯化及胰蛋白酶激活,得到活性CPB,比酶活为131.22 U/mg。以原始LB培养基为对照,proCPB胞外表达量为指标,通过单因素试验对培养基组成进行优化,确定最佳碳源为甘油,最佳氮源为复合氮源,最佳金属离子为Mg2+,最佳添加剂为山梨醇。在单因素试验的基础上,结合诱导温度和诱导时间进行六因素五水平的正交试验,最终得出最佳培养基组合为甘油7 g/L,复合氮源15 g/L、MgSO44 mmol/L、山梨醇0.3 mol/L、NaCl 10 g/L,最佳发酵条件为诱导温度30 ℃,诱导时间24 h。优化后,胞外proCPB的相对表达量为6.35,是优化前的6.35倍;OD600为8.58,是优化前的2.64倍,优化效果显著。
