刺激响应型水凝胶用于药物控释的研究进展
2020-12-29吴立煌李炜镧蔡晓军
吴立煌,李炜镧,蔡晓军
(1.南京工业大学 材料科学与工程学院,江苏 南京 211800;2.南京工业大学 药学院,江苏 南京 211800)
水凝胶(hydrogels)是通过物理或化学交联形成的、具有三维网络结构的聚合物体系,与人体组织具有极其相似的物理特性,因此可作为一种重要的生物医用材料。现已被广泛用于药物递送、组织工程、组织黏合以及生物传感等领域[1]。作为一种宏观载体,水凝胶可直接注射或植入到组织中,并于组织内形成稳定的药物储库,提高药物在病灶部位的浓度,因此常被用于制备局部药物递送系统[1]。
水凝胶可同时负载和运输多种亲疏水性药物,并在一定时间范围内通过扩散的方式释放出所携载药物。但此类释药方式具有自发和不可控性,无法根据生理和病理情况变化实现按需释药,因此在实际应用过程中往往会因局部药物浓度过高而产生较大的细胞毒性,目前传统的水凝胶药物递送系统已不能满足临床应用需求[2]。近年来,药物控制释放系统(Drug Controlled Release Systems,DCRS)的发展为这一难题提出了有效解决办法[2]。DCRS又称为可控给药系统,即药物在体内的运输与分布具有高度的时间、空间和剂量可控性的智能给药系统,其目的在于将适量药物于适宜时间精准递送到准确部位,从而减小药物的毒副作用,并提高治疗效果[2]。按给药方式的不同,DCRS被分为系统性靶向给药和局部给药。当药物递送系统经静脉、皮下或腹腔等途径注射到体内后,可在病灶部位响应代谢变化或特定生物分子,按需释放出合适剂量的药物[1]。制备DCRS所用的载体材料需要具备环境响应性,对于水凝胶药物控制释放系统而言,则需要设计可负载药物分子并具有环境响应性的水凝胶聚合物,从而实现在病灶组织内人为调控、按需释放药物分子,解决传统水凝胶药物载体的应用难题。
1 刺激响应型水凝胶的概述
通过对聚合物分子链设计,可制备出具有刺激响应性能的水凝胶。它们可在外界刺激因素(如温度、pH和酶等)的作用下,改变其溶胀和降解行为[2]。
在特定环境下可溶胀的水凝胶能用于制备可注射的局部药物递送系统。将水凝胶溶液注射到组织后,聚合物分子链可在组织环境的诱导下进行交联、溶胀,形成三维网络结构,避免药物在注射后随组织液的流动而流失,从而提高药物在组织内的滞留率。
在特定环境下可降解的水凝胶可实现药物在时间和空间上的高度可控释放。在组织内形成水凝胶后,聚合物中的敏感键或基团可在pH、光或酶等的作用下降解,使得水凝胶三维网络瓦解,并释放出所包裹的药物,实现药物的控制释放。
根据外界刺激环境的不同,可以把刺激响应型水凝胶分为:pH响应型水凝胶、温度响应型水凝胶、化学响应型水凝胶、光响应型水凝胶和磁响应型水凝胶等[2]。不同的外界刺激环境,需要水凝胶在分子结构上做出相应设计,从而使水凝胶网络表现出溶胀或降解行为。刺激响应型水凝胶作为智能药物递送系统在多种疾病的治疗上效果突出,因而在本文中,笔者综述了近年来刺激响应型水凝胶在智能药物递送领域的研究进展,并展望了其应用前景。
2 pH响应型水凝胶
pH响应型水凝胶可对水溶液的pH变化产生响应。人体不同组织部位具有不同的pH(如体液pH值为7.4左右,胃pH值为2.0左右),且病灶组织部位常伴随着pH的改变(如肿瘤细胞外环境pH值为6.5左右,肿瘤细胞内环境pH值为5.0左右)[2]。因此,pH响应型水凝胶可作为药物控制释放载体,当药物递送到特殊病灶部位后,可通过响应组织的pH变化来实现药物的控制释放[1]。
2.1 阴阳离子型pH响应水凝胶
对于阴离子水凝胶,在pH大于其解离常数(pKa)时,阴离子基团呈解离状态,大量阴离子的存在将产生大渗透压,使得水凝胶网络吸水溶胀;而当pH 小于 pKa时,阴离子基团质子化,从而使聚合物链之间的疏水作用增强,水凝胶网络排水收缩。反之,阳离子水凝胶在pH 小于pKa时溶胀,而在pH 大于 pKa时收缩。因此,具有阴阳离子基团的水凝胶的最大优势在于,可应用在pH发生改变的病灶组织部位,一方面可原位形成水凝胶药物递送系统,大大提高药物在局部组织内的浓度;另一方面可通过病灶部位pH的变化改变水凝胶的溶胀行为,实现药物的特异性释放。
2.2 共价键型pH响应水凝胶
另一类pH响应型水凝胶则含有pH敏感的共价键,如缩醛[3-4]、缩酮[5-6]、亚胺[7-10]和腙键[11-12]等。pH的变化将引起此类共价键的断裂,从而导致水凝胶网络的降解。具有pH响应共价键的水凝胶也因此被广泛用于智能药物递送系统的制备,在局部pH环境改变的情况下,特异性释放药物。该类水凝胶材料相比于阴阳离子型pH响应水凝胶具有更好的力学性能,不易因为组织运动而受到破坏,形成的药物储库更加稳定。
Hu等[10]设计制备了一系列智能型氨基糖苷类抗生素水凝胶(图1),此类水凝胶以氧化多糖(如右旋糖苷、羧甲基纤维素、海藻酸钠和软骨素等)为水凝胶聚合物骨架、氨基糖苷类抗生素(如奈替米星、丁胺卡那霉素、卷曲霉素和核糖霉素等)为交联剂。交联反应发生在氧化多糖的醛基和氨基糖苷类抗生素的氨基上,二者交联形成具有pH敏感性的席夫碱共价键,并最终形成具有pH敏感性的智能抗生素递送系统。值得注意的是,细菌滋生产生的大量质子将引起病灶部位局部酸化,进而引起了水凝胶网络的溶蚀、降解,并释放抗生素。此类水凝胶的突出优点是实现了抗生素的按需释放,且对革兰氏阴性菌和革兰氏阴性菌均表现出良好的抗菌效果,并在小鼠模型上取得了长期的抑菌效果。
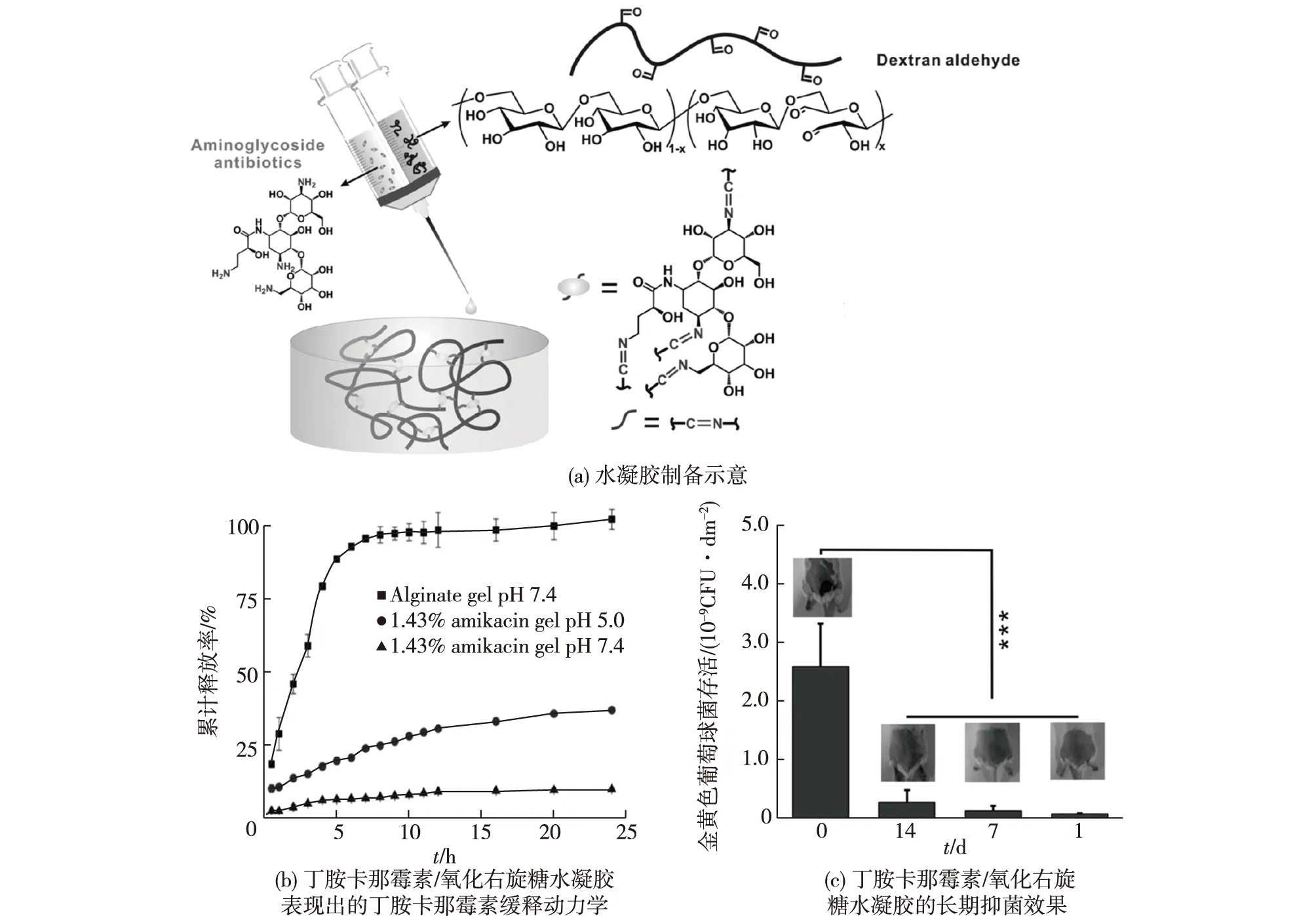
图1 具有高效抗菌性能的智能型氨基糖苷类水凝胶Fig.1 Smart aminoglycoside hydrogels with high antibacterial activity
3 温度响应型水凝胶
温度响应型水凝胶通常含有亲疏水基团,可在特定温度下进行相转变,使得水凝胶的形态随着溶胀度变化而改变,这一温度又被称为最低临界溶解温度(LCST)或最高临界溶解温度(UCST)[13]。
用于制备智能药物递送系统的温度响应型水凝胶通常为具有LCST的水凝胶。当环境温度低于LCST时,水凝胶聚合物链之间的疏水作用弱,表现出高度亲水、溶胀状态,使得水凝胶处于可注射状态;当温度达到或高于LCST时,水凝胶聚合物链之间的疏水相互作用大大增强,水凝胶排水收缩,形成致密的网络结构,其典型代表为聚(N-异丙基丙烯酰胺)(PNIPAm)及其类似物。PNIPAm类水凝胶具有在32 ℃左右的相转变温度,十分接近人体温度(37 ℃)。PNIPAm水溶液在其LCST之下处于聚合物链相对分散的状态,当注射到人体组织后,则可快速形成三维网络结构,从而被广泛用于制备可注射局部药物递送系统[14-16]。
4 化学响应型水凝胶
化学响应型水凝胶是一类可在特定分子的刺激下表现出溶胀或降解特性的水凝胶,典型代表有葡萄糖响应型水凝胶和酶响应型水凝胶。病灶部位常常伴随化学信号分子(如葡萄糖、酶等)水平的升高或降低,因此化学响应型水凝胶可作为智能药物递送系统,对特定病灶部位进行诊断和治疗。
4.1 葡萄糖响应型水凝胶
糖尿病是一种常见的全球流行性疾病,具有严重的并发症和较高的致死率。直接注射胰岛素可以有效治疗糖尿病,但须进行频繁检测和注射,给病人的生活带来诸多不便。因此,可针对这一病理特性设计可响应血液中葡萄糖变化的水凝胶材料。葡萄糖响应型水凝胶可作为葡萄糖传感器和胰岛素递送系统,在血糖升高时响应释放胰岛素,从而改善糖尿病的治疗效果和患者的生活质量[2]。常见的葡萄糖响应型水凝胶有葡萄糖氧化酶水凝胶、伴刀豆球蛋白A水凝胶和苯硼酸水凝胶。
将葡萄糖氧化酶包裹在水凝胶内部可制备葡萄糖氧化酶水凝胶。当体内的葡萄糖含量升高时,葡萄糖将扩散到水凝胶网络中,在葡萄糖氧化酶的催化下产生葡萄糖酸和H2O2,从而降低pH。因此可将葡萄糖响应与pH响应联用,制备多重响应水凝胶。由于该催化过程消耗O2,额外引入过氧化氢酶可催化降解H2O2,产生O2,从而提高水凝胶响应性并降低副作用[17-19]。
伴刀豆球蛋白A水凝胶由糖基聚合物骨架和伴刀豆球蛋白A组成,伴刀豆球蛋白A和聚合物骨架的糖单元特异性结合形成物理交联。当血液或组织液中的葡萄糖扩散到水凝胶内部时,由于伴刀豆球蛋白A与葡萄糖有更强的亲和力,葡萄糖将取代聚合物糖单元,提高水凝胶溶胀率甚至促进凝胶——溶胶转变[20-21]。
苯硼酸(PBA)水凝胶是一类研究较多的葡萄糖响应型水凝胶。该类水凝胶的交联依赖于PBA和二元醇之间形成的可逆共价键,当葡萄糖进入到水凝胶体系中,将与二元醇竞争与PBA的反应。由于葡萄糖上只有一个结合位点,当葡萄糖浓度升高,将降低水凝胶的交联密度,促进凝胶溶胀[22-24]。
Yesilyurt等[24]制备了端基为二元醇和苯硼酸(及其衍生物)的四臂聚乙二醇(PEG),可自发形成具有自修复功能的葡萄糖响应型水凝胶。该水凝胶载体具有良好的生物相容性,可作为细胞载体和大分子蛋白质的递送释放系统(图2)。由图2可知:在局部糖含量升高时,水凝胶可响应释放大分子蛋白。因此该水凝胶体系可作为大分子蛋白质药物尤其是胰岛素的智能递送系统,在血糖升高时按需释放胰岛素,从而反过来降低血糖浓度。
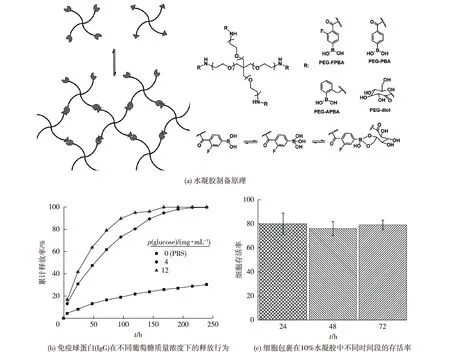
图2 自修复葡萄糖响应型水凝胶Fig.2 Self-healing glucose-responsive hydrogels
4.2 酶响应型水凝胶
除了葡萄糖响应型水凝胶,另一类重要的化学响应型水凝胶为酶响应型水凝胶。酶响应型水凝胶一般由酶响应型多肽组成,后者可在特定酶的催化作用下表现出构型改变或断裂特性,促进水凝胶的形成或降解。通常可利用的酶有:基质金属蛋白酶(MMP)[25-27]、磷酸酶[28-29]、胰蛋白酶[30-31]和酪氨酸酶[32]等。多肽可以设计为基团连接分子,在水凝胶骨架上连接药物,通过多肽在酶催化作用下断裂释放药物;也可设计为交联剂,作为水凝胶网络的组成部分包裹药物,酶催化引起水凝胶骨架的降解,从而促进药物的释放。
Purcell等[25]将透明质酸(HA)和硫酸葡聚糖(DS)利用MMP敏感的短肽序列交联起来,用于包裹MMP抑制剂(rTIMP-3),制备了可按需释放rTIMP-3的可注射水凝胶(图3)。MMP过表达是造成心肌梗死中左心室重塑的重要因素之一,会导致包括左心室壁变薄、心室扩大和功能紊乱等问题。通过将该水凝胶注射到猪心梗区域,可在MMP过表达的情况下破坏水凝胶网络,释放rTIMP-3而反过来降低MMP的水平,从而“按需”抑制MMP表达,减轻左心室不良重塑,改善左心室功能。该策略解决了MMP抑制剂全身用药的脱靶问题,实现了MMP含量的局部抑制效果。
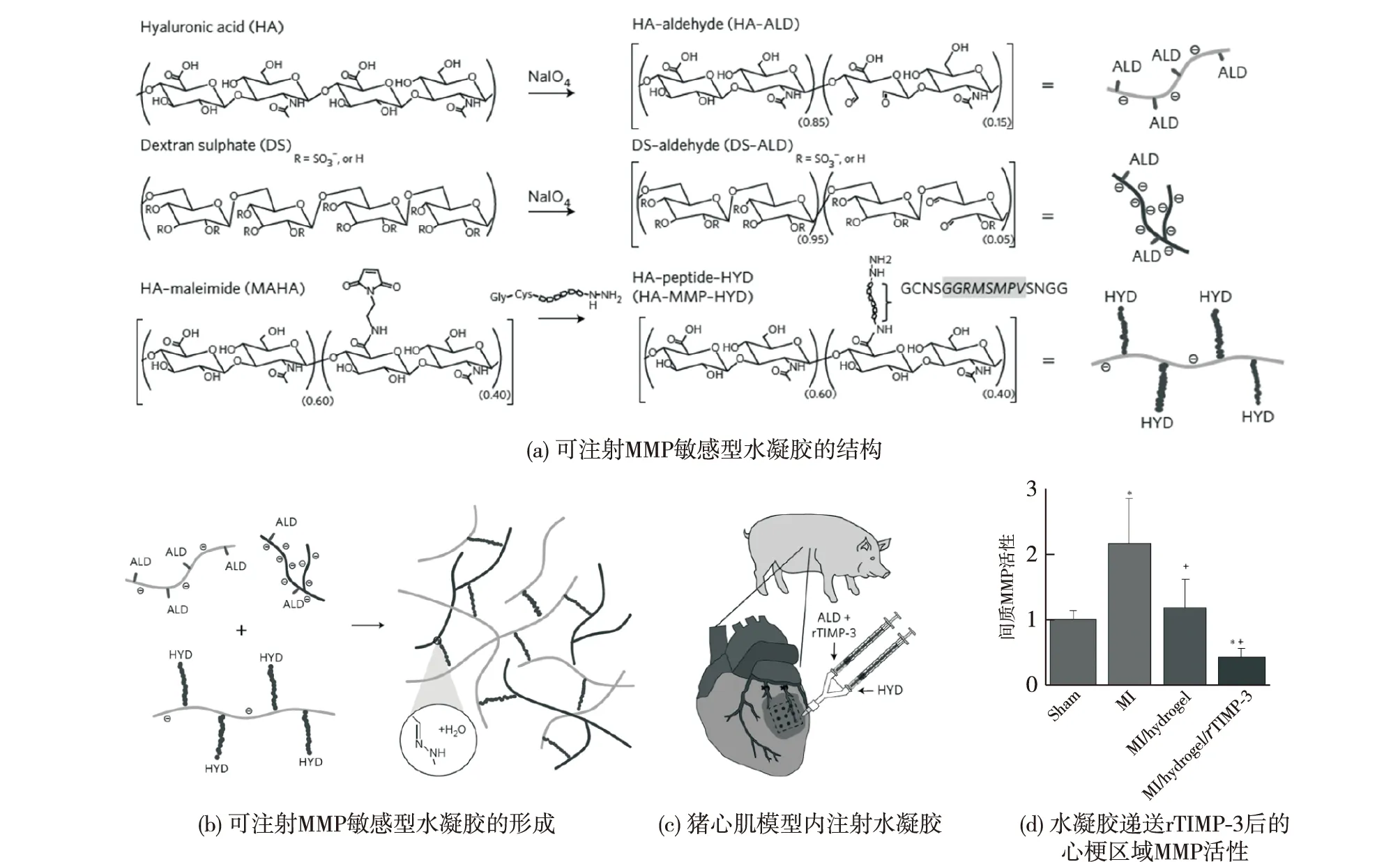
图3 可按需抑制MMP的生物响应型水凝胶Fig.3 Bio-responsive hydrogels for on-demand matrix metalloproteinase inhibition
另外,酶响应型水凝胶在分子设计上,还可以使用酯键[33]和核酸分子[34-35],分别在酯酶和核酸内切酶的作用下降解,从而制备可响应组织内酯酶和核酸内切酶的药物递送系统。
5 光响应型水凝胶
光响应型水凝胶是指可在一定波长的光(紫外光、可见光和近红外光等)照射下发生交联或降解的材料,主要分为光交联型水凝胶和光降解型水凝胶。
光交联型水凝胶可在光和光引发剂的共同作用下发生加成聚合或环化反应。将光交联型聚合物、光引发剂和药物混合注射到组织内部后,施加以一定剂量的光照,便可原位形成水凝胶药物载体。光交联型水凝胶的优势在于光源本身的非介入性和低毒甚至无毒性,以及光照的时间、空间可控性。但值得注意的是,光交联型水凝胶的制备过程需要添加额外的光引发剂,容易产生组织毒副作用,在选择光引发剂的时候应充分考虑其生物安全性。光交联型水凝胶常被用于制备局部药物递送系统。常用的光交联型聚合物主要含有丙烯酸类和香豆素等官能团。
另一类光响应型水凝胶为光降解型水凝胶,通常含有能在光辐照条件下发生断裂的基团(称为光敏基团),其中研究较为广泛的为邻硝基苄基(ONB)及其衍生物[36]。水凝胶聚合物链可通过酯化反应连接上ONB,在光辐照下,酯键断裂使得ONB脱落,从而改变水凝胶的溶胀性。光响应降解特性使得该类水凝胶被广泛用于制备疏水性药物递送系统,后者可在人为调控下,按需施加光照以促进疏水性药物在组织内的释放[37-39]。
Zhao等[38]以ONB-谷氨酸为交联点,制备了PEG、多肽复合的可注射自修复水凝胶。该水凝胶的交联点为ONB的疏水结构域,该结构域还可用于物理装载疏水药物阿霉素(Dox)。在紫外光的辐照下,水凝胶疏水结构域瓦解,释放Dox,引起HeLa细胞的快速凋亡(图4)。

图4 可用于抗癌药物递送的光响应型可注射水凝胶Fig.4 Photo-responsive injectable hydrogel for anticancer drug delivery
ONB的脱落通常采用紫外光(365 nm左右)进行激发。1990年后,随着双光子激发技术的发展,研究者进一步探究了各类光敏基团的双光子激发解离性能,ONB被证实可在近红外光刺激下吸收双光子而发生断裂[40-41]。这对于生物医药领域十分重要,采用组织穿透能力更强、光毒性更低的近红外光进行激发,可避免使用紫外光激发引起的毒副作用并提高治疗深度。
其他的光敏基团如蒽、肉桂酸以及上文提到的香豆素[36],也可在紫外单光子或近红外双光子的作用下解离,进而引起水凝胶的降解并释放药物。
利用光源进行可控药物释放拥有诸多优势,但该治疗手段也受到光源自身缺陷的限制。光对组织的穿透能力随波长的增加而提高,组织穿透深度通常仅有几毫米,对于近红外光而言,其组织穿透深度可达10 mm左右。因此光响应型水凝胶往往仅应用于浅表组织的治疗,难以到达深度组织部位。开发中、远红外区域的光响应型水凝胶或使用光导纤维是解决这一问题的有效手段。
6 磁响应型水凝胶
磁性纳米颗粒具有特殊的磁学性质,在外加磁场的作用下可在人体组织内靶向运输,因而可用于装载药物,制备磁靶向药物递送系统。磁响应型水凝胶是将磁性纳米颗粒与聚合物水凝胶复合制成的无机/有机复合材料,该材料同时具备了水凝胶的诸多优良特性和磁性材料的磁响应特性。磁响应型水凝胶作为药物载体,可将药物有效负载到水凝胶的三维网络结构中,并在外加磁场的作用下大大提高药物对病灶部位的靶向能力,并实现药物的控制释放[42]。磁性材料和聚合物水凝胶可通过物理掺杂法、接枝法和原位沉积法[42]制备磁响应型水凝胶,最常用的磁性材料为Fe3O4。
磁响应型水凝胶可用作远程控制的药物脉冲式释放系统,其原理在于:在未施加磁场时,磁响应型水凝胶内的药物通过自由扩散方式进行释放;当施加磁场时,水凝胶内的磁性颗粒聚集而使水凝胶三维网络结构收缩,孔隙率快速降低,导致药物分子束缚在水凝胶内部,药物释放率降低;当磁场再次关闭时,水凝胶恢复到原来的状态,进而提高药物释放速度。这种磁响应型的特殊的“ON/OFF”型药物释放机制使得磁响应型水凝胶可用于人为控制药物的释放率或模拟体内特殊肽和荷尔蒙的脉冲式释放,根据病情需要调节药物的释放,在糖尿病和癌症的治疗上面得到很广泛的应用[42]。
此外,磁性纳米颗粒还可以与温度响应型水凝胶结合以实现药物的脉冲式释放。在交变磁场作用下,磁性纳米颗粒由磁滞损耗引起的热效应将引起温度响应型水凝胶基质周围温度升高,使其改变溶胀状态,最终改变药物的释放速率[42]。利用这一机制,可设计温度/磁双响应型水凝胶。PNIPAm作为经典的温度响应型水凝胶,已被用于物理掺杂Fe3O4纳米颗粒,外加高频交变磁场使得水凝胶基质升温至30 ℃左右,水凝胶网络结构骤缩,导致药物(维生素B12)被挤压而快速释放出来[43]。不仅如此,磁响应型水凝胶还可以用于磁热疗(Magnetic hyperthermia)。磁性纳米颗粒在交变磁场下产生的热量可使组织局部升温,利用正常细胞和肿瘤细胞对温度变化的敏感差异性,局部升温可加速肿瘤细胞的凋亡,破坏肿瘤组织。因此,磁响应型水凝胶可实现药物释放和磁热疗双重功能,在肿瘤治疗领域有着潜在的应用前景[44]。
7 其他响应型水凝胶
除了上述几种典型的刺激响应型水凝胶外,其他刺激响应型水凝胶还包括氧化还原敏感型水凝胶[45-46]、剪切稀化响应型水凝胶[47-48]和离子响应型水凝胶[49-50]等。各种刺激响应型水凝胶的开发,极大地丰富了水凝胶的种类并拓宽了其在智能药物递送领域的应用。
8 总结与展望
刺激响应型水凝胶是一类极具多样化的智能型材料,不仅具有通常水凝胶的柔软、高度亲水性、良好的渗透性和生物相容性等,还具有时间、空间可控的刺激响应性。对水凝胶网络结构进行修饰,可赋予水凝胶多种可能性,这使得刺激响应型水凝胶在智能药物递送领域具有十分广阔的应用前景。近些年来,关于生物医用刺激响应型水凝胶的研究迅速发展,基于其中的一部分代表性工作,介绍了pH、温度、化学、光和磁响应型水凝胶的分子设计、刺激响应机制以及作为药物控制释放系统的具体应用。
经过全球科研工作者的共同努力,生物医用刺激响应型水凝胶领域的发展如今已越来越成熟,许多新型材料逐渐问世,并在药物控释领域得到广泛应用。但现有刺激响应型水凝胶的临床转化仍然面临诸多挑战,且获得美国食品药品监督管理局(FDA)批准而进入临床研究的材料少之又少。考虑到人体自身环境的复杂性,刺激响应型水凝胶的环境响应速度、溶胀性、降解性、机械性能和生物安全性等仍需要进行更深层次的考虑和改善。随着研究的不断深入,相信在不久的将来,刺激响应型水凝胶会有更大的发展空间,最终将在药物控制释放以及其他生物医学领域带来巨大变革,切实改善全人类的生活质量。
